Электролит восстанавливающий: Как восстановить аккумулятор автомобиля после глубокой разрядки
Как восстановить аккумулятор автомобиля после глубокой разрядки
Процесс разряда аккумуляторной батареи неизбежен, даже без нагрузки его ёмкость уменьшается, это естественный процесс. Если при движении автомобиля он не восстанавливает свою ёмкость, это неизбежно приведёт к ситуации, когда вы просто не сможете завести двигатель. Поэтому за состоянием АКБ нужно следить и, если требуется, подзаряжать его с помощью внешнего зарядного устройства. Сегодня мы расскажем, почему нельзя допускать полного разряда батареи, чем это грозит и что делать в таких ситуациях.
О вреде глубокого разряда
Наверное, каждый водитель наслышан о том, что тот или иной тип автомобильной батареи рассчитан на определённое количество циклов заряда-разряда. Разумеется, это чисто теоретические значение – на практике их могут корректировать в ту или иную сторону целый ряд разноплановых факторов.
Давайте освежим в памяти принцип функционирования классического кислотного аккумулятора.
Когда аккумулятор используется как источник электроэнергии, то есть находится под нагрузкой, серная кислота оседает на электродах (пластинах) АКБ и реагирует с металлом, образуя соли. А поскольку плотность кислоты намного выше, чем у воды, изменение соотношения этих двух компонентов электролита приводит к уменьшению его плотности. При зарядке (как от генератора, так и ЗУ) происходит обратный процесс – соль распадается на кислоту и свинец (диоксид свинца), а концентрация дистиллированной воды, наоборот, понижается, и плотность электролитической жидкости по теории должна вернуться к исходному значению. На практике некоторое количество солей со временем начинает накапливаться на пластинах, не участвуя в химических реакциях, в результате ёмкость аккумулятора со временем начинает уменьшаться.
Но стоит батарее разрядиться сильнее обычного – и объём осевших на положительных электродах солей начинает возрастать, а плотность падать. В конце концов, она достигнет порогового значения, при котором запуск двигателя становится проблематичным или невозможным.
Вы спросите, в чём проблема? Ну, разрядился АКБ почти в ноль, но поставим его на подзарядку, и через пару часов можно снова отправляться в путь!
Увы, но не всё так просто. Дело в том, что, когда соли становится на пластинах слишком много, при зарядке аккумулятора обратной химической реакции могут подвергаться не 100% кристаллов, а немногим меньше – часть солей так и остаётся на пластине. При обычном, некритичном разряде батареи такого не происходит. А если часть площади электрода не покрыта металлом, то соответствующим образом уменьшается и его ёмкость, то есть способность к восстановлению заряда.
При обычном, некритичном разряде батареи такого не происходит. А если часть площади электрода не покрыта металлом, то соответствующим образом уменьшается и его ёмкость, то есть способность к восстановлению заряда.
Из практики известно, что один глубокий разряд аккумулятора приводит к потере ёмкости в пределах 2-4%. Это много. 8-10 таких ситуаций – и ёмкость безвозвратно упадёт на 30%, и этого будет достаточно, чтобы батарея была бессильна в попытках прокрутить коленвал мотора.
Вот вам и ответ на вопрос, почему так опасен глубокий разряд автомобильного аккумулятора и сколько раз можно допускать такую ситуацию без серьёзных последствий для батареи.
Что делать, чтобы АКБ полностью не садилась? Ответы можно взять из других статей, мы же сосредоточимся на том, можно ли реанимировать аккумулятор, если неприятность уже произошла. Но об этом – чуть позже.
youtube.com/embed/3z8MaN-BqsQ?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Почему ГР вреден для аккумулятора
Резюмируя вышесказанное, опишем вред глубокого разряда как можно проще и лаконичнее: в подобных ситуациях слой осевшей соли свинца на электродах оказывается таким толстым, что десульфатация в таких же объёмах оказывается невозможной. Полезная площадь пластин уменьшается, процесс заряда будет протекать не полностью, уменьшая время работы АКБ и увеличивая риск возникновения повторного глубокого разряда. В конце концов, после очередного такого повторения АКБ окажется не подлежащей восстановлению.
Производители утверждают, что теоретический предел для свинцовых АКБ – от 15 до 20 циклов, но на практике достаточно и 10 глубоких разрядов, чтобы зимой такой аккумулятор оказался бесполезным.
youtube.com/embed/0U-k-zV23HQ?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Можно ли реанимировать полностью севший аккумулятор
Сразу отметим, что наиболее критичными к ГР являются кислотный АКБ. А вот кислотные АКБ. Но есть типы автомобильных аккумуляторов, которые в гораздо меньшей степени боятся глубокого разряда. Это гелевые и AGM батареи, они способны выдерживать полный разряд намного большее количество раз. Что не означает, что к уходу за ними следует относиться менее требовательно.
Итак, мы уже знаем, что при глубоком разряде происходит мощная сульфатация пластин, принимающая необратимый характер. Но так ли необратим этот процесс?
Оказывается, придумано немало способов, как избавить электроды от вредоносной соли и реанимировать батарею. Успешность всех подобных мероприятий зависит от того, насколько быстро вы их осуществите.
Излишки солевого налёта на пластинах можно попробовать удалить физически:
- если аккумулятор разборный, слить электролит и вынуть пластины;
- произвести очистку электродов от соли с помощью любого подходящего предмета или инструмента;
- зачистить пластину мягкой наждачной бумагой;
- произвести обратный монтаж, залить свежий электролит.

На деле основная проблема заключается в первом пункте – даже в разборных аккумуляторах демонтировать пакет с пластинами – задача нетривиальная, зачастую её невозможно решить без разрезания корпуса АКБ. Если съёмной оказывается только крышка, доступ к пластинам будет сильно ограничен, и качественная очистка электродов будет делом очень нелёгким.
Проблемы могут возникнуть и на этапе сбор батареи, ведь её корпус должен быть идеально герметичным. Так что на практике этот способ используется редко.
А вот применение специальных составов для реанимации АКБ после глубокого разряда – способ, пользующийся повышенной популярностью. Такие десульфаторы призваны разъедать соли свинца, но метод не всегда срабатывает. Шансы повышаются, если у вас ГР произошёл впервые, и времени прошло немного. С застарелыми солевыми налётами такие средства могут и не справиться.
Можно ли восстановить работоспособность литиевых аккумуляторов
Хотя литиевые батареи по многим показателям превосходят кислотно-свинцовые, они имеют целый ряд противопоказаний, которые не позволяют использовать их массово. В частности, они боятся отрицательных температур и плохо переносят как перезаряд, так и глубокий разряд.
В частности, они боятся отрицательных температур и плохо переносят как перезаряд, так и глубокий разряд.
Можно ли зарядить литиевый аккумулятор автомобиля при глубоком разряде? Давайте разбираться.
В таких АКБ предусмотрена защита от воспламенения, реализуемая с помощью достаточно сложной и дорогостоящей схемой. Одной из её компонентов является специальный диод, который при наступлении «часа Х» переполюсуется, не пропуская заряд в требуемом направлении. Чтобы зарядка осуществлялась, его нужно активировать. Это достигается при подаче напряжения номиналом 3,10-3,20 В. Самостоятельно такую операцию проводить настоятельно не рекомендуется.
Восстановление свинцово-кислотного аккумулятора после глубокого разряда
Несколько достаточно кардинальных способов мы уже описали. Но существуют и другие, не требующие вмешательства в конструкцию батареи. Например, можно попробовать многократную зарядку при условии применения тока малого номинала.
Заряжать аккумулятор после глубокого разряда для восстановления его ёмкости можно и методом подачи высокого напряжения на протяжении довольно длительного промежутка времени. Способ, требующий нескольких итераций.
Способ, требующий нескольких итераций.
Часто применяют и более трудоёмкий способ вывести АКБ из «комы»: осуществляют полную зарядку, затем сливают весь электролит, осуществляют промывку сначала обычной водой, а затем спецсредством (например, раствором аммиака с добавлением двухпроцентного трилона Б). Промывку осуществляют по закрытому контуру 30-45 минут, после чего раствор сливают и промывают батарею дистиллированной водой. И только после этого заливают свежий электролит и ставят АКБ на зарядку.
Отметим, что эффективность всех описанных способов невелика, особенно если батарея подвергалась полному разряду неоднократно.
Как восстановить автомобильный аккумулятор содой?
Аккумуляторная батарея автомобиля, даже при бережном использовании, через 3 — 5 лет эксплуатации приходит в негодность. Связано это с тем, что пластины АКБ покрываются сульфатом, и из-за этого ёмкость батареи значительно падает. Источник питания больше не может обеспечивать автомобиль электричеством в нужном объёме и с необходимой силой тока. Однако, не стоит торопиться выбрасывать аккумулятор — его можно попробовать восстановить с помощью обыкновенной кухонной соды.
Связано это с тем, что пластины АКБ покрываются сульфатом, и из-за этого ёмкость батареи значительно падает. Источник питания больше не может обеспечивать автомобиль электричеством в нужном объёме и с необходимой силой тока. Однако, не стоит торопиться выбрасывать аккумулятор — его можно попробовать восстановить с помощью обыкновенной кухонной соды.
Помогает ли сода восстановить аккумулятор?
Несмотря на недоверие некоторых автовладельцев к такому способу восстановления АКБ, содой, действительно, можно реанимировать источник питания для транспортного средства. Суть метода заключается в вытравливании сульфата со свинцовых пластин с помощью соды. Именно из-за сульфата чаще всего батарея становится негодной.
Такой способ нельзя назвать стопроцентной гарантией восстановления.
Он поможет только в том случае, если автомобильный аккумулятор потерял ёмкость при покрытии пластин сульфатом. Вернуть к жизни батарею со вздутыми полостями или осыпавшимися пластинами таким образом не получится.
Как восстановить?
Перед началом работы нужно учитывать, что в аккумуляторе используются агрессивные вещества, которые при попадании на кожу могут нанести непоправимый вред. Рекомендуется использовать для реанимации АКБ резиновые перчатки и защитные очки.
Прежде чем начать восстанавливать батарею следует замерить напряжение на ней как обычным тестером, так и нагрузочной вилкой. При холостом замере результат может быть более-менее удовлетворительный, а под нагрузкой напряжение заметно просядет. Это означает, что батарея утратила ёмкость и больше не может держать заряд.
При этом желательно замерить плотность электролита.
Сам процесс восстановления начинается со слива электролита в отдельную ёмкость. Делать это нужно аккуратно с помощью ареометра, насколько это будет возможно с помощью такого прибора. Электролит будет грязно-серого цвета. Остаток жидкости сливается в другую ёмкость очень осторожно, так чтобы струи не замкнулись между собой. Для этого нужно соблюдать строго горизонтальное положение отверстий банок при переворачивании корпуса. Оставшийся электролит получится ещё грязнее, почти чёрного цвета.
Для этого нужно соблюдать строго горизонтальное положение отверстий банок при переворачивании корпуса. Оставшийся электролит получится ещё грязнее, почти чёрного цвета.
Далее корпус аккумулятора помещается в большой таз или ванну, и вымывается от остатков грязного электролита обычной проточной водой из крана. Сделать это лучше несколько раз, чтобы банки были максимально чистыми.
После промывки можно приступить к вытравливанию сульфата. Для этого потребуется 500 г пищевой соды (можно меньше), а также 5 литров воды. Оба компонента нужно хорошо перемешать, чтобы вся сода растворилась. Полученную жидкость нужно залить в каждую полость АКБ до краёв. Этот процесс будет сопровождаться бурлением. Часть раствора выльется наружу. По мере опустошения, его нужно подливать в банки пока реакция не прекратится.
Теперь все полости нужно опять тщательно промыть проточной водой несколько раз, и дать внутренним поверхностям хорошо просохнуть.
Заливать можно старый электролит — покупать новый необязательно. Главное его хорошо отфильтровать. Для этого нужно в пластиковую воронку вложить синтетическую салфетку так, чтобы она полностью перекрыла отверстие.
Главное его хорошо отфильтровать. Для этого нужно в пластиковую воронку вложить синтетическую салфетку так, чтобы она полностью перекрыла отверстие.
Электролит переливается из одной ёмкости в другую через неё, а затем равномерно распределяется по банкам аккумулятора. После того как все пузырьки выйдут можно закрыть крышки ёмкостей.
Если проверить заряд на АКБ сразу, разницы почти не будет. Тем не менее после полноценной зарядки напряжение источник питания будет держать хорошо ещё долгое время.
Этот способ очень хорош, но, к сожалению, помогает не во всех ситуациях.
Повышение плотности электролита в АКБ
В холодное время года или после длительного простоя могут появиться проблемы с запуском двигателя. Это происходит из-за севшей АКБ. Длительная зарядка батареи не помогает справиться с этой проблемой, если плотность электролита значительно снизилась.
Это происходит из-за севшей АКБ. Длительная зарядка батареи не помогает справиться с этой проблемой, если плотность электролита значительно снизилась.
Почему снижается плотность
Плотность электролита изменяется во время использования аккумулятора. Когда батарея теряет заряд, показатель понижается, и наоборот. Очень низкая плотность электролита связана со следующими причинами:
- Влияние низких температур в течение длительного времени;
- Перезаряд АКБ, вследствие чего происходит выкипание электролита;
- Регулярное добавление воды.
Воду в электролит доливать можно, но перед этим нужно проверять его плотность и не проводить процедуру без необходимости. Делайте замеры в каждой банке. Нормальные значения – от 1,25 до 1, 29. Чем холоднее регион, тем выше должна быть плотность.
Как повысить плотность
Чтобы провести процедуру повышения плотности, следуйте плану.
- Зарядите батарею (если АКБ разряжена, то при добавлении раствора, поднимется концентрация серной кислоты – пластины разрушается).
- Температура электролита должна быть от 20 до 25 градусов.
- Осмотрите аккумулятор: на нем не должно быть дефектов и повреждений, особое внимание уделите токовыводам.
- Если уровень в норме (от 1,18) долейте электролит с нормальной плотностью до 1,25.
- Выполняйте долив в каждой банке, используя клизму-грушу.
- Потрясите аккумулятор, чтобы новый раствор перемешался со старым.
Что делать при минимальной плотности
Если уровень упал ниже 1,18 долив электролита не поможет. Используйте аккумуляторную кислоту − у нее очень высокая плотность (1,84). Заливайте кислоту по описанной выше схеме. Выполняйте процедуру в защитной одежде, перчатках и маске в хорошо проветриваемом помещении или на открытом воздухе. Следите, чтобы кислота не попала на кожу – может появиться ожог.
Повышение плотности зарядным устройством
Повысить плотность электролита можно при помощи слабого тока. Такой способ требует больше времени.
- Полностью зарядите АКБ.
- Жидкость начнет выкипать, произойдет испарение дистиллированной воды.
- Общий уровень электролита понизится.
- Долейте новый электролит необходимой плотности.
- Сделайте замеры ареометром.
- Если показания недостаточны, повторите процедуру, пока плотность не достигнет 1,25 г/см3.
Не спешите выбрасывать аккумулятор, если машина стала плохо заводиться. Попробуйте восстановить АКБ методом повышения плотности электролита. Это займет немного времени, но продлит жизнь батареи на несколько сезонов и сэкономит деньги.
А чтобы продлить жизнь своему акб, соблюдайте простые правила ухода. Читайте.
Гальванические и электролитические элементы | Электрохимические реакции
Электрохимические реакции (ESCR4)
В 11 классе вы провели эксперимент, чтобы увидеть, что происходит, когда гранулы цинка добавляются в раствор сульфата меди (II). {2 +} \) из раствора \ (\ color {blue} {\ textbf {синий сульфат меди (II)}} \) были восстановлены (получили электроны ) до металлической меди, которая затем была нанесена в виде слоя на твердый цинк.{2 +} \)) получают два электрона и осаждаются в виде твердой меди.
{2 +} \) из раствора \ (\ color {blue} {\ textbf {синий сульфат меди (II)}} \) были восстановлены (получили электроны ) до металлической меди, которая затем была нанесена в виде слоя на твердый цинк.{2 +} \)) получают два электрона и осаждаются в виде твердой меди.
(Фото benjah-bmm27 и Jurii в Википедии)
Помните, что когда вы проводили этот эксперимент, температура реакции повысилась (он был экзотермическим). Экзотермическая реакция высвобождает энергию . Это вызывает несколько вопросов:
Возможно ли преобразование этой тепловой энергии в электрическую?
Можем ли мы использовать химическую реакцию с обменом электронами для производства электричества?
Если бы мы подали электрический ток, могли бы мы, , вызвать какую-нибудь химическую реакцию?
Ответам на эти вопросы и посвящена данная глава:
Энергия химической реакции может быть преобразована в электрическую потенциальную энергию, которая образует электрический ток.

При переносе электронов в химической реакции может протекать электрический ток.
Если вы подаете электрический ток, он может вызвать химическую реакцию, подавая электроны (и потенциальную энергию), необходимые для реакций, протекающих внутри элемента.
Эти типы реакций называются электрохимическими реакциями . Электрохимическая реакция — это реакция, в которой:
химическая реакция создает разность электрических потенциалов и, следовательно, электрический ток во внешних проводящих проводах
или
электрический ток обеспечивает электрическую потенциальную энергию и электроны, поэтому происходит химическая реакция
- Электрохимическая реакция
Электрохимическая реакция включает перенос электронов.
 Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.
Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.
Электрохимия — это раздел химии, изучающий эти электрохимические реакции. Электрохимическая ячейка — это устройство, в котором происходят электрохимические реакции.
- Электрохимическая ячейка
Устройство, в котором происходят электрохимические реакции.
Присоединяйтесь к тысячам учеников, улучшающих свои научные оценки онлайн с помощью Siyavula Practice.
Зарегистрируйтесь здесьЭлектрохимические реакции
Упражнение 13.3\ (\ text {CuO} (\ text {s}) + \ text {H} _ {2} (\ text {g}) \) \ (\ to \) \ (\ text {Cu} (\ text {s}) + \ text {H} _ {2} \ text {O} (\ text {g}) \)
Степень окисления \ (\ text {O} \) равна \ (- \ text {2} \). {2 -} \) равна \ (- \ text {8} \).{2 +} \) получает два электрона и превращается в \ (\ text {Fe} \). Железо уменьшено на .
{2 -} \) равна \ (- \ text {8} \).{2 +} \) получает два электрона и превращается в \ (\ text {Fe} \). Железо уменьшено на .
\ (\ text {Zn} (\ text {s}) + 2 \ text {AgNO} _ {3} (\ text {aq}) \) \ (\ to \) \ (2 \ text {Ag} ( \ text {s}) + \ text {Zn} (\ text {NO} _ {3}) _ {2} (\ text {aq}) \)
Степень окисления иона \ (\ text {NO} _ {3} \) равна \ (- \ text {1} \) как реагент и как продукт.
Степень окисления \ (\ text {O} \) равна \ (- \ text {2} \). \ (\ text {O} \) не окисляется и не восстанавливается.{2 -} \)
Существует два типа электрохимических ячеек, которые мы рассмотрим более подробно в этой главе: гальванические ячейки и электролитические ячейки . Прежде чем мы подробно рассмотрим гальванические и электролитические ячейки, вам необходимо знать несколько определений:
- Электрод
Электрод — это электрический проводник, который соединяет электрохимические частицы из раствора с внешней электрической цепью ячейки.

В электрохимической ячейке есть два типа электродов: \ (\ color {blue} {\ textbf {anode}} \) и \ (\ color {red} {\ textbf {cathode}} \).
\ (\ color {blue} {\ text {Oxidation}} \) всегда встречается в \ (\ color {blue} {\ textbf {anode}} \), а \ (\ color {red} {\ text {сокращение }} \) всегда встречается в \ (\ color {red} {\ textbf {cathode}} \). Поэтому, пытаясь определить, на какой электрод вы смотрите в первую очередь, определите, происходит ли там окисление или восстановление.Легкий способ запомнить это:
Окисление — потеря электронов .
Редукция — это усиление электронов .
\ (\ color {blue} {\ textbf {O}} \) xidation \ (\ color {blue} {\ textbf {i}} \) s \ (\ color {blue} {\ textbf {l }} \) осс электронов | \ (\ color {blue} {\ textbf {OIL}} \) |
\ (\ color {red} {\ textbf {R}} \) образование \ (\ color {red} {\ textbf {i}} \) s \ (\ color {red} {\ textbf {g}} \) в электронах | \ (\ color {red} {\ textbf {RIG}} \) |
\ (\ color {blue} {\ textbf {O}} \) xidation — это \ (\ color {blue} {\ textbf {l}} \) скопление электронов на узел \ (\ color {blue} {\ textbf {a}} \) | \ (\ color {blue} {\ textbf {An Ox}} \) |
\ (\ color { red} {\ textbf {Red}} \) действие — это прирост электронов на участке \ (\ color {red} {\ textbf {cat}} \) | \ (\ color {red} {\ textbf { Красный кот}} \) |
Таблица 13. 1: Краткое изложение фраз, которые помогут вам запомнить правила окисления и восстановления.
1: Краткое изложение фраз, которые помогут вам запомнить правила окисления и восстановления.
Электрод помещается в раствор электролита внутри ячейки. Если ячейка состоит из двух отсеков, эти отсеки будут соединены солевым мостиком .
- Электролит
Электролит — это раствор, который содержит свободные ионы и поэтому ведет себя как проводник заряда (электрический проводник) в растворе.
- Соляной мост
Солевой мостик — это материал, который содержит раствор электролита и действует как соединение между двумя полуэлементами (замыкает цепь). Он поддерживает электрическую нейтральность внутри и между электролитами в отсеках полуэлементов.
Гальванические элементы (ESCR5)
Гальванический элемент (который также иногда называют вольтовым элементом или влажным элементом ) состоит из двух полуэлементов, которые преобразуют химическую потенциальную энергию в электрическую потенциальную энергию.
- Гальванический элемент
Гальванический элемент — это электрохимический элемент, который преобразует химическую потенциальную энергию в электрическую потенциальную энергию посредством спонтанной химической реакции.
В гальваническом элементе два полуэлемента. Каждая полуячейка содержит электрод в электролите. Разделение необходимо для предотвращения прямого химического контакта реакций окисления и восстановления, создающего разность потенциалов. Электроны, высвобождаемые в реакции окисления, проходят через внешнюю цепь (и выполняют работу), прежде чем будут использованы в реакции восстановления.{+} (\ text {aq}) \) раствор электролита.
Электроны, высвобождаемые в \ (\ color {blue} {\ textbf {окисление}} \) металла, остаются на \ (\ color {blue} {\ textbf {анод}} \), в то время как катионы металла образуются перейти в раствор.
Металл на катоде — Y. {+} (\ text {aq}) + \ text {Y} (\ text {s}) \) .{+} {\ textbf {(aq)}}} \) \ (| \) \ (\ color {red} {\ textbf {Y (s)}} \)
{+} (\ text {aq}) + \ text {Y} (\ text {s}) \) .{+} {\ textbf {(aq)}}} \) \ (| \) \ (\ color {red} {\ textbf {Y (s)}} \)
Условно:
\ (\ color {blue} {\ textbf {anode}} \) всегда пишется на \ (\ color {blue} {\ textbf {left}} \).
\ (\ color {red} {\ textbf {cathode}} \) всегда пишется на \ (\ color {red} {\ textbf {right}} \).
Анодная и катодная полуэлементы разделены знаком \ (|| \), представляющим солевой мостик.
Различные фазы в каждой полуячейке (твердая (ые) и водная (водн.) Здесь) разделены знаком \ (| \).
Электроды в каждой полуячейке соединены проводом во внешней цепи. Между отдельными полуячейками существует также солевой мостик.
Гальванический элемент использует реакции, которые происходят на двух электродах, для производства электроэнергии, т. е.е. реакция происходит без необходимости добавления энергии.
е.е. реакция происходит без необходимости добавления энергии.
Спонтанная реакция — это реакция, которая происходит без потребности во внешней энергии. Обратитесь к подразделу о спонтанности для получения дополнительной информации.
Реакцию цинка и меди, которую вы провели в 11 классе, можно изменить, чтобы получить гальванический элемент. Слитки цинка и меди используются в качестве электродов , с растворами сульфата цинка (II) и сульфата меди (II) в качестве электролитов .
В эксперименте с гальваническим элементом убедитесь, что паста хлорида натрия имеет высокую концентрацию и заполняет U-образную трубку для достижения наилучших результатов.{-3} $} \)), \ (\ text {NaCl} \) вставить
Измерительные весы, две \ (\ text {250} \) \ (\ text {ml} \) мензурки, U-образная трубка, вата, амперметр с нулевым центром, соединительный провод.
Чистящий этанол, эфир (при наличии)
Метод
Взвесьте медные и цинковые пластины и запишите их массу.

Налейте \ (\ text {200} \) \ (\ text {ml} \) раствор сульфата цинка в стакан и поместите цинковую пластинку в стакан.
Налейте \ (\ text {200} \) \ (\ text {ml} \) раствор сульфата меди (II) во второй стакан и поместите медную пластину в стакан.
Заполните U-образную трубку пастой \ (\ text {NaCl} \) и заклейте концы трубок ватой (образуя солевой мостик). Ватка поможет предотвратить растворение пасты в электролите.
Подключите цинковую и медную пластины к амперметру с нулевым центром и наблюдайте за амперметром.
Поместите U-образную трубку так, чтобы один конец находился в растворе сульфата меди (II), а другой конец — в растворе сульфата цинка. Наблюдайте за амперметром.
Снимите амперметр и соедините медную и цинковую пластины друг с другом напрямую с помощью медной проволоки.
 Оставить постоять примерно на сутки.
Оставить постоять примерно на сутки.Через день снимите две пластины и промойте их: сначала дистиллированной водой, затем спиртом и, наконец, эфиром (если есть).Просушите тарелки феном.
Взвесьте цинковые и медные пластины и запишите их массу.
Примечание
Вольтметр также можно использовать вместо амперметра с нулевым центром. Вольтметр с нулевым центром будет измерять разность потенциалов на ячейке (а не поток электронов), а амперметр будет измерять ток.
Обсуждение
Амперметр записал показания до того, как солевой мостик был помещен в растворы?
Амперметр записал показания после того, как солевой мостик был помещен в растворы? Если да, то в каком направлении течет ток?
Заполните таблицу ниже:
Пластина
Начальная масса
Конечная масса
Цинк
6
Как изменилась масса цинковых и медных пластин?
На основании того, что вы знаете об окислении и восстановлении, почему произошли эти массовые изменения?
Какой электрод является анодом, а какой катодом?
Результаты
В ходе эксперимента вы должны были заметить следующее:
При отсутствии соляного мостика на амперметре не было показаний.

Когда был подключен солевой мостик, показания были записаны на амперметре.
Направление потока электронов — от цинковой пластины к медной пластине, что означает, что обычный ток течет от медной пластины к цинковой пластине.
После того, как пластины были соединены напрямую друг с другом и оставлены на сутки, их масса изменилась.Масса цинковой пластины уменьшилась, а масса медной пластины увеличилась.
\ (\ color {blue} {\ textbf {O}} \) xidation \ (\ color {blue} {\ textbf {i}} \) s \ (\ color {blue} {\ textbf {l}} \ ) осс электронов, \ (\ color {red} {\ textbf {R}} \) выделение \ (\ color {red} {\ textbf {i}} \) s \ (\ color {red} {\ textbf { G}} \) ина электронов.
Цинковый электрод потерял массу. Это означает, что твердые атомы металлического Zn становятся ионами и переходят в раствор электролита: \ (\ text {Zn} (\ text {s}) \) \ (\ to \) \ (\ text {Zn} ^ {2+} (\ text {aq}) + 2 \ text {e} ^ {-} \).
 {-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде.
{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде.\ (\ color {blue} {\ textbf {Ox}} \) idation — потеря электронов при оде \ (\ color {blue} {\ textbf {an}} \). Окисление происходит на цинковом электроде, поэтому цинковая пластина является анодом.
\ (\ color {red} {\ textbf {Red}} \) действие — это прирост электронов на пути \ (\ color {red} {\ textbf {cat}} \). Восстановление происходит на медном электроде, поэтому медная пластина является катодом.Ионы {2 +} \) произошли здесь, чтобы произвести больше металлической меди.
В этом эксперименте важно отметить следующее:
химические реакции, которые происходят на двух электродах, вызывают электрический ток, протекающий через внешнюю цепь
общая реакция должна быть спонтанной окислительно-восстановительной реакцией
химическая энергия преобразуется в электрическую энергию
цинк-медный элемент является одним из примеров гальванического элемента
Итальянский врач и анатом Луиджи Гальвани ознаменовал рождение электрохимии, установив связь между химическими реакциями и электричеством.
 В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».
В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».В цинко-медной ячейке медная и цинковая пластины являются электродами . Соляной мостик играет очень важную роль в гальваническом элементе:
Раствор электролита состоит из катионов металлов и анионов-спектаторов.{+} \) ионы перемещаются из солевого мостика в отсек катодной полуячейки.
Солевой мостик действует как среда переноса, которая позволяет ионам проходить через них, не позволяя различным растворам смешиваться и напрямую реагировать. Это позволяет уравновесить заряды в растворах электролита и позволяет реакциям в ячейке продолжаться.
Без солевого мостика поток электронов во внешнем контуре полностью прекращается. Это потому, что соляной мостик необходим для замыкания цепи.

Электролитические ячейки (ESCR6)
В электролизере электрическая потенциальная энергия преобразуется в химическую потенциальную энергию. Электролитическая ячейка использует электрический ток, чтобы вызвать конкретную химическую реакцию, которая в противном случае не имела бы места.
- Электролизер
Электролитическая ячейка — это электрохимическая ячейка, которая преобразует электрическую потенциальную энергию в химическую потенциальную энергию, используя электричество для запуска несамопроизвольной химической реакции.
Иногда гальванические элементы называют просто электрохимическими ячейками. Хотя они являются электрохимическими ячейками, электролитические ячейки также являются электрохимическими ячейками. Однако электролитические и гальванические элементы — это не одно и то же.
Электролитическая ячейка активируется за счет приложения электрического потенциала к электродам, чтобы вызвать внутреннюю химическую реакцию между электродами и ионами, находящимися в растворе электролита.
 Этот процесс называется электролиз .
Этот процесс называется электролиз .- Электролиз
Электролиз — это метод запуска химических реакций путем пропускания электрического тока через электролит.
Рисунок 13.6: Эскиз электролитической ячейки.
В электролитической ячейке (например, ячейке, показанной на рисунке 13.6):
Раствор электролита состоит из катионов металлов и спектральных анионов.
Реакции окисления и восстановления происходят в одном контейнере, но не самопроизвольно.Для работы они требуют подключения электродов к внешнему источнику питания.
Электроды в электролитической ячейке могут быть из одного или разных металлов. Принцип тот же. Пусть будет только один металл, пусть это будет металл Z.
Электрод подключен к \ (\ color {blue} {\ textbf {положительной клемме}} \) батареи.

Чтобы сбалансировать заряд на \ (\ color {blue} {\ textbf {положительном электроде}} \), атомы металла \ (\ color {blue} {\ textbf {окисленные}} \) образуют ионы металлов.{-}} \)
\ (\ color {blue} {\ textbf {Ox}} \) idation — это потеря в оде \ (\ color {blue} {\ textbf {an}} \), поэтому этот электрод является \ (\ color { синий} {\ textbf {анод}} \).
Электрод подключен к \ (\ color {red} {\ textbf {отрицательной клемме}} \) батареи.
Когда положительные ионы контактируют с \ (\ color {red} {\ textbf {отрицательным электродом}} \), ионы приобретают электроны и становятся \ (\ color {red} {\ textbf {Reddated}} \).{+} (\ text {aq}) + \ text {Z} (\ text {s}) \). Хотя это может показаться тривиальным, это важный метод очистки металлов (см. Раздел 13.7).
В эксперименте с движением окрашенных ионов для приготовления буферного раствора аммиака и хлорида аммония необходимо объединить эквимолярные количества аммиака и хлорида аммония.
 Объем не имеет значения, если в растворе содержится одинаковое количество молей каждого соединения.
Объем не имеет значения, если в растворе содержится одинаковое количество молей каждого соединения.Концентрированные прочные основания могут вызвать серьезные ожоги.Напоминайте учащимся, что при работе со всеми химическими веществами, особенно сильными концентрированными основаниями, необходимо надевать соответствующее защитное снаряжение. Защитное снаряжение включает перчатки, защитные очки и защитную одежду.
Движение окрашенных ионов под действием электрического заряда
Цель
Для демонстрации того, как ионы перемещаются в растворе к противоположно заряженным электродам.
Аппарат
Фильтровальная бумага, предметное стекло, батарея 9 В, два зажима типа «крокодил», соединенные с проводами, лента
Аммиак (\ (\ text {NH} _ {3} (\ text {aq}) \)) и буферный раствор хлорида аммония (\ (\ text {NH} _ {4} \ text {Cl} \)), раствор хромата меди (II)
Метод
Подсоедините провод от зажима «крокодил» к одному концу батареи и закрепите лентой.
 Повторите то же самое с другим проводом с зажимом-крокодилом и другим концом батареи.
Повторите то же самое с другим проводом с зажимом-крокодилом и другим концом батареи.Смочите кусок фильтровальной бумаги в буферном растворе аммиака и хлорида аммония и поместите его на предметное стекло.
Присоедините фильтровальную бумагу к аккумулятору с помощью одного из зажимов типа «крокодил», другой держите рядом.
Поместите линию раствора хромата меди (II) в центр фильтровальной бумаги.Цвет этого раствора изначально зелено-коричневый.
Прикрепите второй зажим «крокодил» напротив первого (как показано на схеме) и оставьте эксперимент на выполнение примерно \ (\ text {20} \) \ (\ text {minutes} \).
Результаты
После \ (\ text {20} \) \ (\ text {minutes} \) вы должны увидеть, что центральная цветная полоса исчезает и заменяется двумя полосами, желтой и синей, которые кажутся отделенными от первая полоса хромата меди (II).
 Ионы {2 +} \) притягиваются к отрицательному электроду, это создает синюю полосу.
Ионы {2 +} \) притягиваются к отрицательному электроду, это создает синюю полосу.
Заключение
Движение ионов происходит потому, что электрический ток во внешней цепи создает разность потенциалов между двумя электродами.
В эксперименте с электролитической ячейкой важно, чтобы учащиеся тщательно взвешивали медные электроды перед экспериментом и промывали и сушили электроды перед взвешиванием после эксперимента.{-3} $} \))
А \ (\ text {9} \) \ (\ text {V} \) аккумулятор, два соединительных провода, стакан.
Метод
Симптомы, причины, типы и лечение
Общие сведения о электролитных нарушениях
Электролиты — это элементы и соединения, которые естественным образом встречаются в организме. Они контролируют важные физиологические функции.
Примеры электролитов:
Эти вещества присутствуют в вашей крови, биологических жидкостях и моче.
 Они также попадают в организм с едой, напитками и добавками.
Они также попадают в организм с едой, напитками и добавками.Электролитное нарушение возникает, когда уровень электролитов в вашем теле слишком высок или слишком низок. Для правильного функционирования вашего тела необходимо поддерживать равномерный баланс электролитов. В противном случае могут быть затронуты жизненно важные системы организма.
Сильный дисбаланс электролитов может вызвать серьезные проблемы, такие как кома, судороги и остановка сердца.
Легкие формы электролитных нарушений могут не вызывать никаких симптомов.Такие нарушения могут оставаться незамеченными, пока они не будут обнаружены во время обычного анализа крови. Симптомы обычно начинают появляться, когда конкретное расстройство становится более серьезным.
Не все электролитные дисбалансы вызывают одни и те же симптомы, но многие имеют схожие симптомы.
Общие симптомы электролитного нарушения включают:
Немедленно позвоните своему врачу, если вы испытываете какой-либо из этих симптомов и подозреваете, что у вас может быть нарушение электролитного баланса.
 Нарушения электролитного баланса могут стать опасными для жизни, если их не лечить.
Нарушения электролитного баланса могут стать опасными для жизни, если их не лечить.Электролитные нарушения чаще всего вызываются потерей жидкостей организма в результате продолжительной рвоты, диареи или потоотделения. Они также могут развиться из-за потери жидкости, связанной с ожогами.
Некоторые лекарства также могут вызывать нарушение электролитного баланса. В некоторых случаях виноваты основные заболевания, например острые или хронические заболевания почек.
Точная причина может варьироваться в зависимости от конкретного типа нарушения электролита.
Повышенный уровень электролита обозначается префиксом «гипер-.Истощенный уровень электролита обозначается как «гипо-».
Состояния, вызванные дисбалансом уровня электролитов, включают:
Кальций
Кальций — жизненно важный минерал, который ваше тело использует для стабилизации кровяного давления и контроля сокращения скелетных мышц. Он также используется для укрепления костей и зубов.

Гиперкальциемия возникает, когда в крови слишком много кальция. Обычно это вызвано следующими причинами:
Гипокальциемия возникает из-за недостатка кальция в кровотоке.Возможные причины:
Хлорид
Хлорид необходим для поддержания надлежащего баланса жидкостей организма.
Гиперхлоремия возникает, когда в организме слишком много хлоридов. Это может произойти в результате:
Гипохлоремия развивается, когда в организме слишком мало хлоридов. Часто это вызвано проблемами с натрием или калием.
Другие причины могут включать:
Магний
Магний является важным минералом, который регулирует многие важные функции, такие как:
- сокращение мышц
- сердечный ритм
- нервная функция
Гипермагниемия означает избыточное количество магния.Это заболевание в первую очередь поражает людей с болезнью Аддисона и терминальной стадией болезни почек.
Гипомагниемия означает, что в организме слишком мало магния.
 Общие причины включают:
Общие причины включают:Фосфат
Почки, кости и кишечник работают, чтобы сбалансировать уровень фосфатов в организме. Фосфат необходим для множества функций и тесно взаимодействует с кальцием.
Гиперфосфатемия может возникнуть из-за:
- низкого уровня кальция
- хронической болезни почек
- тяжелого затруднения дыхания
- недостаточной активности паращитовидных желез
- тяжелого мышечного повреждения
- синдрома лизиса опухоли, осложнения лечения рака
- чрезмерного использования фосфатсодержащие слабительные
Низкий уровень фосфатов или гипофосфатемия можно увидеть в:
Калий
Калий особенно важен для регуляции сердечной деятельности.Это также помогает поддерживать здоровье нервов и мышц.
Гиперкалиемия может развиться из-за высокого уровня калия. Это состояние может быть фатальным, если его не диагностировать и не лечить. Обычно это вызывается:
Гипокалиемия возникает, когда уровень калия слишком низкий.
 Это часто происходит в результате:
Это часто происходит в результате:- расстройств пищевого поведения
- сильной рвоты или диареи
- обезвоживания
- определенных лекарств, включая слабительные, диуретики и кортикостероиды
натрия
Натрий необходим организму для поддержания баланса жидкости и имеет решающее значение для нормального функционирования организма.Это также помогает регулировать функцию нервов и сокращение мышц.
Гипернатриемия возникает, когда в крови слишком много натрия. Аномально высокий уровень натрия может быть вызван:
- недостаточным потреблением воды
- сильным обезвоживанием
- чрезмерной потерей жидкостей организма в результате продолжительной рвоты, диареи, потоотделения или респираторных заболеваний
- определенных лекарств, включая кортикостероиды
Гипонатриемия развивается при недостатке натрия.Общие причины низкого уровня натрия включают:
Простой анализ крови может определить уровень электролитов в вашем организме.
 Также важен анализ крови, позволяющий оценить функцию почек.
Также важен анализ крови, позволяющий оценить функцию почек.Ваш врач может захотеть провести медицинский осмотр или назначить дополнительные анализы для подтверждения подозреваемого нарушения электролитного баланса. Эти дополнительные тесты будут варьироваться в зависимости от рассматриваемого состояния.
Например, гипернатриемия (слишком много натрия) может вызвать потерю эластичности кожи из-за значительного обезвоживания.Ваш врач может провести щипковый тест, чтобы определить, влияет ли на вас обезвоживание.
Они также могут проверить ваши рефлексы, поскольку как повышенный, так и истощенный уровень некоторых электролитов может влиять на рефлексы.
Электрокардиограмма (ЭКГ или ЭКГ), электрическая запись вашего сердца, также может быть полезна для проверки любых нерегулярных сердечных сокращений, ритмов или изменений ЭКГ или ЭКГ, вызванных проблемами с электролитами.
Лечение различается в зависимости от типа нарушения электролитного баланса и основного состояния, которое его вызывает.

Как правило, используются определенные процедуры для восстановления правильного баланса минералов в организме. К ним относятся:
Внутривенные (IV) жидкости
Внутривенные (IV) жидкости, обычно хлорид натрия, могут помочь регидратировать организм. Это лечение обычно используется в случаях обезвоживания в результате рвоты или диареи. Добавки электролитов могут быть добавлены к жидкостям для внутривенного вливания для устранения недостатков.
Некоторые препараты для внутривенного введения
Препараты для внутривенного введения могут помочь вашему организму быстро восстановить электролитный баланс.Они также могут защитить вас от негативных последствий, пока вы лечитесь другим методом.
Прием лекарств будет зависеть от вашего электролитного нарушения. Лекарства, которые можно вводить, включают глюконат кальция, хлорид магния и хлорид калия.
Пероральные препараты и добавки
Пероральные препараты и добавки часто используются для коррекции хронических минеральных аномалий в организме.
 Это чаще встречается, если вам поставили диагноз продолжающееся заболевание почек.
Это чаще встречается, если вам поставили диагноз продолжающееся заболевание почек.В зависимости от вашего электролитного нарушения вы можете получать лекарства или добавки, такие как:
- кальция (глюконат, карбонат, цитрат или лактат)
- оксид магния
- хлорид калия
- фосфатсвязывающие вещества, которые включают гидрохлорид севеламера (Renagel) , лантан (фосренол) и препараты на основе кальция, такие как карбонат кальция
Они могут помочь заменить истощенные электролиты на краткосрочной или долгосрочной основе, в зависимости от основной причины вашего расстройства.Как только дисбаланс будет исправлен, ваш врач устранит основную причину.
Хотя некоторые добавки можно купить без рецепта, большинство людей с нарушениями электролитного баланса получают рецепт на добавки от своего врача.
Гемодиализ
Гемодиализ — это вид диализа, при котором используется аппарат для удаления отходов из крови.
Один из способов заставить кровь течь к этой искусственной почке — это хирургическим путем создать сосудистый доступ или точку входа в ваши кровеносные сосуды.

Эта точка входа позволит большему количеству крови проходить через ваше тело во время процедуры гемодиализа. Это означает, что можно фильтровать и очищать больше крови.
Гемодиализ можно использовать, когда нарушение электролитного баланса вызвано внезапным повреждением почек и другие методы лечения не работают. Ваш врач также может принять решение о лечении гемодиализом, если проблема с электролитами стала опасной для жизни.
Нарушение электролита может развиться у любого человека. Некоторые люди подвергаются повышенному риску из-за их истории болезни.Состояния, повышающие риск нарушения электролитного баланса, включают:
Следуйте этим советам, чтобы предотвратить нарушения электролита:
- оставайтесь гидратированными, если вы испытываете длительную рвоту, диарею или потливость
- обратитесь к врачу, если у вас обычное заболевание Симптомы нарушения электролитного баланса
Если нарушение электролитного баланса вызвано лекарствами или сопутствующими заболеваниями, ваш врач скорректирует прием лекарств и устранит причину. Это поможет предотвратить будущий дисбаланс электролитов.
Определение, функции, дисбаланс и источники
Электролиты участвуют во многих важных процессах в организме.
Они играют роль в проведении нервных импульсов, сокращении мышц, поддержании гидратации и регулировании уровня pH в организме (1, 2, 3, 4).
Следовательно, вам необходимо получать достаточное количество электролитов из своего рациона, чтобы ваше тело функционировало должным образом.
В этой статье подробно рассматриваются электролиты, их функции, риск дисбаланса и возможные источники.
«Электролит» — общий термин для частиц, несущих положительный или отрицательный электрический заряд (5).
В питании этот термин относится к важным минералам, содержащимся в крови, поте и моче.
Когда эти минералы растворяются в жидкости, они образуют электролиты — положительные или отрицательные ионы, используемые в метаболических процессах.
К электролитам, содержащимся в вашем теле, относятся:
Эти электролиты необходимы для различных процессов в организме, включая правильное функционирование нервов и мышц, поддержание кислотно-щелочного баланса и поддержание гидратации.
Резюме
Электролиты — это минералы, несущие электрический заряд. Они содержатся в крови, моче и поте и имеют жизненно важное значение для определенных процессов, которые поддерживают нормальное функционирование вашего тела.
Электролиты имеют решающее значение для поддержания функционирования нервной системы и мышц, а также для поддержания баланса внутренней среды.
Функция нервной системы
Ваш мозг посылает электрические сигналы через нервные клетки для связи с клетками по всему телу.
Эти сигналы называются нервными импульсами, и они генерируются изменениями электрического заряда мембраны нервной клетки (6).
Изменения происходят из-за движения электролита натрия через мембрану нервной клетки.
Когда это происходит, запускается цепная реакция, перемещая больше ионов натрия (и изменяя их заряд) по длине аксона нервной клетки.
Функция мышц
Электролит кальция необходим для сокращения мышц (7).
Позволяет мышечным волокнам скользить вместе и перемещаться друг над другом, так как мышца укорачивается и сокращается.
Магний также необходим в этом процессе, чтобы мышечные волокна могли скользить наружу, а мышцы расслаблялись после сокращения.
Правильная гидратация
Вода должна содержаться в нужном количестве как внутри, так и снаружи каждой клетки вашего тела (8).
Электролиты, особенно натрий, помогают поддерживать баланс жидкости за счет осмоса.
Осмос — это процесс, при котором вода движется через стенку клеточной мембраны из разбавленного раствора (больше воды и меньше электролитов) в более концентрированный раствор (меньше воды и больше электролитов).
Это предохраняет клетки от разрыва от переполнения или сморщивания из-за обезвоживания (9).
Внутренние уровни pH
Чтобы оставаться здоровым, ваше тело должно регулировать свой внутренний pH (10).
pH — это показатель кислотности или щелочности раствора. В вашем теле это регулируется химическими буферами или слабыми кислотами и основаниями, которые помогают минимизировать изменения во внутренней среде.
Например, уровень pH в вашей крови должен оставаться около 7.От 35 до 7,45. Если он отклоняется от этого, ваше тело не может функционировать должным образом, и вы заболеете.
Правильный баланс электролитов имеет основополагающее значение для поддержания уровня pH в крови (10).
Резюме
Электролиты необходимы для поддержания функционирования нервной системы и мышц. Они также обеспечивают оптимальную внутреннюю среду вашего тела, поддерживая гидратацию и помогая регулировать внутренний pH.
В некоторых случаях уровень электролитов в крови может стать слишком высоким или низким, вызывая дисбаланс (11, 12, 13).
Нарушения электролитов могут оказать вредное воздействие на ваше здоровье и в редких случаях даже привести к летальному исходу (14).
Дисбаланс электролитов часто возникает из-за обезвоживания, вызванного чрезмерным нагревом, рвотой или диареей. Вот почему вы должны помнить о восполнении любых потерянных жидкостей, когда вам жарко или когда вы больны (15).
Некоторые заболевания, в том числе болезни почек, расстройства пищевого поведения и травмы, такие как тяжелые ожоги, также могут вызывать нарушение электролитного баланса (16, 17, 18, 19).
Если у вас легкое нарушение электролитного баланса, у вас, вероятно, не будет никаких симптомов.
Однако более серьезные дисбалансы могут вызывать такие симптомы, как (20, 21):
- Усталость
- Быстрое или нерегулярное сердцебиение
- Онемение и покалывание
- Спутанность сознания
- Слабость и спазмы мышц
- Головные боли
- Судороги
Если вы подозреваете, что у вас дисбаланс электролитов, обязательно обсудите свои симптомы с врачом.
Резюме
Электролитный дисбаланс чаще всего возникает, когда люди сильно обезвожены из-за рвоты, диареи или чрезмерного потоотделения. Сильный дисбаланс может мешать функционированию вашего тела.
Когда вы потеете, вы теряете воду и электролиты, особенно натрий и хлорид.
В результате длительные упражнения или активность, особенно в жару, могут вызвать значительную потерю электролитов.
По оценкам, пот в среднем содержит около 40–60 ммоль натрия на литр (22).
Но фактическое количество электролитов, теряемых с потом, может варьироваться от человека к человеку (23, 24).
В США максимальная рекомендуемая доза натрия составляет 2300 мг в день, что эквивалентно 6 г или 1 чайной ложке поваренной соли (25).
Поскольку около 90% взрослых американцев потребляют намного больше, большинству людей не требуется восполнять потерю натрия с потом (26).
Однако некоторые группы населения, такие как спортсмены на выносливость, которые тренируются более двух часов, или те, кто тренируется в условиях сильной жары, могут захотеть подумать о том, чтобы пить спортивные напитки, обогащенные электролитами, чтобы восполнить свои потери (27).
Для всех остальных достаточно получать нормальное количество натрия из пищи и питьевой воды, чтобы оставаться гидратированным.
Резюме
Когда вы потеете, вы теряете воду и электролиты, особенно натрий. Тем не менее, натрия, потребляемого с пищей, обычно достаточно, чтобы покрыть любые потери.
Лучший способ достичь и поддерживать баланс электролитов — это здоровое питание.
Основными пищевыми источниками электролитов являются фрукты и овощи.Однако в западной диете обычным источником натрия и хлоридов является поваренная соль.
Ниже приведены некоторые продукты, содержащие электролиты (28, 29, 30):
- Натрий: Маринованные продукты, сыр и поваренная соль.
- Хлорид: Соль поваренная.
- Калий: Фрукты и овощи, такие как бананы, авокадо и сладкий картофель.
- Магний: Семена и орехи.
- Кальций: Молочные продукты, витаминизированные заменители молока и зеленые листовые овощи.
Электролиты, такие как бикарбонат, вырабатываются естественным путем в организме, поэтому вам не нужно беспокоиться о том, чтобы включить их в свой рацион.
Резюме
Электролиты содержатся во многих продуктах питания, включая фрукты, овощи, молочные продукты, орехи и семена.
Некоторые люди пьют воду с электролитом или добавляют электролиты, такие как натрий и кальций, чтобы получить достаточно.
Однако сбалансированной диеты, включающей источники электролитов, должно хватить для большинства.
Ваше тело обычно может эффективно регулировать электролиты и поддерживать их на нужном уровне.
Но в некоторых случаях, например, во время приступов рвоты и диареи, когда потери электролитов чрезмерны, может оказаться полезным добавление раствора для регидратации, содержащего электролиты (31).
Сумма, которую вам нужно будет израсходовать, будет зависеть от ваших потерь. Всегда читайте инструкции по замене без рецепта.
Также обратите внимание, что если у вас не низкий уровень электролитов из-за чрезмерных потерь, то прием добавок может вызвать аномальный уровень и, возможно, болезнь (32).
Перед добавлением электролитов лучше проконсультироваться с врачом или фармацевтом.
Резюме
Если вы придерживаетесь сбалансированной диеты, которая содержит хорошие источники электролитов, добавки обычно не нужны.
Электролиты — это минералы, которые несут электрический заряд при растворении в воде.
Они жизненно важны для вашей нервной системы, мышц и поддержания оптимальной среды тела.
Большинство людей удовлетворяют свои потребности в электролитах за счет сбалансированной диеты, хотя может возникнуть дисбаланс, если вы обезвожены из-за болезни или перегрева.
Если вы подозреваете, что у вас дисбаланс электролитов, поговорите со своим врачом.
Электролитный дисбаланс: симптомы, причины и лечение
Электролитный дисбаланс может возникнуть, если в организме слишком много или слишком мало воды.
Электролиты — это минералы в крови, тканях и других частях тела. Их название связано с тем, что у них есть электрический заряд.
Ниже вы узнаете, как может выглядеть электролитный дисбаланс, на что обращать внимание и когда обращаться за медицинской помощью.
Поделиться на PinterestПотребление напитка для регидратации может помочь восстановить баланс электролитов в организме.Электролиты — это минералы, и они нужны организму, чтобы:
- сбалансировать уровень воды
- перемещать питательные вещества в клетки
- удалять продукты жизнедеятельности
- позволять нервам посылать сигналы
- позволяют мышцам нормально расслабляться и сокращаться
- поддерживать Работа мозга и сердца
Люди получают электролиты из продуктов питания и напитков.Почки и печень помогают поддерживать баланс электролитов.
Если человек ест разнообразную пищу и пьет достаточно жидкости, уровень электролитов обычно остается на нужном уровне.
Примеры электролитов в организме человека включают:
- натрий
- калий
- кальций
- магний
- фосфат
- хлорид
- бикарбонат
Когда уровни электролитов становятся слишком высокими или низкими, это электролит дисбаланс.Это не болезнь, но это признак другой проблемы в организме.
Нарушение баланса электролитов может произойти, если человек обезвожен или в его теле слишком много воды.
Наиболее частыми причинами электролитного дисбаланса являются:
- рвота
- диарея
- недостаточное потребление жидкости
- недостаточное питание
- чрезмерное потоотделение
- определенные лекарства, такие как слабительные и мочегонные средства
- расстройства пищевого поведения
- проблемы с печенью или почками
- лечение рака
- застойная сердечная недостаточность
Организм по-разному реагирует на электролитный дисбаланс.Эффект может зависеть от того, какие уровни электролитов несбалансированы, насколько серьезна проблема и есть ли у человека другие заболевания.
В одном исследовании изучались данные 996 пациентов, получивших неотложную помощь по поводу электролитного дисбаланса.
Исследователи сообщают, что наиболее частыми симптомами были:
- лихорадка
- одышка
- спутанность сознания
- отек или вздутие живота
- учащенное сердцебиение
- нерегулярное сердцебиение
Другие симптомы могут включать:
- раздражительность
- усталость
- онемение
- покалывание
- мышечная слабость
- подергивание
- спазмы
- быстрые изменения артериального давления
- судороги
Дети имеют более высокий риск обезвоживания, чем взрослые, из-за их меньшего размера и быстрее метаболизм жидкостей и электролитов.
Если ребенок заболеет с сильной рвотой или диареей, у него может развиться электролитный дисбаланс, требующий медицинской помощи.
Ребенок с основным заболеванием, таким как заболевание щитовидной железы, сердца или почек, может иметь более высокий риск электролитного дисбаланса.
Если у ребенка есть риск обезвоживания или электролитного дисбаланса, немедленно обратитесь за медицинской помощью.
Исследования показали, что пожилые люди более подвержены обезвоживанию и электролитному дисбалансу, чем молодые люди.
Для этого есть много причин, в том числе:
- Почки могут потерять часть своих функций с возрастом.
- Пожилые люди могут принимать несколько лекарств, например диуретики, которые могут изменять уровень электролитов.
- Они могут не получать достаточно еды или питья из-за инвалидности, отсутствия аппетита или жажды или из-за того, что у них нет постоянного доступа к еде и питью.
Опекуны и близкие должны внимательно следить за пожилыми людьми на предмет признаков обезвоживания.Возможно, им потребуется помочь убедиться, что человек ест и пьет достаточно.
Признаки обезвоживания у пожилых людей могут включать:
- сухость во рту, включая губы и язык
- запавшие глаза
- кожа, которая кажется сухой и менее упругой или эластичной
- сонливость
- спутанность сознания или дезориентация
- головокружение
- низкое кровяное давление
Если человек заболел коротким приступом рвоты или диареи или сильно потел, питьевая вода или раствор электролита, отпускаемый без рецепта, могут помочь восстановить баланс электролитов.
Многие напитки для пероральной регидратации доступны в магазинах, и их может быть достаточно, если у человека имеется легкий дисбаланс без серьезных симптомов.
У некоторых людей электролитный дисбаланс возникает из-за состояния здоровья, например болезни почек или сердца. В этом случае человек может исправить дисбаланс дома в течение нескольких дней или недель. Однако врач должен контролировать этот процесс, чтобы быть уверенным, что человек получает правильное количество.
Прием большого количества электролитов без рекомендации врача может создать еще один дисбаланс и привести к осложнениям со здоровьем.Кроме того, некоторым людям требуется дополнительное лечение для решения основной проблемы.
Если у человека более тяжелое заболевание почек, ему может потребоваться диализ для исправления электролитного дисбаланса.
Дисбаланс электролитов может быть опасным. Если дисбаланс серьезный, человеку может потребоваться ввести электролиты через внутривенную или внутривенную линию в больнице.
Если человек считает, что у него может быть умеренное обезвоживание, он может попробовать напиток для регидратации, чтобы восстановить баланс электролитов.
Однако будьте осторожны с использованием спортивных напитков для этой цели. Некоторые эксперты считают, что спортивные напитки содержат слишком много сахара и слишком мало натрия, чтобы исправить дисбаланс.
Однако некоторые исследования показали, что спортивные напитки и растворы для пероральной регидратации давали аналогичные результаты у людей, которые тренировались в жаркую погоду.
Всемирная организация здравоохранения (ВОЗ) рекомендует готовить раствор для пероральной регидратации дома, а не покупать готовый напиток.
Рецепт включает в себя смешивание 1 литра воды с 1 чайной ложкой соли и 2 столовыми ложками сахара.Человек может использовать этот рецепт вместо купленного в магазине раствора электролита.
Поскольку электролитный дисбаланс может быть опасным для жизни, не пробуйте домашние средства, если у человека есть серьезные симптомы или какие-либо сопутствующие заболевания.
Младенцы, маленькие дети и пожилые люди также могут иметь более высокий риск серьезных осложнений. В таких случаях всегда консультируйтесь с врачом.
Здоровые взрослые с умеренным обезвоживанием могут обнаружить, что питье раствора для регидратации помогает им восполнить свои электролиты.
Если дисбаланс вызван состоянием здоровья, обратитесь к врачу.
Пожилые люди, младенцы и дети должны получать профессиональную помощь, если у них есть какие-либо симптомы электролитного дисбаланса или обезвоживания.
DoITPoMS — Библиотека топливных элементов TLP
В этом разделе TLP описаны основные свойства наиболее распространенных материалов, используемых в качестве электролитов в ТОТЭ.
Электролит должен соответствовать нескольким критериям.Это должно быть:
- Плотность и герметичность
- Устойчив в восстановительной и окислительной средах
- Хороший ионный проводник при рабочих температурах
- Неэлектронный проводник
- Тонкий для снижения ионного сопротивления
- Увеличенная площадь для максимальной токовой нагрузки
- Термостойкость
- Экономичный
В качестве материала использована твердая ионопроводящая керамика.Есть две основные группы таких ионных проводников: со структурой флюорита и со структурой перовскита, помимо новых материалов, таких как оксиды с гексагональной структурой. Три наиболее распространенных электролитических материала: легированный диоксид церия (CeO 2 ), легированный галлат лантана (LaGaO 3 ) (оба являются проводниками ионов кислорода) и легированный цирконат бария (BaZrO 3 ) (проводник протонов). Концентрация и тип (ионный радиус) примесей сильно влияют на свойства материала. Примеси, которые вызывают наименьшее напряжение и, следовательно, наименьшее влияние на ландшафт потенциальной энергии исходной решетки, имеют наибольшее влияние на проводимость.
В проводнике оксидных ионов ток течет за счет движения оксидных ионов через кристаллическую решетку. Это термически активируемый процесс, когда ионы случайным образом скачут из одного узла решетки в другой (из одной потенциальной долины в другую). При приложении электрического поля дрейф в одном направлении накладывается на случайное тепловое движение.
Потенциальная энергия в электрическом поле в периодическом кристалле
Ионная проводимость зависит от подвижности ионов и, следовательно, от температуры.При высоких температурах проводимость может достигать 1 См / см -1 , что по порядку величины того же порядка, что и для жидких электролитов. Кристалл должен содержать незанятые узлы, которые эквивалентны узлам, занятым ионами решеточного кислорода. Энергетический барьер для миграции с занятого сайта на незанятый должен быть небольшим (≤1 эВ). Это может показаться необычным, поскольку относительный размер ионов кислорода велик, и более вероятно, что более мелкие ионы металлов мигрируют в электрическом поле.Вот почему существует только несколько специальных структур, которые делают возможной миграцию ионов кислорода: оксиды со структурой флюорита, перовскиты, семейство LAMOX и BIMEVOX.
Оксиды флюорита являются наиболее распространенными и классическими материалами, проводящими ионы кислорода. Кристаллическая структура состоит из кубической кислородной решетки с чередующимися центрами тела, занятыми восемью координированными катионами. Катионы организованы в гранецентрированную кубическую структуру с анионами, занимающими тетраэдрические позиции. Это оставляет довольно открытую структуру с большой октаэдрической межузельной пустотой.
Ваш браузер не поддерживает видео тег.
Решетка из диоксида циркония вращающаяся
Стандартные условия использования DoITPoMS
Примечание. Для этой анимации требуется Adobe Flash Player 8 и более поздних версий, который можно скачать здесь.
->Общая формула имеет вид AO 2 , где A обычно представляет собой большой четырехвалентный катион, например U, Th, Ce. Поскольку Zr 4+ слишком мал, чтобы поддерживать структуру флюорита при низких температурах, он должен быть частично замещен катионом большего размера, называемым легирующей добавкой.Легирование обычно включает замещение в решетку катионов с более низкой валентностью. Чтобы сохранить нейтральность заряда, необходимо ввести кислородные вакансии, которые обеспечивают миграцию ионов кислорода.
Вакансия транспорта в ЯСЗ
Интересной особенностью структуры флюорита является то, что он может выдерживать высокую степень замещения. В результате получается очень неупорядоченный материал с открытой структурой, который способствует ионной проводимости.
Электронная микрофотография с высоким разрешением, изображающая интерфейс никеля и YSZ (Изображение любезно предоставлено Техническим университетом Токио)
Путем замены основных катионных центров на редкоземельный или щелочноземельный элемент, как и в случае оксида циркония, стабилизированного оксидом иттрия (YSZ), можно добиться увеличения ионной проводимости.Цирконий (диоксид циркония, ZrO 2 ) в чистом виде имеет высокую температуру плавления и низкую теплопроводность. Применение чистого диоксида циркония ограничено, поскольку он демонстрирует полиморфизм. Это моноклинный при комнатной температуре и переходит в более плотную тетрагональную фазу примерно от 1000 ° C. Это влечет за собой большое изменение объема и вызывает обширное растрескивание. Следовательно, диоксид циркония имеет низкое сопротивление тепловому удару. Добавление некоторых оксидов приводит к стабилизации кубической фазы и созданию одной кислородной вакансии, т.е.{..}}}}] \)Y 2 O 3 (ZrO 2 ) → 2Y ’ Zr + 3O x o + V o
Фазовая диаграмма частично стабилизированного диоксида циркония (ЧСЗ)
Частично стабилизированный диоксид циркония (ЧСЦ) представляет собой смесь полиморфов диоксида циркония: кубическая и метастабильная тетрагональная фаза ZrO. 2 получают из-за недостаточного количества стабилизатора. ПСЗ также называют тетрагональным поликристаллом диоксида циркония: ТЗП.PSZ — это материал, упрочненный трансформацией, поскольку возникшие микротрещины и поля напряжений поглощают энергию. ПСЗ используется для тиглей, потому что он имеет низкую теплопроводность и высокую температуру плавления. Добавки 16 мол.% CaO, 16 мол.% MgO или 8 мол.% Y 2 O 3 (8YSZ) достаточно для образования полностью стабилизированного диоксида циркония. Структура превращается в твердый раствор кубической формы, не имеющий фазовых превращений при нагревании от комнатной температуры до 2500 ° C. Из-за высокой проводимости оксидных ионов YSZ часто используется для датчиков кислорода и твердооксидных топливных элементов.
Сканирующая электронная микрофотография, показывающая 8 мол.% Y 2 O 3 (8YSZ) поверхность (Изображение любезно предоставлено Altair Nanotechnologies, Inc)
Можно было ожидать, что увеличение концентрации примеси приведет к увеличению проводимости. Эта корреляция применима только к низким концентрациям примеси, потому что на более высоких уровнях примеси первой и второй электронных координационных сфер начинают взаимодействовать с кислородными вакансиями, и проводимость уменьшается.{..}}}}} \ right] \) — это незанятая кислородная вакансия.
Проводимость как функция температуры, данные взяты из [3].
В современных топливных элементах в качестве электролита выбирается диоксид циркония, стабилизированный либо 3 мол.% Y 2 O 3 (3YSZ), либо 8 мол.% Y 2 O 3 (8YSZ). YSZ — не лучший ионный проводник, но он самый дешевый в обработке и имеет достаточно низкую электронную проводимость. Есть много других материалов, которые проводят оксиды, но преимущества YSZ: обилие, химическая стабильность, нетоксичность и экономичность делают его наиболее подходящим материалом в настоящее время.Недостатками являются высокий коэффициент теплового расширения и, следовательно, проблемы с герметизацией топливного элемента. Мировой спрос на YSZ растет, но, к счастью, Zr является одним из наиболее распространенных элементов земной коры, обычно в виде силикатного циркона (ZrSiO 4 ). Этот материал необходимо очищать, поскольку SiO 2 имеет тенденцию блокировать пути ионов и электронов.
Иттрия является основным используемым стабилизатором, и для получения полностью стабилизированного кубического материала необходимо добавить около 13-16 мас.%.Поставки более редких примесей, таких как скандия, могут стать проблемой в будущем.
Другой интересный материал со структурой флюорита — это CeO 2 , легированный 10 мол.% GdO (GCO). Это особенно полезно для приложений с более низкими температурами. Но GCO является электронным проводником в восстановительной среде на аноде, и поэтому короткое замыкание является проблемой.
Изготовление пленок из диоксида циркония электролита обычно осуществляется путем отливки ленты или осаждения из паровой фазы .
Вторая очень интересная группа твердотельных ионных проводников — перовскиты. Общая стехиометрия перовскита — ABO 3 .
Ваш браузер не поддерживает видео тег.
Вращающаяся решетка перовскита
Стандартные условия использования DoITPoMS
Примечание. Для этой анимации требуется Adobe Flash Player 8 и более поздних версий, который можно скачать здесь.
->
Из-за количества комбинаций (2 + 4, 5 + 1, 3 + 3), которые имеют общий заряд +6 на AB, высокой стабильности структуры и большого разнообразия катионов, которые могут быть размещены внутри, перовскиты имеют широкий спектр свойств, которые подходят не только для ТОТЭ, но и в качестве сегнетоэлектриков, катализаторов окисления или сверхпроводников.Высокая ионная проводимость в перовскитах достигается за счет легирования материала трехвалентными элементами, такими как, например, Y в позиции Zr в BaZrO 3 , так что появляются кислородные вакансии. Электропроводность перовскитов ABO 3 сильно зависит от размера A и, в меньшей степени, от размера катиона B, поскольку оксиды должны перемещаться через треугольное пространство, состоящее из двух больших катионов A и одного катиона B меньшего размера. Увеличение этого треугольного пространства способствует миграции оксидных ионов через решетку.Следовательно, можно ожидать более высокой ионной проводимости при больших размерах решетки.Чтобы включить гидроксильные группы в свободные участки оксида, материал подвергается воздействию влажной атмосферы. Второй протон молекулы воды присоединяется к другому атому кислорода в структуре. Из-за слабой связи между ионом водорода и атомом кислорода, легко возникает проводимость, когда ионы водорода переходят от одного кислорода к другому.
Перовскиты LaGaO 3 и BaZrO 3 оказались очень интересными, поскольку их структура очень толерантна и может выдерживать большие концентрации примесей, но меньше, чем в YSZ (следовательно, ионная проводимость перовскитов всегда меньше, чем у YSZ) .
Конкретный состав: La 0,9 Sr 0,1 Ga 0,8 Mg 0,2 O 3-d (LSGM), как было обнаружено, имеет чисто ионную проводимость, аналогичную CeO 2 , также при низких температурах. (<600 ° С). Однако испарение Ga вызывает проблемы со стабильностью. Другие проблемы, такие как реакционная способность LSGM с никелевыми электродами, были решены путем добавления буферного слоя CeO 2 между двумя материалами.
В случае конструкции с электролитической опорой толщина электролита должна быть 120–150 мм.Для работы при низких температурах требуется тонкий электролит, поскольку проводимость пропорциональна температуре. Для рабочих температур от 600 до 800 ° C толщина слоя электролита не может превышать 20 мм, чтобы обеспечить достаточно высокую проводимость.
Процесс производства электролита
Последний метод производства включает электрохимическое осаждение из паровой фазы, используемый для изготовления трубчатых элементов (в Westinghouse). Легированный манганит лантана (катодный материал) помещается в камеру низкого давления, и пары хлорида циркония и хлорида иттрия проходят по внешней стороне трубки, так как водяной пар проходит по внутренней стороне трубки.Более традиционный метод производства — ленточное литье:
Лента литьевая
предыдущая | следующийКак отличить электролиты от неэлектролитов
- Образование
- Наука
- Химия
- Как отличить электролиты от неэлектролитов
Электролиты — это вещества, проводящие электричество в расплавленном состоянии или растворенные в воде.Неэлектролиты — это вещества, которые в этих состояниях не проводят электричество.
Когда ионное соединение, такое как хлорид натрия, помещается в воду, молекулы воды притягивают катионы и анионы в кристалле и втягивают их в раствор (см. Кристалл, показанный на рисунке). Катионы и анионы распределяются по всему раствору.
Кристаллическая структура хлорида натрия.
Вы можете обнаружить присутствие этих ионов с помощью прибора, который называется тестером проводимости .Тестер проводимости проверяет, проводят ли водные растворы различных веществ электричество. Он состоит из лампочки с двумя прикрепленными электродами.
Лампочка подключена к розетке, но не загорается, пока какой-либо проводник (вещество, способное передавать электричество) между электродами не замыкает цепь. (Цепь замыкает палец, поэтому этот эксперимент нужно проводить осторожно.)
Когда вы помещаете электроды в чистую воду, ничего не происходит, потому что между электродами нет проводника.Чистая вода — непроводник. Но если вы поместите электроды в раствор NaCl, лампочка загорится, потому что ионы проводят электричество (переносят электроны) от одного электрода к другому.
Тебе даже не нужна вода. Если бы вы расплавили чистый NaCl (для этого требуется много тепла!), А затем поместили бы в него электроды, вы бы обнаружили, что расплавленная поваренная соль также проводит электричество. В расплавленном состоянии ионы NaCl могут свободно перемещаться и переносить электроны, как и в растворе соленой воды.
Ученые могут получить хорошие подсказки относительно типа связи в соединении, обнаружив, является ли вещество электролитом или неэлектролитом. Ионно-связанные вещества действуют как электролиты. Но ковалентно связанные соединения, в которых нет ионов, обычно неэлектролиты.
Столовый сахар или сахароза — хороший пример неэлектролита. Вы можете растворить сахар в воде или растопить его, но он не будет иметь проводимости. Ионы, переносящие электроны, отсутствуют.
.



 Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.
Происходит преобразование химической потенциальной энергии в электрическую потенциальную энергию, электрическую потенциальную энергию или в химическую потенциальную энергию.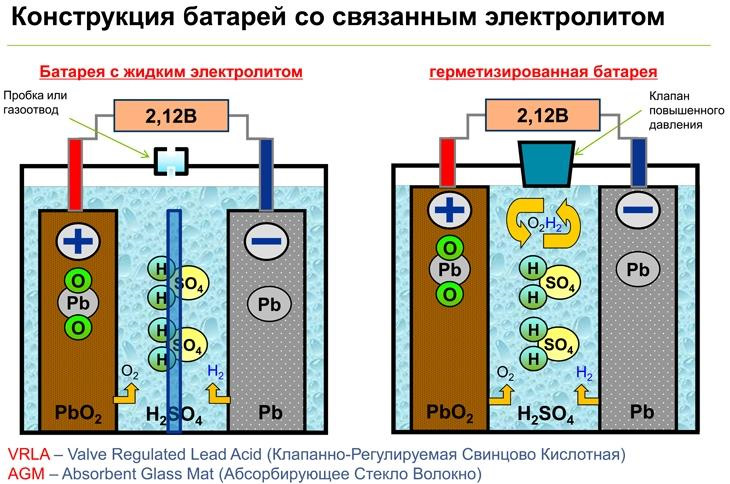


 {-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде.
{-} \) \ (\ to \) \ (\ text {Cu} (\ text {s}) \). Восстановление происходит на медном электроде. В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».
В 1780 году Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены друг с другом, а затем оба одновременно касались разных частей нерва лягушачьей ноги, они заставляли ногу сокращаться. Он назвал это «животным электричеством».

 Объем не имеет значения, если в растворе содержится одинаковое количество молей каждого соединения.
Объем не имеет значения, если в растворе содержится одинаковое количество молей каждого соединения. Ионы {2 +} \) притягиваются к отрицательному электроду, это создает синюю полосу.
Ионы {2 +} \) притягиваются к отрицательному электроду, это создает синюю полосу. Они также попадают в организм с едой, напитками и добавками.
Они также попадают в организм с едой, напитками и добавками. Нарушения электролитного баланса могут стать опасными для жизни, если их не лечить.
Нарушения электролитного баланса могут стать опасными для жизни, если их не лечить.
 Общие причины включают:
Общие причины включают: Также важен анализ крови, позволяющий оценить функцию почек.
Также важен анализ крови, позволяющий оценить функцию почек.
 Это чаще встречается, если вам поставили диагноз продолжающееся заболевание почек.
Это чаще встречается, если вам поставили диагноз продолжающееся заболевание почек.