Как получить этиленгликоль из этилена: Как можно получить этиленгликоль? Составьте уравнение соответствующей реакции
Методы получения этиленгликоля — Справочник химика 21
Методы получения этиленгликоля [c.60] Получение этиленгликоля из формальдегида организовано в США фирмой Е. I. du Pont de Nemours and o. По этому способу смесь паров формальдегида и воды (объемное соотношение 1 1) абсорбируется водным раствором гликолевой кислоты (мольное соотношение 1 2) с примесью каталитических количеств серной кислоты и затем пропускается через реактор вместе с избытком окиси углерода при 200 «С и 70 МПа (время контакта 5 мин). В результате образуется гликолевая кислота (выход 90—95%), выделяемая перегонкой прн пониженном давлении. После этерификации гликолевой кислоты метиловым спиртом и очистки зфира перегонкой, проводится гидрирование метилового эфира гликолевой кислоты при 200 °С и 3 МПа в присутствии катализатора медь—хромат бария. На стадии восстановления получают этиленгликоль с выходом 90%. Данный метод не получил широкого распространения вследствие многостаднйности и высокой коррозионности среды, но может быть перспективным при снижении стоимости и расщирении производства синтез-газа.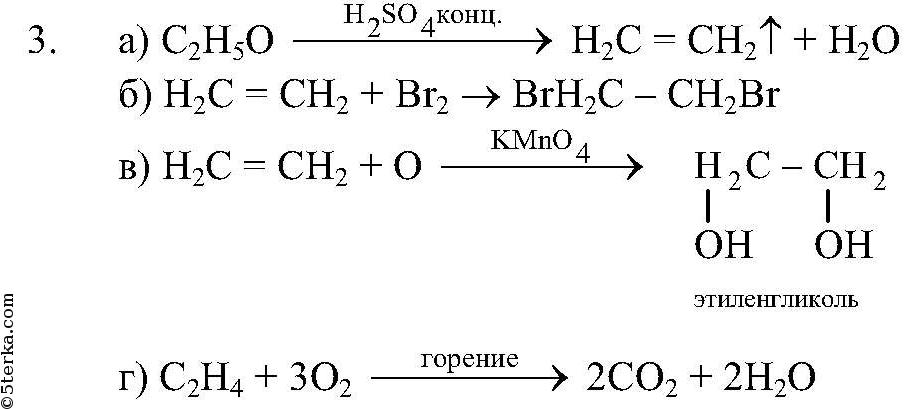
Промышленными методами получения этиленгликоля являются гидратация окиси этилена, гидролиз этиленхлоргидрина и гидролиз дихлорэтана. В настоящее время этиленгликоль получают, главным образом, по первому методу [c.159]
Реакция дегидратации одноатомных спиртов под действием серной кислоты или ее солей является классическим методом получения простых эфиров. В образовании молекулы эфира участвуют две молекулы спирта. Реакция дегидратации гликолей в аналогичных условиях протекает в двух направлениях с образованием линейных полигликолей или с внутримолекулярной циклизацией (если возможно образование ненапряженных пяти- или шестичленных циклов). Этиленгликоль под действием серной кислоты образует полигликоли или шестичленный циклический эфир 1,4-диоксан [c.213]
Два новых метода получения этиленгликоля из синтез-газа. Редакционная ста- [c.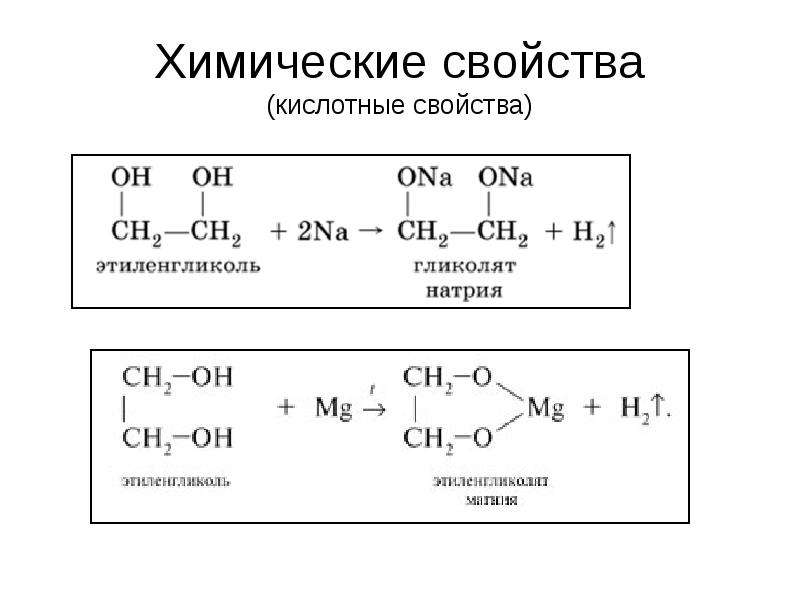 76]
76]
Представляет интерес метод получения этиленгликоля через этиленкарбонат. Сущность метода заключается в том, что в присутствии диоксида углерода и катализатора проводят гидратацию этиленоксида в этиленкарбонат. Его подвергают гидролизу с образованием этиленгликоля. Способ интересен тем, что получаемый этиленгликоль содержит незначительное количество воды и поэтому не требуется сооружение выпарных установок для концентри-рован я этиленгликоля перед ректификацией. [c.224]
Этиленхлоргидрин (монохлоргидрин или 2-хлорэтанол) впервые был получен Вюрцем в 1859 г. нагреванием в запаянной трубке этиленгликоля, насыщенного хлористым водородом. В поисках промышленных методов получения этиленхлоргидрина длительное время придерживались принципа получения его из этилена и хлорноватистой кислоты, считая последнюю необходимым компонентом реакции. Исходя из этого, предлагалось получение этиленхлоргидрина из этилена и гипохлоритов в присутствии слабых кислот (угольная, борная и др.
В промышленности наибольшее количество а-оксидов расходуется на получение гликолей и их простых эфиров. Так, промышленный метод синтеза этиленгликоля состоит в гидратации этиленоксида при 170-200 °С и 15-кратном избытке воды. [c.488]
Основной промышленный метод получения этиленгликоля — гидратация этиленоксида [c.178]
По другому методу дихлорэтан гидролизуют при 140—250° и давлении, доходящем до 40 ата, непрерывно прибавляя раствор едкого натра, причем с помощью фосфатного буфера pH реакционной среды все время поддерживают равным 2—4 [15]. Наконец, дихлорэтан можно перевести в сложные эфиры (формиаты и ацетаты), которые гидролизуются значительно легче.
 Однако эти методы экономически менее выгодны, чем метод получения этиленгликоля из этиленхлоргидрина (стр. 188) или из окиси этилена (гл. 19, стр. 353). Это объясняется тем, что при вышеуказанных методах приходится либо расходовать большие количества щелочи, либо применять дорогостоящую аппаратуру, способную выдержать действие разбавленной соляной кислоты при повышенных температуре и давлении. [c.170]
Однако эти методы экономически менее выгодны, чем метод получения этиленгликоля из этиленхлоргидрина (стр. 188) или из окиси этилена (гл. 19, стр. 353). Это объясняется тем, что при вышеуказанных методах приходится либо расходовать большие количества щелочи, либо применять дорогостоящую аппаратуру, способную выдержать действие разбавленной соляной кислоты при повышенных температуре и давлении. [c.170] Гидролизом соответствующих хлоридов в большом количестве производятся бензиловый, аллиловый и металлиловый спирты. Один из методов получения этиленгликоля состоит в катализируемом щелочами гидролизе этиленхлоргидрина. Получаемая промежуточно окись этилена затем гидролизуется при повышенной температуре или в разбавленной кислоте. Подобной же серией превращений из пропилена получают пропиленгликоль
Сущность метода получения этиленгликоля из этиленкарбо-ната [63] заключается в том, что гидратацию окиси этилена проводят [c.64]
Получение этиленглнколя из метанола.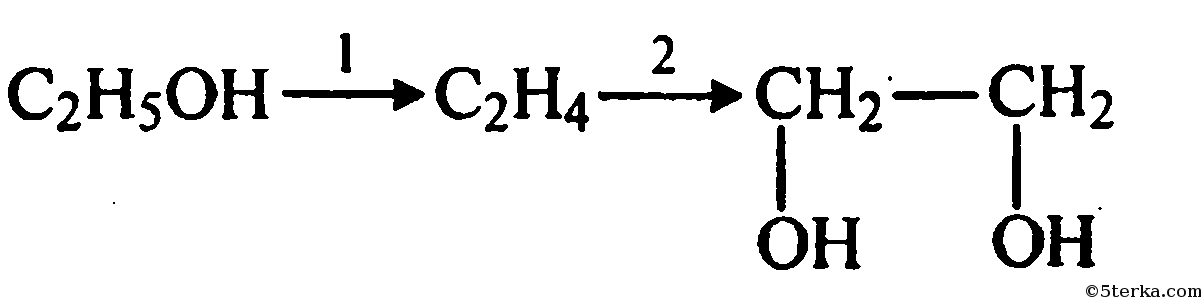 Процесс получения этиленгликоля по этому методу, который был осуществлен в промышленных условиях в США, включает следующие стадии [68] получение формальдегида окислением метанола [c.67]
Процесс получения этиленгликоля по этому методу, который был осуществлен в промышленных условиях в США, включает следующие стадии [68] получение формальдегида окислением метанола [c.67]
Методы получения этиленгликоля, рассмотренные в этом разделе, можно разделить на лабораторные, часть из которых прошла проверку на опытных установках п, возможно, найдет промышленное применение, и промышленные, которые в свое время нашли применение, однако в дальнейшем потеряли значение в связи с большими успехами, достигнутыми в процессе получения окисп этилена и ее гидратации в этиленгликоль. Следует заметить, что такое разделение методов получения этиленгликоля является в известной степени условным, так как ио мере развития иаукп и техники — открытия новых катализаторов и экономичных способов получения исходных продуктов, существенного усовершенствования уже известных способов — лабораторный способ может стать промышленным, а способ, по которому производится продукт, может потерять свое проьатшлен-ное значение.
Напишите уравнения реакций, лежащих в основе технических методов получения метилового, этилового, изопропилового и аллилового спиртов, этиленгликоля и глицерина.
В книге описаны физические п химические свойства, методы получения, области применения, условия транспортирования, хранения и методы анализа ряда наиболее важных производных окисей этилена и пропилена этиленгликоля, ДИ-, три- и тетраэтиленгликолей, пропилен-, дипропилен-и трипропиленгликолей, эфиров гликолей и полимеров окиси этилена и окиси пропилена. Рассмотрены также токсические свойства указанных продуктов, условия обращения с ними. [c.2]
Dunstan и Bir h предложили следующий метод получения этиленгликоля. Водный раствор этиленхлоргидрина непрерывш смешивается с водным раствором слабой щелочи (например карбоната натрия) и нагревается под давлением при 105—150°. Горячая реакционная смесь протекает, под давлением и при температуре реакции, через серию нагреваемых U-образных труб. В этих трубах нижние части заполнены насадкой, а верхние снабжены изогнутыми внутрь ребрами. [c.553]
В этих трубах нижние части заполнены насадкой, а верхние снабжены изогнутыми внутрь ребрами. [c.553]
Получение этиленгликоля гидролизом этиленгликольацетатов. Основанием для этого метода послужила разработка процесса окисления этилена кислородом в уксусной кислоте с образованием эти-ленгликольацетата или этиленгликольдиацетата (в зависимости от выбранного катализатора). Гидролиз полученных ацетатов приводит к получению этиленгликоля [c.62]
Нами разработан метод получения 2-хлорметил-1,3-диок-солана, основанный на взаимодействии димергидрата хлорацетальдегида с этиленгликолем, насыщенным хлористым водородом, в присутствии плавленого хлористого кальция. [c.24]
Решение. Оксид этилена — один нз важнейших полупродуктов различных синтезов получения этиленгликоля. полигликолей, лаковых растворителей, пластификаторов, этаноламинов, эмульгирующих и моющих средств соединения, синтезируемые нз оксида этилена, находят применение в производстве синтетических волокон, каучуков и других продуктов.
Известны и другие методы получения диэтиленгликоля [34] гидролиз диацетата диэтиленгликоля при его нагревании в метанольном растворе хлористоводородной кислоты, синтез из этиленгликоля при его нагревании в токе двуокиси углерода или в присутствии щелочи, получение диэтиленгликоля при нагревании слабокислых водных растворов (pH 5—7) высших гликолей до 200— 300 °С [c.133]
Специфические методы получения. Долгое время не могли получить магнийорганические соединения из галогенидов винильного типа. Только в 1954 г. Норману удалось провести реакцию магния с бромистым винилом с образованием магнийбромвинила с высоким выходом. Оказалось, что эта реакция идет только в тетрагидрофуране и некоторых близких к нему по строению соединениях (2-метилтетра-гидрофуране, тетрагидропиране и некоторых диалкиловых эфирах этиленгликоля) [c.210]
Диалкил-1,4-диоксаны.
 Эти соединения могут быть синтезированы конденсацией различных гликолей, аналогичной методу получения самого 1,4-диоксана из этиленгликоля [62]. Однако указанный способ дает обычно смесь продуктов реакции. Так, при этерификации пропиленгликоля образуются 2,5-и 2,6-диметил-1,4-диоксаны. Подобным же образом 1,2-бутиленгликоль дает [c.20]
Эти соединения могут быть синтезированы конденсацией различных гликолей, аналогичной методу получения самого 1,4-диоксана из этиленгликоля [62]. Однако указанный способ дает обычно смесь продуктов реакции. Так, при этерификации пропиленгликоля образуются 2,5-и 2,6-диметил-1,4-диоксаны. Подобным же образом 1,2-бутиленгликоль дает [c.20]Предложены различные методы производства гликолей из раз личного сырья. В настоящее время исходными материалами для получения этиленгликоля являются дихлорэтан, этиленхлоргид-рин и окись этилена. [c.149]
Нами разработан метод получения глиоксаля парофазным окислением этиленгликоля воздухом с добавкой водяного пара па катализаторе при 650—670° С [2]. В указанных условиях выход глиоксаля за один проход составлял — 60% при полной конверсии этиленгликоля, а выход прочих альдегидов (формальдегид и, гликолевый альдегид) — 15%.
Разработан метод получения глиоксаля жидкофазным окислением этиленгликоля воздухом с добавкой водяного пара на катализаторе при 650—670° С. Выход глиоксаля составляет — 60% при полной конверсии этиленгликоля. [c.207]
Выход глиоксаля составляет — 60% при полной конверсии этиленгликоля. [c.207]
В начале раздела рассмотрены методы получения этиленгликоля из этплена или его производных, затем из метанола илп формальдегида п дано описание процессов получения этиленгликоля по методам, которые были реализованы в промышленпостп. В настоящее время в промышленности этиленгликоль производится практически только одним методом — гидратацией окиси этилена. [c.60]
Вследствие высокой температуры плавления терефталевой кислоты (возгоняется при 300°) и плохой ее растворимости в этиленгликоле для реакции ноликонденсации применяют обычно не кислоту, а ее диметиловый эфир, в процессе получения которого происходит также очистка терефталевой кислоты. Разработке методов получения терефталевой кислоты посвящено большое число исследований и патентов, нашедших отражение в обзорах [47, 48, 49, 67] и др. [c.699]
В растворе. Приведенный здесь метод является обработкой метода, упомянутого Бауэром [3 и о,писанного значительно более детально Мюллером 4], а также в немецком патенте 15]. Лиман [6] указал метод получения полимера диизоцианага этиленгликоля в растворе. В этих работах приведены температуры плавления большого числа полимеров такого типа [c.76]
Лиман [6] указал метод получения полимера диизоцианага этиленгликоля в растворе. В этих работах приведены температуры плавления большого числа полимеров такого типа [c.76]
Щавелевая кислота производится в промышленном масштабе. Описанные в литературе методы получения ш,авелевой кислоты могут быть разделены на две группы. Первую, наиболее многочисленную группу составляют методы, основанные на окислении различных соединений, вторую — методы, основанные на синтезе щавелевой кислоты из окиси углерода. В первой группе методов в качестве исходного сырья используют углеводы, древесину, каменный уголь, торф, сланцы, отходы целлюлозной промышленности, олефины, этиленгликоль и другие продукты. Окисление осуществляют азотной кислотой, перманганатом калия, кислородом и другими химическими агентами или биохимическим способом. [c.26]
Фтористые алкилы были получены реакцией между элементарным фтором и парафинами присоединением фтористого водорода к олефинам реакцией алкилгалогенндов с фтористой ртутью , с двухфтористой ртутьюс фтористым серебром ь или с фтористым калием под давлением Изложенная методика основана на способе Гофмана , который заключается во взаимодействии безводного фтористого калия с алкилгалогенидом при атмосферном давлении в присутствии этиленгликоля, который берется в качестве растворителя неорганического фторида. Получаемый фтористый алкил обычно содержит небольшую примесь олефина, которую легко удалить обработкой раствором брома и бромистого калия. Опубликован обзор методов получения алкилмонофторидов [c.70]
Получаемый фтористый алкил обычно содержит небольшую примесь олефина, которую легко удалить обработкой раствором брома и бромистого калия. Опубликован обзор методов получения алкилмонофторидов [c.70]
Хлор в больших количествах используется также при производстве некоторых продуктов, не содержаш их его в окончательном виде. В производствах сульфонола, этиленгликоля, глицерина в качестве промежуточных продуктов применяются такие Хлорсодержащие соединения, как хлоркеросин, хлористый аллил. При получении конечного продукта хлор выводится из системы в виде хлоридов металлов (Na l, a lj) или хлористого водорода. В по-следнее время наблюдается тенденция к вытеснению хлорных методов получения этих продуктов и замене их бесхлорными, так как [c.10]
В данном разделе изучена возможность получения р-хлоралкиловых моноэфиров этиленгликоля исходя из доступных олефинов, алкилгипохлоритов и этиленгликоля с целью разработки метода получения замещенных 1,4-диоксанов на их основе. [c.13]
[c.13]
В 1939-1941 гг. английские химики открыли реакцию поликонденсации терефталевой кислоты и этиленгликоля с образованием полиэфира, способного давать прочное волокно и пленку. Высокие темпы развития производства полиэфирного волокна вызвали интенсивное исследование процесса окисления п-ксилола с целью нахождения наиболее эффективных методов получения терефталевой кислоты (ТФК) и ее диметилового эфира (ДМТ). [c.345]
Хлоргидриппый метод в последнее время почти полностью вытеснен гидратацией окиси этилена, получаемой каталитическим окислением этилена. Таким образом, все способы получения этиленгликоля из хлорпроизводных этилена утратили промышленное значение, так как пх использование сопряжено с расходом значительных количеств хлора, получением больших количеств химически загрязненных сточных вод и рядом других недостатков. [c.62]
По другому способу [101], этиленгликоль, полученный в качестве побочного продукта при производстве окиси этилена, подщелачивается и перегоняется при пониженном давлении для отделения от тяжелокииящнх примесей. Вода отгоняется вместе с легкокипя-щпми примесями, а кубовый остаток прн 80 °С обрабатывается активированным углем, после чего подвергается ректификации при температуре в кубе колонны не выше 200 °С (лучше при 180 °С). Полученный этиленгликоль пригоден для производства синтетического волокна. Очистку этиленгликоля можно также проводить методом противоточной дистилляции с водяным паром. [c.90]
Вода отгоняется вместе с легкокипя-щпми примесями, а кубовый остаток прн 80 °С обрабатывается активированным углем, после чего подвергается ректификации при температуре в кубе колонны не выше 200 °С (лучше при 180 °С). Полученный этиленгликоль пригоден для производства синтетического волокна. Очистку этиленгликоля можно также проводить методом противоточной дистилляции с водяным паром. [c.90]
Цель и задачи опыта. Изучение реакции гидролиза этиленхлоргидрина в этиленгликоль в присутствии щелочи, знакомство с методом проведения гомогенно-каталитической реакции гидролиза на указанном примере. Определение веса полученного этиленгликоля, выхода его на взятый этиленхлоргидрин, плотности и показателя преломления. Сравнение характеристик полученного продукта с литерасурными. [c.210]
В лабораторных условиях разработан метод получения изомерных кислот Сю с выходом 84—86% от теорет., считая на 1,3-бутадиен при соотношении натрия к 1,3—бутадиену, равном 1,1 1 (в молях), в среде диэтилового эфира этиленгликоля в присутствии /г-терфенила и температуре реакции —35 —40° С.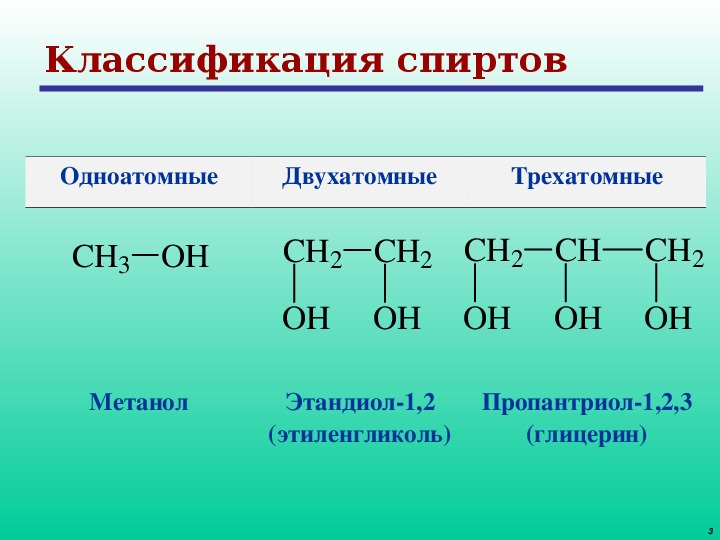 Подробная методика получения смеси кислот Сю, стояш ая из стадии получения дисперсии металлического натрия, димери-созации 1,3-бутадиена, карбонизации динатрийоктадиенов, выделения непредельных кислот из реакционной смеси и гидрирования, описана в нашем первом сообщении [14]. [c.213]
Подробная методика получения смеси кислот Сю, стояш ая из стадии получения дисперсии металлического натрия, димери-созации 1,3-бутадиена, карбонизации динатрийоктадиенов, выделения непредельных кислот из реакционной смеси и гидрирования, описана в нашем первом сообщении [14]. [c.213]
Как разводить этиленгликоль водой? | Статьи и обзоры «Техноформ»
Раствор этиленгликоля– это эффективный теплоноситель для систем охлаждения и кондиционирования воздуха, холодильных установок и других инженерных систем жилых и производственных объектов.
Сегодня производители выпускают антифризы в двух вариантах: готовый водно-гликолевый раствор выбранной концентрации либо концентрированный раствор гликоля, который требует разведения. При покупке важно учитывать климатические условия использования оборудования.
- Если вы приобретаете готовый раствор с массовой долей гликоля 20-22%, а его морозостойкость соответствует требованиям системы, то заниматься разбавлением не нужно.

- Другая ситуация, если куплен концентрированный антифриз с массовой долей гликоля 40% и более. Специалисты утверждают, что применение концентрированных растворов допустимо лишь для условий Крайнего Севера с экстремально низкими температурами.
Производители не выпускают антифризы с содержанием гликолей более 70%, ведь увеличение доли гликоля в растворе не ведет к снижению температуры замерзания. Более того, ухудшаются многие теплопередающие свойства, увеличивается вязкость, что негативным образом отражается на работоспособности системы.
Свойства и необходимость разведения
По химическому составу раствор этиленгликоля – это простой двухатомный спирт. Физические свойства – маслянистая жидкость с температурой замерзания всего 13 градусов ниже нуля, температурой кипения – +196 градусов.
Низкий температурный порог является существенным недостатком чистого гликоля, поэтому важно увеличить его рабочий диапазон путем добавления воды. Разведение раствора этиленгликоля позволяет получить более низкие физические характеристики – температуры замерзания падает до 40-65 градусов ниже нуля, а вязкость и теплопроводность делают перенос тепла по инженерной системе эффективным.
Разведение раствора этиленгликоля позволяет получить более низкие физические характеристики – температуры замерзания падает до 40-65 градусов ниже нуля, а вязкость и теплопроводность делают перенос тепла по инженерной системе эффективным.
Требования к воде и рекомендуемые пропорции
Концентрированный раствор этиленгликоль допустимо разбавлять лишь деминерализованной или умягченной водой (показатель жесткости не должен превышать 5 мг на эквивалент). Это делается для того, чтобы растворенные соли не приводили к образованию осадка, засоряющего климатическую систему и ухудшающую теплообмен оборудования.
Производители не рекомендуют заливать теплоноситель с концентрацией гликоля более 70 %, ведь он имеет повышенную вязкость и создает дополнительную нагрузку на насосное оборудование. Концентрированный раствор гликоля также обладает сниженной теплопроводностью, что негативным образом отражается на эффективности работы климатической системы.
Кроме того, для получения работоспособного раствора необходимо учитывать климатические условия, в которых будет использоваться оборудование. Если речь идет о приобретенном растворе гликоля с объемной долей выше 40%, то температура замерзания такого антифриза составит 65 градусов ниже нуля.
В умеренных широтах это практически исключено, поэтому в целях экономии можно разбавить раствор водой, увеличив температуру замерзания до следующих показателей:
- Разведение в пропорции 1 к 1 позволяет добиться температуры замерзания в – 35-40 градусов;
- Разбавление в пропорции два литра концентрированного раствора гликоля на три литра воды -30 градусов ниже нуля;
- Пропорция 1 к 2 – 20 градусов ниже нуля.
Актуальность процедуры и меры безопасности
Не стоит забывать, что раствор этиленгликоля является токсичным веществом, поэтому при использовании водно-гликолевой смеси в климатических системах отопления допускаются лишь конструкции с закрытым контуром.
При использовании в двухконтурном котле антифриз может попасть в систему горячего водоснабжения. Работать с концентрированным раствором гликолем допустимо лишь в средствах индивидуальной защиты – маске, перчатках и очках. При случайной утечке необходимо заменить внешние элементы системы, вступившие в контакт с раствором этиленгликоля.
Производители предлагают нам выбор: довериться профессионализму их технологов и приобрести готовый состав или сэкономить, занявшись разбавлением концентрированного раствора гликоля самостоятельно. В ассортименте компании «ТЕХНОФОРМ» можно подобрать антифриз из линейки Hot Stream на основе этиленгликоля с пакетом карбоксилатных присадок.
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Что такое Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие 1 двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°.
Простейшим алкеном является этилен (C2H4).
По номенклатуре IUPAC:
- названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»;
- положение двойной связи указывается арабской цифрой.
Алкены, число атомов углерода в которых больше 2х, (т. е. кроме этилена) имеют изомеры.
Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии.
Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2).
С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкены химически активны.
Их химические свойства во многом определяются наличием двойной связи.
Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения.
Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены являются важнейшим химическим сырьем.
Промышленное использование этиленаЭтилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты.
Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Мировое производство этилена составляет порядка 100 млн т/год (по данным на 2005 г: 107 млн т).
Промышленное использование пропилена
Пропилен в промышленности применяется в основном для синтеза полипропилена (62% всего выпускаемого объема).
Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн т/год.
По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объемы его производства, причем, ожидается, что к 2010 г. объем его мирового выпуска достигнет 90 млн т/год.
Промышленное использование прочих алкенов
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ.
Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10-С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
МЭГ, ДЭГ, ТЭГ (гликоли)
Характеристики:
Гликоль МЭГ (Этиленгликоль) — это двухатомный спирт, классический представитель многоатомных спиртов. Он представляет собой бесцветную жидкость маслянистой консистенции, запаха не имеет и обладает сладким вкусом.
Основной промышленный способ получения этиленгликоля — гидратация оксида этилена при 10 атм и 200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной кислоты.
Химическая формула: C2H6O2.
Данный спирт широко применяется в технической промышленности:
— Используют в роли теплоносителя с содержанием не более 50 % в системах отопления.
— Используется как элемент автомобильных антифризов и тормозных жидкостей.
— Применен в роли теплоносителя в качестве раствора в автомобилях, а также в системах охлаждения компьютеров.
— Этиленгликоль является весьма эффективным высокотемпературным растворителем.
Гликоль ДЭГ (Диэтиленгликоль) — это двуэтиленовый спирт, классический представитель двухатомных спиртов.
Спирт представляет собой прозрачную вязкую жидкость. Обладает сладким вкусом. Отлично растворяется в воде, низших спиртах, ацетоне, анилине и феноле. Не растворим в минеральных и растительных маслах.
Химическая формула: C4h20O3.
Получить данное вещество можно несколькими способами:
Оксиэтилирование этиленгликоля; cинтез этиленгликоля из этиленоксида.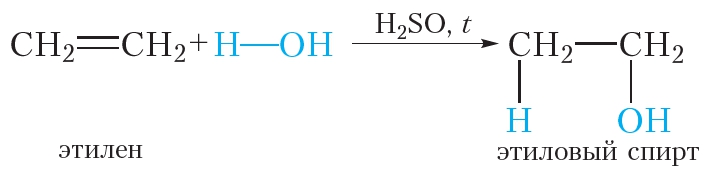
— В основном используется в качестве сырья при изготовлении эфиров, полиуретанов и олигоэфиракрилатов.
— Часто используется как пластификатор, экстрагент ароматических углеводородов из катализатов риформинга, а кроме этого, увлажнитель табака.
— Диэтиленгликоль — эффективный растворитель нитратов целлюлозы и полиэфирных смол.
Гликоль ТЭГ (Триэтиленгликоль) — это бесцветная вязкая жидкость, не имеет запаха.
Химическая формула: C6h24O4.
Используется в нескольких областях:
— Используют в роли пластификатора для винила, а кроме этого, выполняет функции дезинфицирующего средства.
— Применяется как жидкий осушитель для природного газа и в системах кондиционирования воздуха.
Свойства данных спиртов:
|
Характеристики |
МЭГ |
ДЭГ |
ТЭГ |
|
Молярная масса |
62,068 г/моль |
106,12 г/моль |
150,17 г/моль |
|
Плотность |
1,113 г/см³ |
1,118 г/см³ |
1,1 г/см³ |
|
Температура кипения |
197,3 °C |
244-245 °C |
285 °C |
|
Температура плавления |
−12,9 °C |
-7. |
— |
|
Температура вспышки |
111 °C |
— |
— |
Химия — 11
Этиленгликоль — простейший представитель предельных двухатомных спиртов (гликолей). Общая формула предельных двухатомных спиртов CnH2n(OH)2 или CnH2n+2O2.
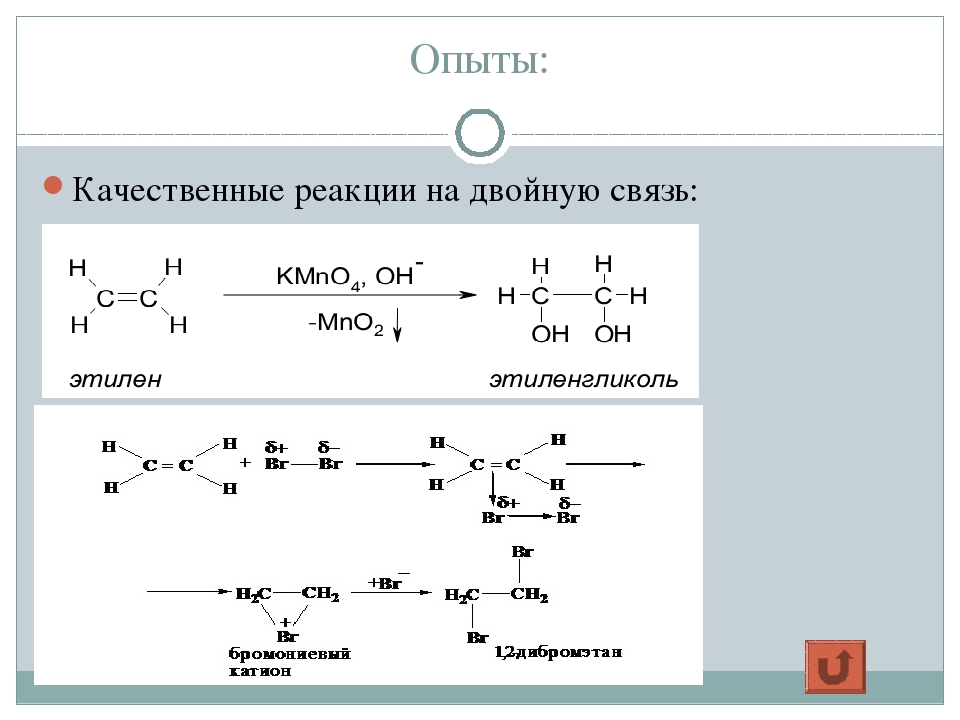
Получение. В лаборатории этиленгликоль можно получить окислением этилена раствором перманганата калия:
В промышленности этиленгликоль получают следующими способами:
— гидратацией оксида этилена:
— каталитическим окислением этилена пероксидом водорода: — гидролизом 1,2-дигалогенопроизводных этана в присутствии щелочи или соды: Физические свойства.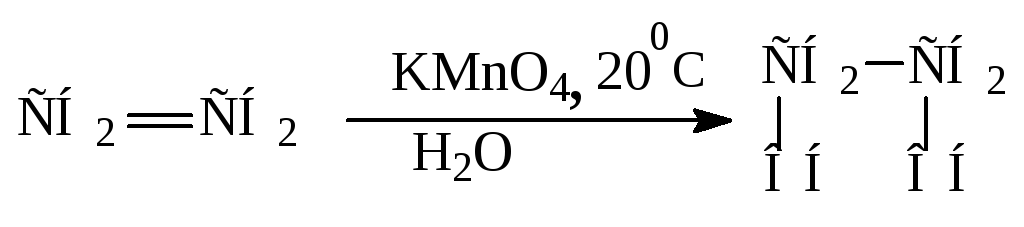 Этиленгликоль — бесцветная сиропообразная, сладкая на вкус жидкость. Очень ядовитое вещество; замерзает при -13,2°С, кипит при +197,6°С. Высокая температура кипения и вязкость этиленгликоля обусловлена возникновением достаточно сильных межмолекулярных водородных связей между -ОН группами.
Этиленгликоль — бесцветная сиропообразная, сладкая на вкус жидкость. Очень ядовитое вещество; замерзает при -13,2°С, кипит при +197,6°С. Высокая температура кипения и вязкость этиленгликоля обусловлена возникновением достаточно сильных межмолекулярных водородных связей между -ОН группами.
Этиленгликоль хорошо растворяется в воде и этаноле. Хорошая растворимость в этих растворителях связана с образованием водородных связей между молекулами этиленгликоля и воды, а также этиленгликоля и этанола.
Химические свойства. Этиленгликоль взаимодействует с щелочными металлами, щелочами, а также с органическими и неорганическими кислотами:
Изучи
Нахождение молекулярной формулы многоатомных спиртов
Определите молекулярную формулу X.
| Предельный спирт | Число моль спирта | Число моль Н2, образовавшегося при полном взаимодействии с Na | Масса полученного алкоголята натрия (г) |
| X | 0,2 | 0,2 | 21,2 |
Argus Ethylene and Derivatives | Argus Media
Еженедельное издание Argus Ethylene and Derivatives содержит ключевые ценовые эталоны для контрактных и спотовых партий этилена и его производных продуктов, отраслевые новости и анализ основных экономических факторов, влияющих на рыночную ситуацию.
Основные преимущества
- Еженедельные обновления: Регулярно получайте актуальную информацию о мировом рынке этилена для быстрого принятия коммерческих решений.
- Подробное освещение мирового рынка в одном обзоре: Подробная информация о предложении и спросе на мировом рынке этилена, влияющая на ваши основные финансовые показатели.

- Сжатая аналитика: Поймите причины недавних изменений на рынке, опираясь на удобные для восприятия графики, таблицы и комментарии экспертов.
- Краткосрочные тенденции: Узнайте прогнозы экспертов на ближайшее будущее и используйте эту информацию в своих целях.
- Сведения о ключевых типах сырья: Помимо изучения рынка этилена вы также можете узнать, какую роль в вашем бизнесе играет сырье, например нафта и ШФЛУ.
- Экспертные знания, которым можно доверять: Положитесь на опытных и авторитетных экспертов Argus, которые помогут вам сохранить конкурентоспособность на мировом рынке этилена.
Ключевые особенности
- Еженедельный обзор мирового рынка этилена
- Обзор цен на мировом рынке по регионам
- Обзоры регионального производства, рыночные комментарии и аналитика
Освещаемые рынки
- Этилен
- Этиленгликоль
- Полиэтилен высокой плотности (ПЭВП)
- Полиэтилен низкой плотности (ПЭНП)
- Линейный полиэтилен низкой плотности (ЛПНП)
- Дихлорэтан и поливинилхлорид (ПВХ)
Целевая аудитория
- Торговые компании
- Коммерческие менеджеры
- Менеджеры по закупкам
- Инвестиционные банки
Этиленгликоль как растворитель — Энциклопедия по машиностроению XXL
В промышленности в больших количествах вырабатывают и потребляют простейший из эпоксидов -—окись этилена. Окисление этилена, исходного сырья для получения этиленгликоля, растворителей, пластмасс и других химических продуктов, осуш,ествляется кислородом воздуха на серебряном катализаторе. Процесс окисления ведется под давлением 0,9—2,0 МПа при температуре 260—290 °С, если окислитель воздух, и при 230 °С, если окислитель кислород. Интенсивный отвод реакционного тепла в этом процессе весьма важен, так как при температуре выше 300 °С ускоряется реакция полного окисления этилена до двуокиси углерода и воды. Возможность эффективного съема тепла, образующегося при реакции, является одним из самых сложных вопросов при промышленном осуществлении процесса.
[c.9]
Окисление этилена, исходного сырья для получения этиленгликоля, растворителей, пластмасс и других химических продуктов, осуш,ествляется кислородом воздуха на серебряном катализаторе. Процесс окисления ведется под давлением 0,9—2,0 МПа при температуре 260—290 °С, если окислитель воздух, и при 230 °С, если окислитель кислород. Интенсивный отвод реакционного тепла в этом процессе весьма важен, так как при температуре выше 300 °С ускоряется реакция полного окисления этилена до двуокиси углерода и воды. Возможность эффективного съема тепла, образующегося при реакции, является одним из самых сложных вопросов при промышленном осуществлении процесса.
[c.9]
Перед пайкой флюсы необходимо замешать в воде или в спирте и нанести иа паяемое место до нагрева. Лучшие результаты получаются, если в качестве растворителя используется не этиловый спирт или вода, а многоатомные спирты глицерин, этиленгликоль, пропиленгликоль и др.
 Образующийся при пайке летучий эфир создает в зоне паяного шва газовую защиту от окисления кислородом воздуха.
[c.130]
Образующийся при пайке летучий эфир создает в зоне паяного шва газовую защиту от окисления кислородом воздуха.
[c.130]Дихлорэтан широко применяется в качестве растворителя в экстракционных процессах, при химчистке текстильных изделий, в лакокрасочной промышленности. Он является также сырьем для синтеза хлорвинила, этилендиамина, этиленгликоля и других соединений. [c.71]
В патентной литературе имеются также указания о возможности осаждения сплава с содержанием индия в широком интервале из неводного раствора перхлоратов свинца и индия. В качестве растворителя применяются производные простого эфира этиленгликоля [70]. Применяются аноды из сплавов с высоким содержанием индия. [c.149]
Алкидные смолы представляют собой продукты поликонденсации таких кислот, как малеиновая, адипиновая, фталевая и себациновая с глицерином, пентаэритритом и этиленгликолем. Из смол этого типа следует отметить глифталевые смолы , получаемые взаимодействием фталевого ангидрида и глицерина. В процессе нагревания этих смол происходит сшивка цепей между собой и из плавкого вещества они превращаются в неплавкие. Но процесс отверждения протекает медленнее, чем у резольных смол и при более высокой температуре. Поэтому для приготовления прессовочных смесей глифталевые смолы распространения не получили. Они служат для приготовления быстро высыхающих лаков на летучих растворителях и масляных лаков. Глифталевые смолы применяют также в качестве клея при изготовлении электротехнических слюдяных композиций (миканит, микафолий).
[c.24]
В процессе нагревания этих смол происходит сшивка цепей между собой и из плавкого вещества они превращаются в неплавкие. Но процесс отверждения протекает медленнее, чем у резольных смол и при более высокой температуре. Поэтому для приготовления прессовочных смесей глифталевые смолы распространения не получили. Они служат для приготовления быстро высыхающих лаков на летучих растворителях и масляных лаков. Глифталевые смолы применяют также в качестве клея при изготовлении электротехнических слюдяных композиций (миканит, микафолий).
[c.24]
На крышке растворителя установлен состоящий из трубчатого теплообменника с рубашкой обратный холодильник 5, назначение которого конденсировать пары этиленгликоля, а также имеются два смотровых [c.97]
Растворитель снабжен воздушником и штуцерами для загрузки ДМТ, выхода раствора, подачи этиленгликоля, подачи азота, входа пара в рубашку, выхода конденсата. [c.97]
Эмаль пентафталевая № 64-К серая (ТУ ЯН 63—58). Пленки эмали устойчивы к резкому изменению температуры от —60 до + 70° С, устойчивы к периодическому воздействию минерального масла, этиленгликоля и воды при температуре +50° С. Применяется для окраски конденсаторов и приборов, эксплуатируемых в помещениях, — группа п. Эмаль наносится без грунта в два слоя. Сушка эмали производится при 50—55° С в течение 4 ч. Растворитель бензин Б-70 или ксилол.
[c.34]
Пленки эмали устойчивы к резкому изменению температуры от —60 до + 70° С, устойчивы к периодическому воздействию минерального масла, этиленгликоля и воды при температуре +50° С. Применяется для окраски конденсаторов и приборов, эксплуатируемых в помещениях, — группа п. Эмаль наносится без грунта в два слоя. Сушка эмали производится при 50—55° С в течение 4 ч. Растворитель бензин Б-70 или ксилол.
[c.34]
На крышке растворителя установлен обратный холодильник 5, назначение которого конденсировать пары этиленгликоля. — [c.104]
Удовлетворение перечисленных требований достигается обычно составлением рабочих жидкостей из двух компонентов маловязкого, используемого в качестве растворителя (спирт, эфиры), и вязкого, обладающего смазывающим свойством (касторовое масло, глицерин и т. п.). К числу таких смесей, используемых в эксплуатационной практике, относятся смеси этилового или бутилового спирта (50%) с глицерином (50%), изобутилового спирта (55%) с касторовым маслом (45%), моноэтиловый эфир этиленгликоля (70%) и касторового масла (30%), диацетоновый 10 147
[c. 147]
147]
Этилцеллюзольв (моноэтиловый эфир этиленгликоля) продукт взаимодействия окиси этилена и этилового спирта. Пизколетучпй растворитель. Технический продукт (ГОСТ 8313—76) выпускают трех сортов высшего, 1-го и [c.310]
Органические бесканифоль-н ы е флюсы. 1. Активная часть — органические кислоты (молочная, олеиновая, салициловая, стеариновая, глютаминовая, фталевая)- -носитель (вода, органические растворители, петролатумная паста, этиленгликоль, глицерин). [c.118]
Реакция эпихлоргидрина с быс-фенолом заключается во взаимодействии как хлора, так и эпоксидных групп эпихлоргидрина с обои.ми гидроксилами бис-фенола. Состав полученного продукта зависит от отношения количеств исходных компонентов, использования прерывателей цепи, а также от температуры и давления во время процесса. Следует помнить, что эпоксидное кольцо довольно легко гидролизуется. Эта реакция используется для получения этиленгликоля из окиси этилена, как показано в уравнении (1) (см. схему 28). Отношение количеств воды и окиси этилена определе-ляет состав получающегося продукта, как это видно из уравнения (2) процесса получения диэтиленгликоля. Реакция окиси этилена со спиртами используется для производства ряда эфирно-спиртовых растворителей, известных под названием целлозольвы (см. уравнение 3). Аналогичная реакция протекает и с быс-фенолом, как это видно из уравнения (4). Следует отметить, что структура в скобках уравнения (4) является структурным звеном уравнения (8). Структуру этого звена можно изменить, меняя соотношение количеств эпихлоргидрина и бис-фенола. Увеличение количества эпихлоргидрина вызывает увеличение числа гидроксильных групп в звене.
[c.359]
схему 28). Отношение количеств воды и окиси этилена определе-ляет состав получающегося продукта, как это видно из уравнения (2) процесса получения диэтиленгликоля. Реакция окиси этилена со спиртами используется для производства ряда эфирно-спиртовых растворителей, известных под названием целлозольвы (см. уравнение 3). Аналогичная реакция протекает и с быс-фенолом, как это видно из уравнения (4). Следует отметить, что структура в скобках уравнения (4) является структурным звеном уравнения (8). Структуру этого звена можно изменить, меняя соотношение количеств эпихлоргидрина и бис-фенола. Увеличение количества эпихлоргидрина вызывает увеличение числа гидроксильных групп в звене.
[c.359]
Метилцеллозольв (монометиловый эфир этиленгликоля) (ТУ 6-09-4398— 7) получают взаймодействием оксида этилена с метиловым спиртом. Является растворителем нитратов и ацетатов целлюлозы, поливинилацетата, природных и синтетических смол. Текстильно-вспомогательное вещество, компонент аппретур для кож, присадка к топливам для предотвращения образования льда, разделяющий агент для азеотропной ректификации спиртов и углеводородов, растворитель в парфюмерии. Продукт растворим в воде и органических растворителях.
[c.43]
Продукт растворим в воде и органических растворителях.
[c.43]
Бутилцеллозольв (монобутиловый эфир этиленгликоля) (МРТУ 6-01-222—68) —прозрачная жидкость, обладающая слабым приятным запахом и низкой летучестью. Получают путем оксиэтилирования нормального бутилового спирта. Растворитель нитратов и ацетатов целлюлозы, природных и синтетических емол, минеральных масел компонент составов для химической чистки одежды текстильно-вспомогательное вещество. Разделяющий агент для азеотропной ректификации углеводородов и спиртов присадка к автомобильным бензинам для предотвращения образования льда в смеси с бутиловым спиртом (38 62) используют в производстве водоразбавляемых лаков и красок. [c.44]
Диэтиленгликоль — бесцветная жидкость плотность при 15°С — 1,1197 г/см температуры плавления— минус 8°С, кипения— 245 °С коэффициент преломления лри 20 С— 1,4472. Более эффективен по растворяющей способности, чем этяленгли-коль. Применяют как растворитель масел, нитратцеллюлозы, смол. Получают аналогично этиленгликолю. Для этих же целей применяют и пропиленгликоль.
[c.59]
Получают аналогично этиленгликолю. Для этих же целей применяют и пропиленгликоль.
[c.59]
Триэтиленгликоль и тетраэтиленгликоль получают при взаимодействии оксида этилена с водой и этиленгликолем. Характеризуются низкой токсичностью, хорошей растворяющей способностью. По свойствам близки к диэтиленгликолю. Применяют в качестве растворителей и пластификаторов в лакокрасочных материалах. [c.59]
Повышенной токсичностью обладают растворители и ТМС, содержащие хлорированные компоненты, а также эфиры, спир-tbi и этиленгликоль. Эти вещества необходимо хранить в герметически закрытой таре с соответствующей надписью Осторож-йо и Ядовитые вещества . Все работы, связанные с применением растворителей и ТМС, необходимо проводить в хорошо вентилируемом помещении, при условии контроля концентрации [c.160]
В 3%-ой концентрации смесь входит в состав композиции, содержащей нафталиновую кислоту канифоль натрий, гидрат окиси натрий сульфонокис-лый этиленгликоль, бутиловый эфир (моно) смазочное масло пенообразователь растворитель (керосин, бензин) и воду.
 [c.149]
[c.149]Фурфурол С4Н3ОСНО — гетероциклический альдегид фурано-вого ряда — обладает высокой селективностью и хорошей растворяющей способностью [10]. Свежеперегнанный фурфурол — бесцветная жидкость, хорошо растворимая во многих органических растворителях (этиловом спирте, эфире, ацетоне, бензоле, хлороформе, этиленгликоле, бутиловом и изобутиловом спиртах). Во всех отношениях смешивается с муравьиной, уксусной, пропионовой и масляной кислотами. [c.240]
Дихлорэтан в ряду других хлорорганических растворителей является весьма стабильным соединением, в частности он устойчив к воздействию воды. Гидролиз его с образованием хлористого водорода и этиленгликоля протекает с чрезвычайно малой скоростью даже при температуре кипения. Однако стабильность дихлорэтана существенно понижается при нагревании под давлением. Согласно данным Голева [1], кислотность влажного дихлорэтана, при 90° С не превышающая 0,066%, при 110° возрастает до 0,4%, а при 140° до 7—12%.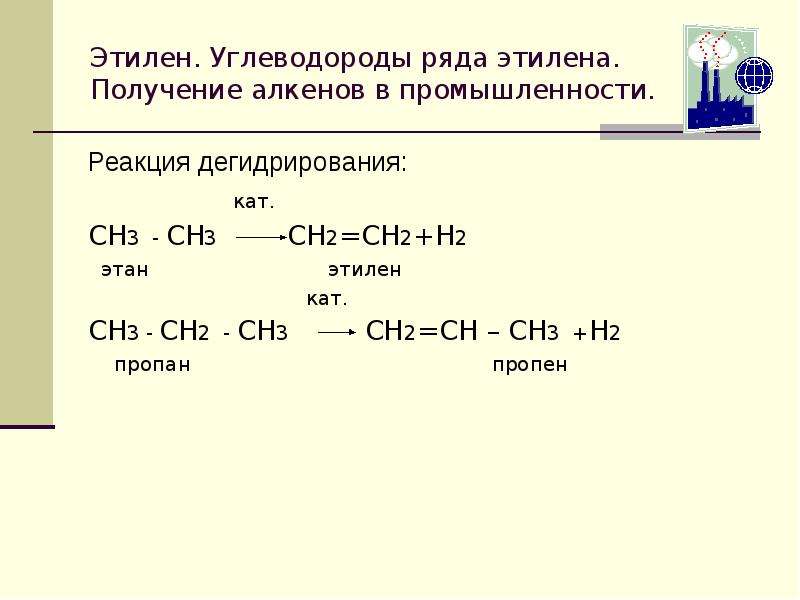 Свет и кислород воздуха отрицательно влияют на стабильность дихлорэтана, но это действие становится заметным при температуре кипения и более высоких температурах.
[c.67]
Свет и кислород воздуха отрицательно влияют на стабильность дихлорэтана, но это действие становится заметным при температуре кипения и более высоких температурах.
[c.67]
Для обеспечения гомогенности реакционной среды рекомендуется [Л. 2-120] использовать в качестве растворителя для хлоруглеводоро-дов этиленгликоль 5 г хлорированного ароматического углеводорода смешивают с 25 мл 0,5 н. раствора КаОН в смеси, состоящей из 60% об. этиленгликоля и 40% об. метилового (этилового) спирта. Смесь оставляют при 25 °С яа 18 ч, после чего образовавшиеся хлориды титруют Потенциометрическим методам в среде ацетона или воды. В последнем случае результаты получаются несколько заниженными. [c.90]
Летучесть растворителя зависит от упругости его паров. Условно ее выражакэт отношением времени испарения капли данного растворителя с поверхности фильтровальной бумаги к времени испарения такого же количества серного эфира.. По значению относительной летучести растворители можно условно разделить на 3 группы легколетучие (ниже 7), среднелетучие (7—13) и медленно-летучие (выше 13). Из числа наиболее употребительных растворителей к легколетучим относятся ацетон, этилацетат, бензол, толуол, бензин, к среднелетучим — бутил- и амилацетаты, этиловый спирт, ксилол к медленнолетучим — скипидар, бутиловый спирт, этиловый эфир этиленгликоля (этилцелозольв) и др.
[c.360]
Из числа наиболее употребительных растворителей к легколетучим относятся ацетон, этилацетат, бензол, толуол, бензин, к среднелетучим — бутил- и амилацетаты, этиловый спирт, ксилол к медленнолетучим — скипидар, бутиловый спирт, этиловый эфир этиленгликоля (этилцелозольв) и др.
[c.360]
Жидкая грунтовая краска или лак смачивают как поверхность кожи, так и стенки капилляров и пор кол и. При этом глубина проникания в последние находится в прямой зависимости, с одной стороны, от вязкости и поверхностного натяжения краски и лака на поверхности волокон кожи, а с другой стороны от степени очистки поверхности и раскрытия пор лицевой поверхности кожи в результате ее обработки перед окрашиванием. Чем глубже в поры кожи попадает лак и чем лучше смачивает он поверхность пор, тем прочнее все покрытие в целом. На таких пористых материалах, как кол а, трудно достигнуть прилипания, ие обеспечив пропитывания и тем самым прочного механического сцепления. Совершенно понятно, что этого можно достигнуть только в том случае, если краска будет высыхать не очень быстро, и кожа успеет пропитаться еще жидкой краской. При этом, учитывая гидро-фильность кожи, необходимо иметь в составе краски достаточное количество гидрофильных растворителей. Из последних применяются моноэтиловый эфир этиленгликоля (целлозольв), циклогексанон, бутиловый спирт и др.
[c.419]
При этом, учитывая гидро-фильность кожи, необходимо иметь в составе краски достаточное количество гидрофильных растворителей. Из последних применяются моноэтиловый эфир этиленгликоля (целлозольв), циклогексанон, бутиловый спирт и др.
[c.419]
Удаление лакокрасочных покрытий осуществляется применением для этой цели растворителей, смывок, растворов щелочей и специального инструмента. Наибольшее распространение находит способ обработки деталей из черных металлов и их сплавов в ванне с водным раствором каустической соды массовой концентрацией 50. .. 100 г л при температуре 85 «С. Для интенсификации процесса снятия лакокрасочного покрытия в 2—3 раза в раствор вводят ускорители — трипропи-ленгликоль или смесь триэтаноламина с монофениловым эфиром этиленгликоля (1. .. 10 % массы каустической соды). [c.163]
Этилцеллозольв (МОНС0ТИЛОВЫЙ эфир этиленгликоля) ГОСТ 8313—60 — — Эпоксидные, а,также для изготовления смеси растворителей
[c. 38]
38]
К растворителям относятся вода сероуглерод группа углеводородов (бензол, толуол, ксилол, тетралин, скипидар, пентан, гексан, гептан, октан и ряд других углеводородов) группа нефтепродуктов (бензины, уайт-спирит и др.) хлор-лроизводные углеводородов (хлористый метил, хлороформ, четыреххлористый З глерод, хлорбензол, дихлорэтан и др.) группа спиртов (метиловый, этиловый, этиленгликоль, глицерин, ацетон, пропиловый, бутиловый, эмиловый и др.). [c.560]
Склеивание. В настоящее время наиболее широко для склеивания полиэтилентерефталатной пленки применяется клей на основе полиэфиров терефталевой и себациновой кислот и этиленгликоля. При определенном соотношении кислот указанные полиэфиры характеризуются пониженной, по сравнению с ПЭТФ, температурой плавления, хорошей растворимостью в ряде растворителей и каучукоподобными свойствами. Оптимальный по свойствам полиэфир получил обозначение ТФ-60, а клей на его основе, представляющий собой раствор смолы ТФ-60 в метиленхлориде, называется ТМ-60. [c.68]
[c.68]
Ассортимент строительных красок имеет специальные подразделы краски для пола, для защиты бетона, для плавательных бассейнов и т. д. Эти краски изготавливаются на основе различных связующих, однако основу ассортимента крупното-нажных декоративных красок строительного назначения составляют две группы красок водные и краски на растворителях (более точно водные и неводные ). В состав первой гругнш входит небольшое количество полярных растворителей, например спиртов или производных этиленгликоля, тогда как неводные группы красок обычно содержат алифатические растворители и иногда также некоторое количество ароматических углеводородов. [c.246]
Рудное бюро США [26] получило превосходные оловянноникелевые покрытия, осажденные из различных органических растворителей. Наилучшими растворителями для осаждения оловянноникелевого сплава являются ацетамид и этиленгликоль. Эти покрытия характеризуются меньшими напряжениями и лучшим качеством, чем те, которые получаются при осаждении из водного раствора. Таким образом, электроосаждением из органических растворителей можно получить более надежные покрытия, чем осаждением из водных растворов, которое дает пористые покрытия, характеризуемые значительными напряжениями.
[c.198]
Таким образом, электроосаждением из органических растворителей можно получить более надежные покрытия, чем осаждением из водных растворов, которое дает пористые покрытия, характеризуемые значительными напряжениями.
[c.198]
Жировые загрязнения обычно сильно затрудняют травление, и, чтобы ускорить удаление этих загрязнений, можно добавлять кислотоустойчивые поверхностноак-тивиые вещества. Существует, однако, класс кислотных моющих растворов, которые получили довольно широкое применение. В состав этих растворов входит фосфорная кислота, иоверхностноактивные вещества и растворимые в воде органические растворители, такие, какмоиобути-ловый эфир этиленгликоля, часто вместе с травильным ингибитором. С помощью таких моющих растворов легкие окислы удаляются вместе с органическими загрязнениями, а на поверхности остается незначительное количество слегка кислого остатка. Поскольку такой остаток благоприятно содействует адгезии лакокрасочных покрытий, главным назначением этих растворов является удаление легких загрязнений и окислов перед покраской металлической поверхности.
 [c.39]
[c.39]Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Путь к устойчивому производству этиленгликоля из возобновляемого ресурса, отходов биодизеля: обзор
Этиленгликоль (EG) — это товарный химикат, производимый в промышленных масштабах путем окисления нефтехимического сырья, этилена. Он имеет прямое применение в антифризах, помимо того, что является промежуточным продуктом последующей производственной линии пластмасс, таких как полиэтилентерефталат (ПЭТ). EG также может производиться через экологически безопасным способом с использованием возобновляемого биоресурса, называемого глицерином, отходов биодизельной промышленности. Гидрогенолиз этой биомолекулы с помощью гетерогенного катализа вызывает селективные расщепления C – O и C – C, которые приводят к образованию EG. Этот обзор охватывает i) механизмы производства EG, ii) гомогенный катализ и iii) гетерогенный катализ при производстве EG, выполняемый как в системах периодического, так и в непрерывном потоке реакторов. Роль переходных металлов и катализаторов из благородных металлов в превращении глицерина и селективности по отношению к EG критически анализируется в этой статье. В дополнение к этому, также подробно обсуждаются условия реакции, такие как pH, температура и давление, а также тип реактора, который способствует производству EG.Взвешивая преимущества гетерогенного катализа в устойчивом производстве ЭГ, были предложены различные методы для повышения эффективности и осуществимости существующих методов.
Гидрогенолиз этой биомолекулы с помощью гетерогенного катализа вызывает селективные расщепления C – O и C – C, которые приводят к образованию EG. Этот обзор охватывает i) механизмы производства EG, ii) гомогенный катализ и iii) гетерогенный катализ при производстве EG, выполняемый как в системах периодического, так и в непрерывном потоке реакторов. Роль переходных металлов и катализаторов из благородных металлов в превращении глицерина и селективности по отношению к EG критически анализируется в этой статье. В дополнение к этому, также подробно обсуждаются условия реакции, такие как pH, температура и давление, а также тип реактора, который способствует производству EG.Взвешивая преимущества гетерогенного катализа в устойчивом производстве ЭГ, были предложены различные методы для повышения эффективности и осуществимости существующих методов.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент. ..
Что-то пошло не так. Попробуй снова?
..
Что-то пошло не так. Попробуй снова?Токсичность этиленгликоля — StatPearls
Непрерывное образование
Этиленгликоль (C2H6O2) — токсичный спирт, который содержится в различных бытовых и промышленных веществах.Воздействие этиленгликоля может быть чрезвычайно опасным, если его не лечить, со значительной заболеваемостью и смертностью. Этиленгликоль — бесцветная жидкость со сладким вкусом, которая чаще всего встречается в антифризах, но иногда используется для других целей, например, в промышленных растворителях. Воздействие обычно наблюдается из-за случайного или преднамеренного проглатывания, сладкий вкус которого способствует случайному токсическому воздействию, тогда как преднамеренное воздействие может быть мотивировано попыткой самоубийства или желанием опьянения в отсутствие этанола. Воздействие этиленгликоля может вызывать различную степень токсичности, и лечение обычно требует поддерживающей терапии, тщательного лабораторного мониторинга и антидотной терапии. В этом упражнении рассматриваются этиология, проявления, оценка и лечение / профилактика токсичности этиленгликоля, а также рассматривается роль межпрофессиональной группы в оценке, диагностике и лечении состояния.
Воздействие этиленгликоля может вызывать различную степень токсичности, и лечение обычно требует поддерживающей терапии, тщательного лабораторного мониторинга и антидотной терапии. В этом упражнении рассматриваются этиология, проявления, оценка и лечение / профилактика токсичности этиленгликоля, а также рассматривается роль межпрофессиональной группы в оценке, диагностике и лечении состояния.
Цели:
Опишите основную патофизиологию и токсикокинетику токсичности этиленгликоля.
Изучите процедуры обследования и оценки для диагностики токсичности этиленгликоля, включая любые применимые лабораторные испытания.
Обобщите стратегию лечения и контроля токсичности этиленгликоля.
Объяснить стратегии межпрофессиональной группы для улучшения координации оказания помощи и сотрудничества с целью более эффективного выявления, скрининга и лечения токсичности этиленгликоля и улучшения результатов лечения пациентов.

Введение
Этиленгликоль (C2H6O2) — токсичный спирт, который содержится в различных бытовых и промышленных веществах. Термин «токсичные спирты» — это собирательный термин, который включает метанол, этиленгликоль и изопропиловый спирт. Воздействие этиленгликоля может быть чрезвычайно опасным, если его не лечить, со значительной заболеваемостью и смертностью. Этиленгликоль — бесцветная жидкость со сладким вкусом, которая чаще всего встречается в антифризах, но иногда используется для других целей, например, в промышленных растворителях.Воздействие обычно наблюдается из-за случайного или преднамеренного проглатывания, сладкий вкус которого способствует случайному токсическому воздействию, тогда как преднамеренное воздействие может быть мотивировано попыткой самоубийства или желанием опьянения в отсутствие этанола. Воздействие этиленгликоля может вызывать разную степень токсичности, и лечение обычно требует поддерживающей терапии, тщательного лабораторного мониторинга и антидотной терапии. Первичные методы лечения — этанол или фомепизол, а иногда и диализ.[1]
Первичные методы лечения — этанол или фомепизол, а иногда и диализ.[1]
Этиология
Токсичность этиленгликоля чаще всего возникает при проглатывании. Он имеет довольно ограниченное всасывание через кожу, в отличие от других спиртов, таких как метанол. [2] Большинство воздействий преднамеренное, как попытки самоубийства или, иногда, для опьянения. Дети, которые могут проглотить антифриз, исследуя окружающую среду, могут быть склонны потреблять значительно токсичные количества из-за его сладкого вкуса. [3]
Эпидемиология
К группам риска относятся малыши и маленькие дети, исследующие свое окружение, пациенты с алкогольным расстройством и суицидальные личности.[1] Согласно ежегодному отчету Национальной системы данных по ядам Американской ассоциации центров по борьбе с отравлениями, количество упоминаний этиленгликоля в 2016 году составило 6 374 случая. Большинство этих случаев были у взрослых старше 20 лет и были преднамеренными [4]. Дети в возрасте до 12 лет составили 686 из 6 374 известных случаев, 13 из которых неизвестны в детском возрасте [4].
Патофизиология
Этиленгликоль быстро всасывается в желудочно-кишечном тракте после приема внутрь, при этом концентрация в сыворотке крови достигает пика вскоре после приема внутрь.Объем распределения составляет около 0,7 л. Кг. Выведение происходит в первую очередь при концентрациях ниже 250 мг / дл с периодом полураспада примерно 4-6 часов [5]. При концентрациях выше 250 мг / дл выведение становится нулевым, вероятно, около 10 мг / кг / час. Когда алкогольдегидрогеназа ингибируется, предотвращая метаболизм, период полувыведения этиленгликоля увеличивается до 10-18 часов и зависит от почек. [6] [7]
Подобно этанолу и метанолу, метаболизм начинается с алкогольдегидрогеназы слизистой оболочки желудка и происходит главным образом в печени в результате последовательного окисления алкогольдегидрогеназой и альдегиддегидрогеназой, с каждой стадией восстановления NAD + до NADH.Этиленгликоль сначала окисляется алкогольдегидрогеназой до гликолевого альдегида, который затем окисляется альдегиддегидрогеназой до гликолевой кислоты, которая в первую очередь ответственна за связанный с этим метаболический ацидоз. Затем гликолевая кислота окисляется до глиоксиловой оксидазой гликолевой кислоты или лактатдегидрогеназой из-за ее сходства с лактатом. Глиоксиловая кислота является предшественником нефротоксического метаболита щавелевой кислоты; а также для нетоксичных метаболитов α-гидрокси-β-кетоадипиновой кислоты и глицина, который далее превращается в гиппуровую кислоту.Тиамин является кофактором при производстве α-гидрокси-β-кетоадипиновой кислоты, а пиридоксин и магний являются кофакторами при производстве глицина [1] [8] [9] [10]
Затем гликолевая кислота окисляется до глиоксиловой оксидазой гликолевой кислоты или лактатдегидрогеназой из-за ее сходства с лактатом. Глиоксиловая кислота является предшественником нефротоксического метаболита щавелевой кислоты; а также для нетоксичных метаболитов α-гидрокси-β-кетоадипиновой кислоты и глицина, который далее превращается в гиппуровую кислоту.Тиамин является кофактором при производстве α-гидрокси-β-кетоадипиновой кислоты, а пиридоксин и магний являются кофакторами при производстве глицина [1] [8] [9] [10]
Токсикокинетика
Потенциально смертельная доза этилена гликоль составляет примерно 1-2 мл / кг 95% концентрированного раствора или примерно 1500 мг / кг. [11] Этиленгликоль, исходное соединение, действует опьяняюще, но обычно считается нетоксичным. Исходное соединение является осмотически активным и отвечает за повышенную осмоляльность, наблюдаемую на раннем этапе воздействия до метаболизма.Метаболиты этиленгликоля ответственны за метаболический ацидоз анионной щели. Хотя есть доказательства того, что каждый из метаболитов токсичен, считается, что именно гликолевая кислота является достаточно долгоживущей, чтобы в первую очередь отвечать за метаболический ацидоз анионной щели, в то время как щавелевая кислота отвечает за связанное с ней повреждение органов-мишеней, нефротоксичность. . Отложения щавелевой кислоты в почечных канальцах в виде нерастворимого моногидрата оксалата кальция, что приводит к некрозу проксимальных канальцев. Сродство щавелевой кислоты к кальцию может привести к гипокальциемии, которая может быть связана с тетанией, судорогами и удлинением интервала QT на электрокардиограмме.Важно понимать, что увеличенный осмолярный зазор может присутствовать на ранней стадии после токсического воздействия до значительного метаболизма, но по мере того, как курс прогрессирует, осмолярный зазор закрывается, и метаболизм приводит к развитию метаболического ацидоза анионного зазора без увеличения осмолярного зазора. [11] [8] [9]
Хотя есть доказательства того, что каждый из метаболитов токсичен, считается, что именно гликолевая кислота является достаточно долгоживущей, чтобы в первую очередь отвечать за метаболический ацидоз анионной щели, в то время как щавелевая кислота отвечает за связанное с ней повреждение органов-мишеней, нефротоксичность. . Отложения щавелевой кислоты в почечных канальцах в виде нерастворимого моногидрата оксалата кальция, что приводит к некрозу проксимальных канальцев. Сродство щавелевой кислоты к кальцию может привести к гипокальциемии, которая может быть связана с тетанией, судорогами и удлинением интервала QT на электрокардиограмме.Важно понимать, что увеличенный осмолярный зазор может присутствовать на ранней стадии после токсического воздействия до значительного метаболизма, но по мере того, как курс прогрессирует, осмолярный зазор закрывается, и метаболизм приводит к развитию метаболического ацидоза анионного зазора без увеличения осмолярного зазора. [11] [8] [9]
История и физика
Историю часто сложно получить в случае умышленной попытки членовредительства или злоупотребления психоактивными веществами, и физический осмотр часто может быть нормальным в начале курса.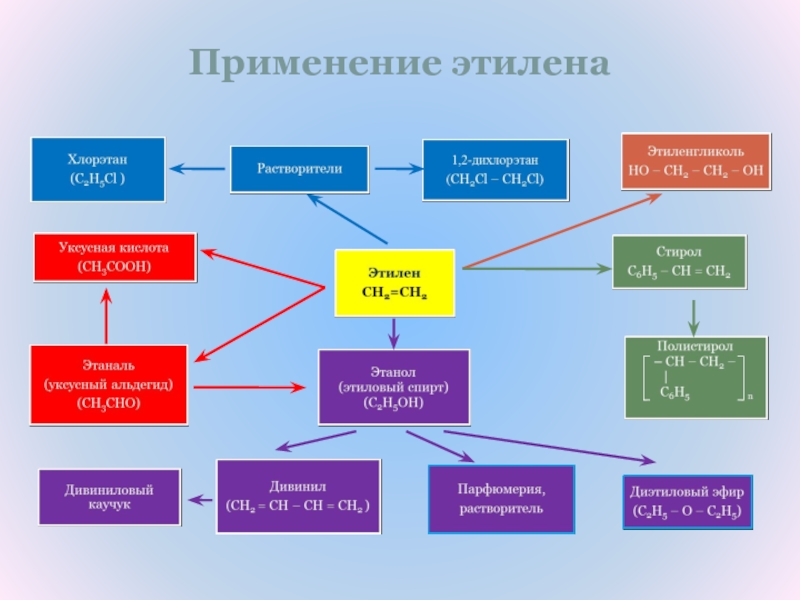 Многие пациенты могут быть смущены или не хотят признаваться в своих действиях. Пациенты также часто недооценивают масштабы и тяжесть своего проглатывания. Однако о случайном проглатывании часто сообщают сами или становятся свидетелями. Часто возникает диагностическая дилемма, и врач должен рассматривать токсическое воздействие алкоголя как этиологию таких открытий, как метаболический ацидоз с повышенным анионным разрывом или, в данном случае, потенциально с повреждением почек [1].
Многие пациенты могут быть смущены или не хотят признаваться в своих действиях. Пациенты также часто недооценивают масштабы и тяжесть своего проглатывания. Однако о случайном проглатывании часто сообщают сами или становятся свидетелями. Часто возникает диагностическая дилемма, и врач должен рассматривать токсическое воздействие алкоголя как этиологию таких открытий, как метаболический ацидоз с повышенным анионным разрывом или, в данном случае, потенциально с повреждением почек [1].
Тяжесть заболевания будет варьироваться со временем от воздействия до проявления, если произошло совместное употребление этанола или было ли доступно раннее лечение.Токсичность этиленгликоля обычно проявляется различной степенью опьянения в начале курса, что может привести к угнетению центральной нервной системы (ЦНС). В это время часто наблюдается повышенный осмолярный зазор без повышенного анионного зазора или ацидоза. Когда концентрация этиленгликоля смещается в сторону производства метаболитов, осмолярный разрыв уменьшается, а анионный разрыв увеличивается с развитием метаболического ацидоза.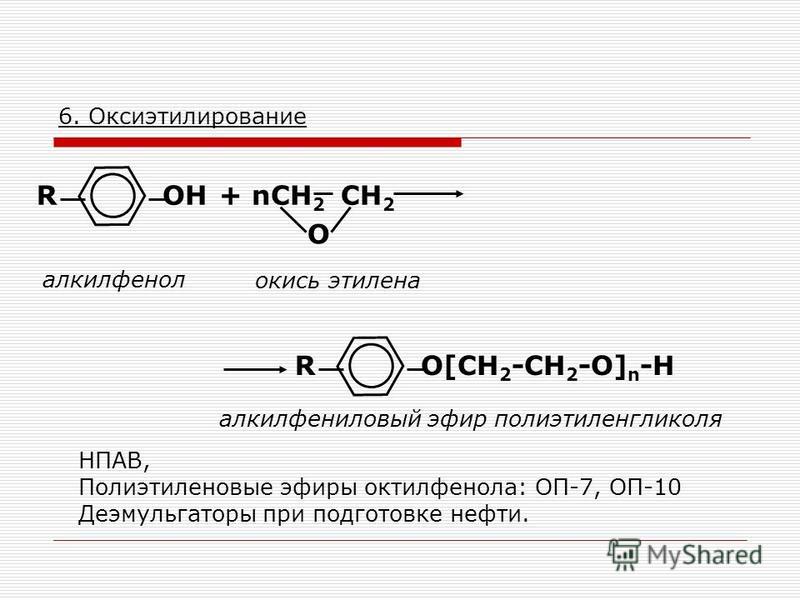 Проглатывание этанола в любой момент остановит метаболизм этиленгликоля.Поскольку этиленгликоль прогрессивно метаболизируется в течение 4-12 часов, метаболический ацидоз анионной щели развивается вторично по отношению к накоплению гликолевой кислоты. В это время пациент может чувствовать себя плохо или у него может быть угнетение ЦНС, и он может начать компенсировать это за счет гипервентиляции или гиперпноэ. Также могут возникнуть тахикардия и гипертония. Примерно через 12 часов могут появиться признаки нефротоксичности, проявляющиеся в повышении креатинина из-за осаждения кристаллов оксалата кальция в проксимальных канальцах.Такое отложение оксалата кальция может предрасполагать к гипокальциемии, подвергая пациента риску тетании, судорог, удлинения интервала QT и аритмий. Примерно через 12-18 часов может развиться олигурия. Если лечение проводится в это время, острое повреждение почек обычно обратимо, и диализ часто не требуется. Однако, если лечение откладывается в дальнейшем, обычно из-за позднего проявления или распознавания, может развиться острая почечная недостаточность и системное заболевание, включая острый респираторный дистресс-синдром, отек или инфаркт мозга и сердечную недостаточность.
Проглатывание этанола в любой момент остановит метаболизм этиленгликоля.Поскольку этиленгликоль прогрессивно метаболизируется в течение 4-12 часов, метаболический ацидоз анионной щели развивается вторично по отношению к накоплению гликолевой кислоты. В это время пациент может чувствовать себя плохо или у него может быть угнетение ЦНС, и он может начать компенсировать это за счет гипервентиляции или гиперпноэ. Также могут возникнуть тахикардия и гипертония. Примерно через 12 часов могут появиться признаки нефротоксичности, проявляющиеся в повышении креатинина из-за осаждения кристаллов оксалата кальция в проксимальных канальцах.Такое отложение оксалата кальция может предрасполагать к гипокальциемии, подвергая пациента риску тетании, судорог, удлинения интервала QT и аритмий. Примерно через 12-18 часов может развиться олигурия. Если лечение проводится в это время, острое повреждение почек обычно обратимо, и диализ часто не требуется. Однако, если лечение откладывается в дальнейшем, обычно из-за позднего проявления или распознавания, может развиться острая почечная недостаточность и системное заболевание, включая острый респираторный дистресс-синдром, отек или инфаркт мозга и сердечную недостаточность. Считается, что дисфункция мультисистемных органов связана с отложением оксалата кальция. Если лечение не начнется достаточно рано, течение болезни может привести к коме и смерти. [12] [11] [13] [8] [9] [10]
Считается, что дисфункция мультисистемных органов связана с отложением оксалата кальция. Если лечение не начнется достаточно рано, течение болезни может привести к коме и смерти. [12] [11] [13] [8] [9] [10]
Оценка
Пациент, который принял этиленгликоль, будет иметь бессимптомное течение с увеличенным осмолярным зазором до очень тяжелого заболевания с токсичностью для органов-мишеней и метаболическим ацидозом анионного зазора. При оценке состояния пациента, находящегося в состоянии интоксикации этиленгликолем, необходимо использовать диагностический подход, основанный на исторических и объективных данных.Электрокардиограмма, основная метаболическая панель и концентрация парацетамола должны быть получены у всех токсикологических пациентов с подозрением на попытки членовредительства. Дополнительные тесты, которые следует учитывать, когда возникает проблема самоповреждения, — это общий анализ крови, трансаминазы, липазы, статус беременности, кетоны в сыворотке или моче, концентрации лактата, этанола и салицилата.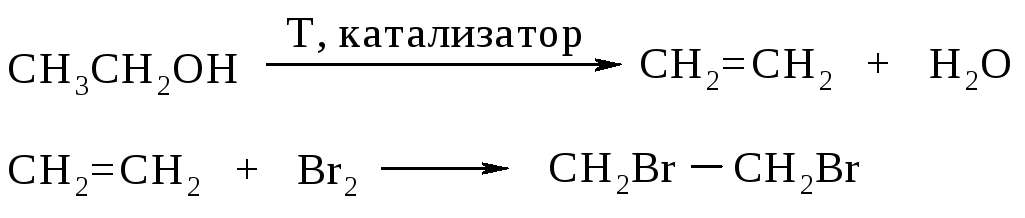 В случае токсичных спиртов очень важно исключить токсичность салицилата, особенно при обследовании пациента с метаболическим ацидозом.Концентрация этанола также необходима при обследовании пациента с токсическим употреблением алкоголя, поскольку этанол подавляет метаболизм этиленгликоля. [10]
В случае токсичных спиртов очень важно исключить токсичность салицилата, особенно при обследовании пациента с метаболическим ацидозом.Концентрация этанола также необходима при обследовании пациента с токсическим употреблением алкоголя, поскольку этанол подавляет метаболизм этиленгликоля. [10]
Концентрации токсичного алкоголя подтверждаются и измеряются с помощью газовой хроматографии, которая доступна не во всех медицинских учреждениях. Концентрация указывается в миллиграммах на децилитр (мг / дл), и, поскольку она обычно достигает пика вскоре после абсорбции, ожидается, что она будет уменьшаться по кинетике нулевого порядка, как описано выше.Время приема внутрь также важно учитывать, поскольку концентрация токсичного алкоголя может не отражать уровень токсичности, если метаболизм уже прогрессировал. Это связано с тем, что именно метаболиты в первую очередь ответственны за токсические эффекты. В случае этиленгликоля можно оценить концентрацию щавелевой кислоты, чтобы коррелировать с токсичностью для органов-мишеней, приводящей к нефропатии; однако его предшественник, гликолевая кислота, является основным фактором ацидоза.
Для определения токсичных концентраций алкоголя часто требуется отправить образец сыворотки во внешнее учреждение, на получение результатов может уйти от нескольких часов до нескольких дней, а диагностика обычно требуется раньше.Следовательно, необходимо рассмотреть методологический подход к диагностике, при котором пациент находится под наблюдением на предмет ожидаемых эффектов токсичности. Поскольку ацидоз анионной щели является более поздним обнаружением, за пациентом с нормальным кислотно-основным статусом сразу после приема пищи следует наблюдать в течение как минимум 12 часов с последовательными панелями основного метаболизма каждые 2-4 часа, чтобы контролировать развитие метаболического ацидоза и повышенная анионная щель. Этот период наблюдения может начаться только после подтверждения того, что концентрация этанола у пациента не определяется.Также важно воздерживаться от введения экзогенного бикарбоната или профилактического фомепизола в течение этого периода наблюдения. 12-часовой период наблюдения был принят в качестве стандарта лечения, но он основан на коллективном опыте, а не на конкретных данных, поскольку ацидоз может возникнуть раньше, чем через 12 часов [1].
12-часовой период наблюдения был принят в качестве стандарта лечения, но он основан на коллективном опыте, а не на конкретных данных, поскольку ацидоз может возникнуть раньше, чем через 12 часов [1].
Многие предпочитают использовать измерение осмолярного зазора для дальнейшей стратификации риска у ранних пациентов. Увеличенный осмолярный зазор неспецифичен и указывает на присутствие любого осмотически активного агента, такого как этанол.В этой настройке существует обратная зависимость между осмолярным зазором и анионным зазором. Осмолярный зазор следует увеличивать сразу после приема алкоголя и постепенно уменьшать по мере развития метаболического ацидоза анионного зазора. Эта повышенная осмоляльность обусловлена обилием осмотически активного исходного соединения, а ацидоз — производством его метаболитов. При расчете осмолярного зазора важно включить в расчет этанол, поскольку этанол также является осмотически активным.Уравнение для измерения осмолярного зазора выглядит следующим образом:
Осмолярный зазор не может использоваться для исключения присутствия токсичного алкоголя, но может быть полезен как показание для начала лечения, когда осмолярный зазор превышает 25 мОсм / кг.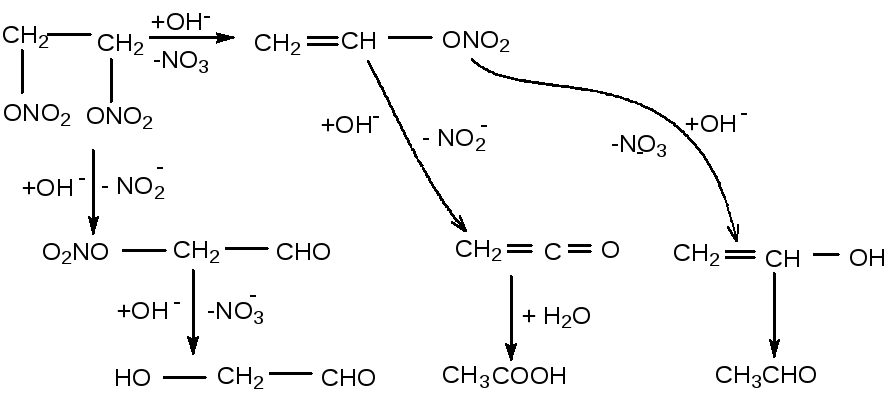 Хотя в некоторых источниках упоминается использование осмолярного зазора более 50 мОсм / кг. Используя приведенное выше уравнение, теоретически можно экстраполировать концентрацию токсичного спирта из промежутка с использованием молярной массы метанола или этиленгликоля, 32 г / моль и 62 г / моль соответственно.Следует отметить, что считается, что базовый разрыв осмоляльности находится в диапазоне от -9 до 19 мОсм / кг. Это следует учитывать при расчете осмолярного зазора, и истинный результат расчета может быть +/- 20 по сравнению с обнаруженным. Последовательные измерения осмоляльности сыворотки и расчеты осмолярного зазора не требуются и не указываются при оценке. [1]
Хотя в некоторых источниках упоминается использование осмолярного зазора более 50 мОсм / кг. Используя приведенное выше уравнение, теоретически можно экстраполировать концентрацию токсичного спирта из промежутка с использованием молярной массы метанола или этиленгликоля, 32 г / моль и 62 г / моль соответственно.Следует отметить, что считается, что базовый разрыв осмоляльности находится в диапазоне от -9 до 19 мОсм / кг. Это следует учитывать при расчете осмолярного зазора, и истинный результат расчета может быть +/- 20 по сравнению с обнаруженным. Последовательные измерения осмоляльности сыворотки и расчеты осмолярного зазора не требуются и не указываются при оценке. [1]
Когда рассматривается токсичность этиленгликоля у пациента с метаболическим ацидозом с анионной щелью, пациента следует обследовать на предмет острого повреждения почек.Кроме того, если концентрация этиленгликоля в сыворотке не может быть подтверждена, особенно важно исключить токсичность салицилата. Разрыв осмоляльности не может быть значительно увеличен, если у пациента ацидоз, поскольку исходное соединение уже метаболизируется до неизвестной степени, и, если выявляется значительно позже, осмолярный разрыв может быть нормальным.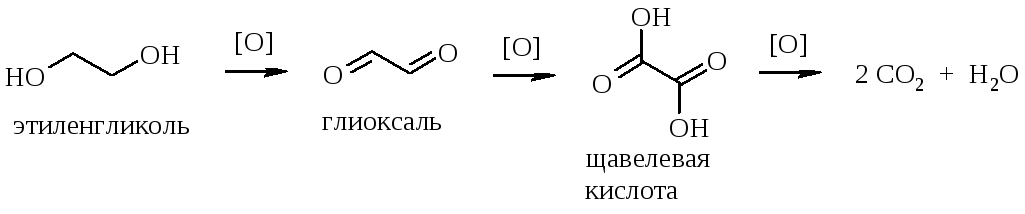 Не следует проводить 12-часовой период наблюдения, если у пациента уже имеется ацидоз; однако, если состояние стабильное, пациента следует проверить на кетоны в сыворотке или моче и ввести от 1 до 2 литров изотонических жидкостей, содержащих декстрозу, внутривенных.Если улучшение наступает, о чем свидетельствует улучшение ацидоза и уменьшение анионной щели, то прием токсичного алкоголя следует рассматривать как менее вероятный, и следует более тщательно учитывать другую этиологию. [1]
Не следует проводить 12-часовой период наблюдения, если у пациента уже имеется ацидоз; однако, если состояние стабильное, пациента следует проверить на кетоны в сыворотке или моче и ввести от 1 до 2 литров изотонических жидкостей, содержащих декстрозу, внутривенных.Если улучшение наступает, о чем свидетельствует улучшение ацидоза и уменьшение анионной щели, то прием токсичного алкоголя следует рассматривать как менее вероятный, и следует более тщательно учитывать другую этиологию. [1]
Часто также можно оценить концентрацию алкоголя в сыворотке крови. (Обратите внимание, что термин «спирт» конкретно не относится только к этанолу). Этот подход может быть полезен при стратификации риска небольших случайных проглатываний с очень ясными и точными историями. Оценка основана на дозе или количестве в миллилитрах (D), процентной концентрации выпитого алкоголя, биодоступности (BV), объеме распределения (V), выраженном в литрах на килограмм, и весе пациента (W) в килограммах.Это наиболее полезно при оценке токсичности при случайном проглатывании небольшими дозами, обычно детьми.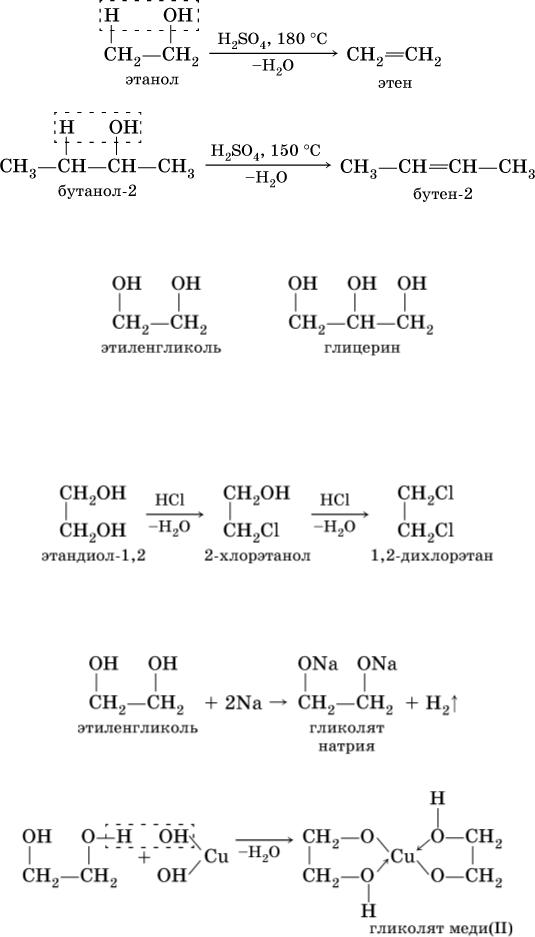 Уравнение выглядит следующим образом:
Уравнение выглядит следующим образом:
Для этого сначала определяют процентную концентрацию проглоченного агента, при этом 1% равен 1 г / 100 мл. Затем количество проглоченного определяется умножением процентной концентрации на проглоченный объем. Затем этот продукт умножается на биодоступность, которая консервативно принимается за 100%. Затем это делится на произведение объема распределения (0.7 л / кг) и вес пациента в килограммах. Результат будет в граммах на литр, которые необходимо будет преобразовать в миллиграммы на децилитр (или умножить на 100). Полученная концентрация в сыворотке предполагает, что полное проглатывание произошло мгновенно с полным всасыванием. [1] С небольшими глотками можно предположить, что глоток взрослого составляет примерно 30 мл, а глоток малыша — примерно 10 мл. [14]
Воздействие токсичного алкоголя подтверждается, когда концентрация в сыворотке крови свидетельствует о диагнозе.Его следует подозревать у пациента с развивающимся метаболическим ацидозом с повышенным анионным разрывом, которому предшествует осмолярный разрыв, который со временем уменьшается, с сопутствующими симптомами, как описано выше [1].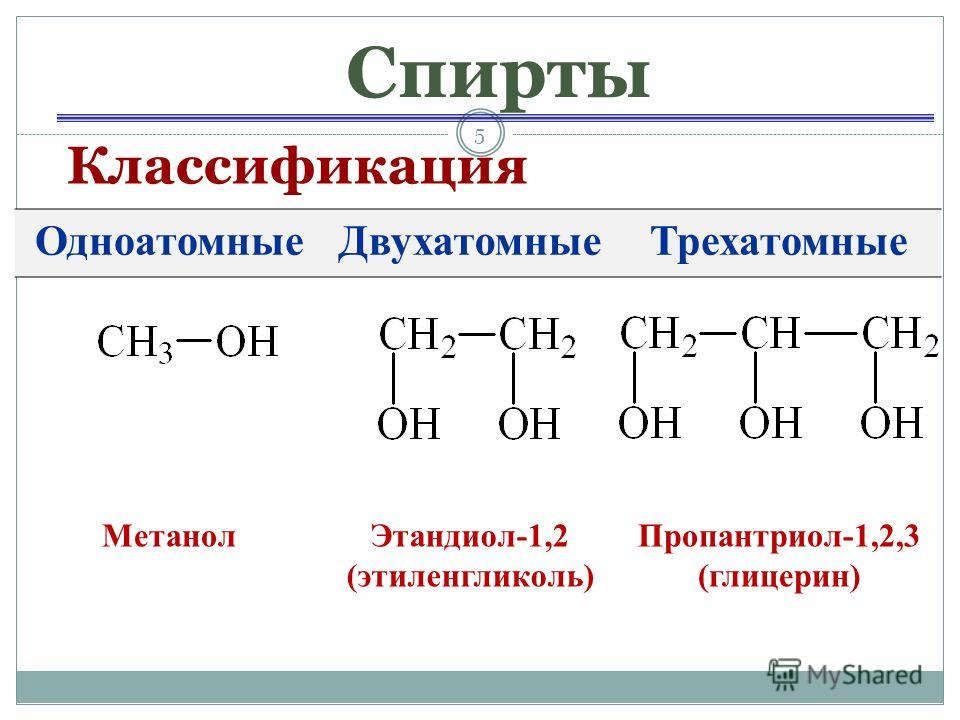 Другие результаты, которые могут присутствовать при токсичности этиленгликоля, могут включать кристаллы оксалата кальция в моче, флуоресценцию выделяемого в моче флуоресцеина натрия — случайную антифризную добавку, гипокальциемию сыворотки, вторичную по отношению к осаждению кристаллов оксалата кальция, удлинение интервала QT на электрокардиограмме в результате указанной гипокальциемии. , а также повышенный или ложно повышенный лактат в результате интерференции анализа со стороны гликолевой кислоты.Эти результаты неспецифичны и могут быть ложноположительными или отрицательными в данной ситуации.
Другие результаты, которые могут присутствовать при токсичности этиленгликоля, могут включать кристаллы оксалата кальция в моче, флуоресценцию выделяемого в моче флуоресцеина натрия — случайную антифризную добавку, гипокальциемию сыворотки, вторичную по отношению к осаждению кристаллов оксалата кальция, удлинение интервала QT на электрокардиограмме в результате указанной гипокальциемии. , а также повышенный или ложно повышенный лактат в результате интерференции анализа со стороны гликолевой кислоты.Эти результаты неспецифичны и могут быть ложноположительными или отрицательными в данной ситуации.
Лечение / управление
Варианты лечения токсичности этиленгликоля включают поддерживающую терапию, фомепизол (антизол, 4-метилпиразол или 4MP), этанол, диализ и, теоретически, тиамин, пиридоксин и магний. Фомепизол является противоядием от токсичных спиртов и действует путем ингибирования алкогольдегидрогеназы, прекращая токсический метаболизм алкоголя. Этанол также можно использовать терапевтически для ингибирования алкогольдегидрогеназы, когда фомепизол недоступен.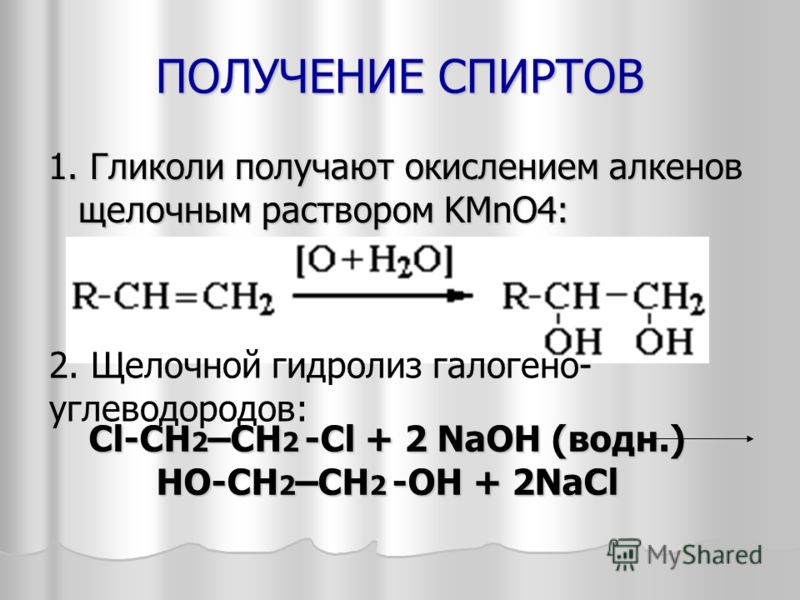 У любого лечения есть свои преимущества и недостатки. Фомепизол легче дозировать, не вызывает опьянения и сильнее ингибирует алкогольдегидрогеназу, но стоит довольно дорого. Этанол дешевле, но его сложнее точно дозировать, он требует тщательного мониторинга концентрации этанола в сыворотке и вызывает опьянение, которое может потребовать наблюдения в интенсивной терапии. [1] [15]
У любого лечения есть свои преимущества и недостатки. Фомепизол легче дозировать, не вызывает опьянения и сильнее ингибирует алкогольдегидрогеназу, но стоит довольно дорого. Этанол дешевле, но его сложнее точно дозировать, он требует тщательного мониторинга концентрации этанола в сыворотке и вызывает опьянение, которое может потребовать наблюдения в интенсивной терапии. [1] [15]
Показания к антидотному лечению включают повышенную концентрацию этиленгликоля и тяжелый или прогрессирующий ацидоз, несмотря на реанимацию, с клиническим подозрением на воздействие.Рекомендации относительно определенных пороговых значений концентрации этиленгликоля различаются, при этом самые консервативные рекомендации относятся к лечению, если она превышает 20–25 мг / дл. Однако, если метаболический ацидоз мягкий или отсутствует, и нет доказательств токсичности для органов-мишеней, особенно почек, тогда концентрация этиленгликоля 62 мг / дл является подходящей отправной точкой для лечения, поскольку молярные расчеты показывают, что это коррелирует с максимум 10 ммоль / л токсичного метаболита. Эта концентрация метаболитов сама по себе не должна вызывать дефицит оснований более 10 ммоль / л или связанный с ним токсический эффект.(Примечание: пороговое значение обработки на основе молярности для метанола составляет 32 мг / дл; см. Главу о токсичности метанола). Когда концентрация этиленгликоля недоступна, лечение следует начинать, когда уровень бикарбоната становится ниже 15 ммоль / л или если есть доказательства почечной токсичности. Через 12 часов после введения фомепизола метаболизм этиленгликоля останавливается. Это дает достаточно времени, чтобы получить концентрацию этиленгликоля и при необходимости организовать диализ. [16] [1]
Эта концентрация метаболитов сама по себе не должна вызывать дефицит оснований более 10 ммоль / л или связанный с ним токсический эффект.(Примечание: пороговое значение обработки на основе молярности для метанола составляет 32 мг / дл; см. Главу о токсичности метанола). Когда концентрация этиленгликоля недоступна, лечение следует начинать, когда уровень бикарбоната становится ниже 15 ммоль / л или если есть доказательства почечной токсичности. Через 12 часов после введения фомепизола метаболизм этиленгликоля останавливается. Это дает достаточно времени, чтобы получить концентрацию этиленгликоля и при необходимости организовать диализ. [16] [1]
Фомепизол и этанол ингибируют алкогольдегидрогеназу, чтобы остановить превращение этиленгликоля (и других спиртов) в его токсичные метаболиты.Когда алкогольдегидрогеназа ингибируется, клиренс этиленгликоля увеличивается с периода полувыведения 4-6 часов до эффективного периода полувыведения примерно 17 часов. Фомепизол вводят внутривенно с нагрузочной дозой 15 мг / кг с последующим поддерживающим введением 10 мг / кг каждые 12 часов в течение четырех доз, или до тех пор, пока концентрация этиленгликоля не станет по крайней мере менее 62 мг / дл при нормальном кислотно-щелочном балансе.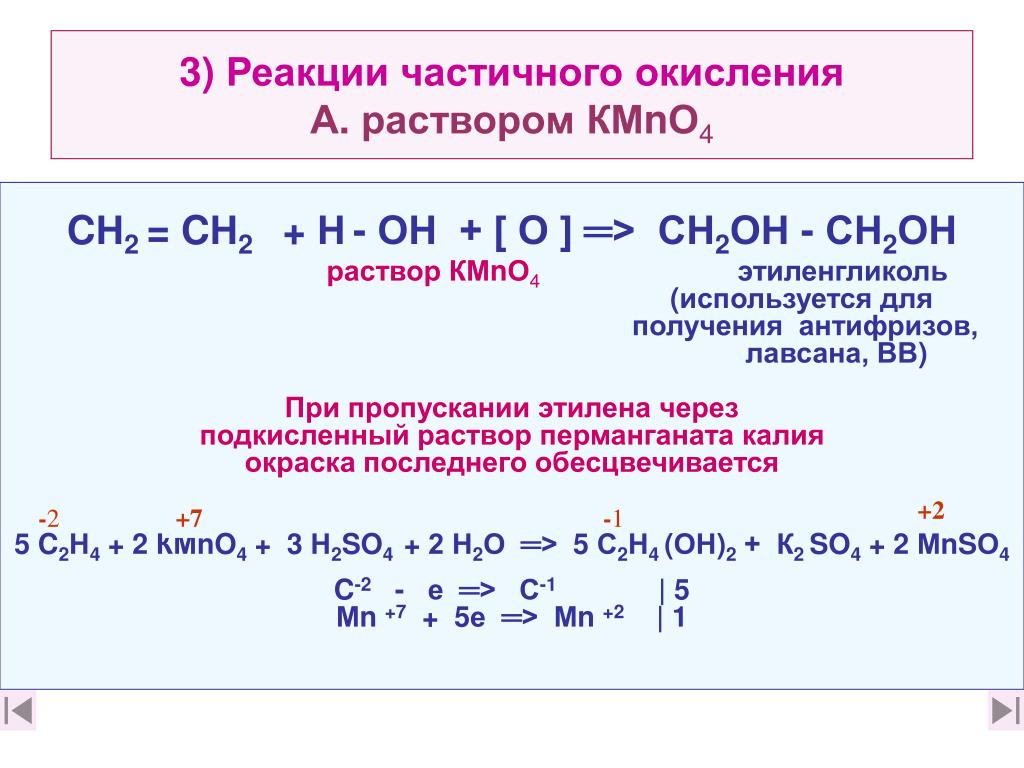 статус; однако существуют более консервативные рекомендации — ниже 25 мг / дл. Совершать четыре приема не обязательно.Если требуется дополнительное дозирование сверх четырех поддерживающих доз, то дозу следует увеличивать до 15 мг / кг каждые 12 часов из-за аутоиндукции собственного метаболизма фомепизолом. Во время диализа фомепизол следует вводить каждые 4 часа, так как он удаляется во время диализа. Для стандартного 4-часового сеанса диализа фомепизол следует вводить как до, так и после сеанса, с возобновлением 12-часового приема после этого. [1] [16] [17] [7] [18]
статус; однако существуют более консервативные рекомендации — ниже 25 мг / дл. Совершать четыре приема не обязательно.Если требуется дополнительное дозирование сверх четырех поддерживающих доз, то дозу следует увеличивать до 15 мг / кг каждые 12 часов из-за аутоиндукции собственного метаболизма фомепизолом. Во время диализа фомепизол следует вводить каждые 4 часа, так как он удаляется во время диализа. Для стандартного 4-часового сеанса диализа фомепизол следует вводить как до, так и после сеанса, с возобновлением 12-часового приема после этого. [1] [16] [17] [7] [18]
Использовать этанол в качестве противоядия сложнее, чем лечение фомепизолом.Трудно титровать, контролировать и опьяняет. Этанол можно вводить внутривенно или перорально, но его использование должно быть ограничено, поскольку фомепизол недоступен. Хотя он считается менее дорогим, чем фомепизол, во время пребывания в больнице он часто имеет более высокую общую стоимость. Во время лечения целевая концентрация этанола в сыворотке составляет от 80 до 120 мг / дл. Формуляр для внутривенного введения этанола обычно составляет 10%, а нагрузочная доза рассчитывается с использованием произведения целевой концентрации в плазме (C = 100 мг / дл) на объем распределения этанола (V = 0.6 л / кг) и вес пациента. В таком случае поддерживающая дозировка основывается на скорости выведения. Эмпирически можно вводить 10% этанол внутривенно с нагрузочной дозой 8 мл / кг в течение 30-60 минут с последующим поддерживающим дозированием 1-2 мл / кг в час. Во время диализа поддерживающая дозировка удваивается. Пероральное дозирование может быть рассчитано с использованием приведенного выше уравнения для концентраций спирта в сыворотке, используя 100 мг / дл для концентрации в сыворотке и затем решая процентное количество проглоченного этанола. Эмпирически 50% (100%) пероральный этанол можно вводить с нагрузочной дозой 2 мл / кг, за которой следует 0.2-0,4 мл / кг в час. Во время диализа поддерживающая дозировка удваивается. [1] [11] [19]
Формуляр для внутривенного введения этанола обычно составляет 10%, а нагрузочная доза рассчитывается с использованием произведения целевой концентрации в плазме (C = 100 мг / дл) на объем распределения этанола (V = 0.6 л / кг) и вес пациента. В таком случае поддерживающая дозировка основывается на скорости выведения. Эмпирически можно вводить 10% этанол внутривенно с нагрузочной дозой 8 мл / кг в течение 30-60 минут с последующим поддерживающим дозированием 1-2 мл / кг в час. Во время диализа поддерживающая дозировка удваивается. Пероральное дозирование может быть рассчитано с использованием приведенного выше уравнения для концентраций спирта в сыворотке, используя 100 мг / дл для концентрации в сыворотке и затем решая процентное количество проглоченного этанола. Эмпирически 50% (100%) пероральный этанол можно вводить с нагрузочной дозой 2 мл / кг, за которой следует 0.2-0,4 мл / кг в час. Во время диализа поддерживающая дозировка удваивается. [1] [11] [19]
Этиленгликоль и его метаболиты поддаются диализу; однако при правильном применении фомепизола диализ обычно не показан при отсутствии почечной дисфункции.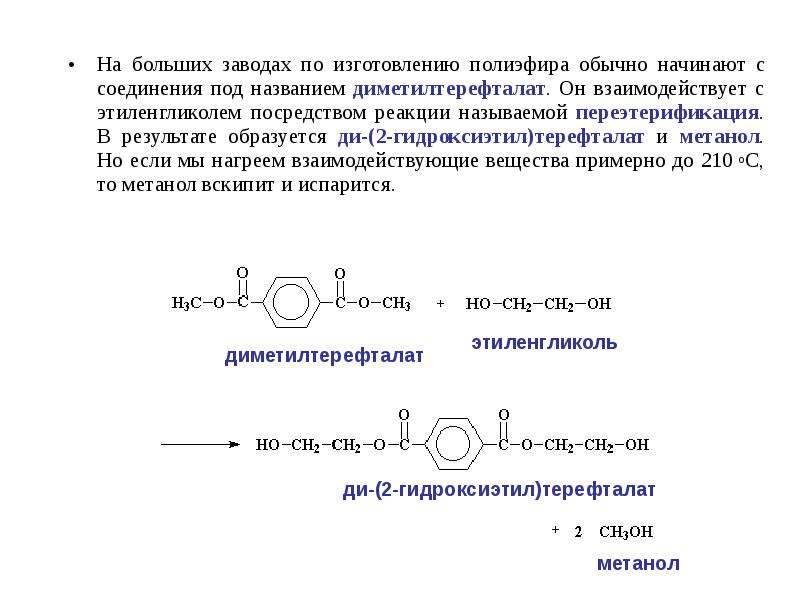 Кроме того, диализ может неоправданно увеличить риск и стоимость для пациента. В отличие от метанола или диэтиленгликоля, только фомепизол рекомендуется для лечения токсического воздействия этиленгликоля без почечной дисфункции и только с минимальными кислотно-щелочными нарушениями, поскольку гораздо менее вероятно, что какая-либо токсичность связана с неметаболизированным этиленгликолем.Эффективный период полураспада этиленгликоля увеличивается примерно до 17 часов только при ингибировании алкогольдегидрогеназы; следовательно, диализ не обязательно сокращает продолжительность пребывания в больнице. Кроме того, его использование часто требует нахождения в отделении интенсивной терапии во многих больницах, что увеличивает расходы. При нарушении функции почек, тяжелом метаболическом ацидозе и тяжелых электролитных нарушениях следует настоятельно рекомендовать гемодиализ. Для лечения одним фомепизолом необходимо обеспечить нормальный диурез, чтобы этиленгликоль мог надежно выводиться из организма.
Кроме того, диализ может неоправданно увеличить риск и стоимость для пациента. В отличие от метанола или диэтиленгликоля, только фомепизол рекомендуется для лечения токсического воздействия этиленгликоля без почечной дисфункции и только с минимальными кислотно-щелочными нарушениями, поскольку гораздо менее вероятно, что какая-либо токсичность связана с неметаболизированным этиленгликолем.Эффективный период полураспада этиленгликоля увеличивается примерно до 17 часов только при ингибировании алкогольдегидрогеназы; следовательно, диализ не обязательно сокращает продолжительность пребывания в больнице. Кроме того, его использование часто требует нахождения в отделении интенсивной терапии во многих больницах, что увеличивает расходы. При нарушении функции почек, тяжелом метаболическом ацидозе и тяжелых электролитных нарушениях следует настоятельно рекомендовать гемодиализ. Для лечения одним фомепизолом необходимо обеспечить нормальный диурез, чтобы этиленгликоль мог надежно выводиться из организма. Наличие тяжелого ацидоза указывает на активный и, вероятно, неполный метаболизм этиленгликоля, с опасением, что циркулирующая гликолевая кислота может быть преобразована в оксалат, что увеличивает риск ухудшения функции почек. Продолжительное замещение почек, хотя и менее эффективное, может рассматриваться, если прерывистый гемодиализ невозможен, особенно в условиях нестабильности гемодинамики. Решение об использовании гемодиализа является сложным и должно приниматься после консультации с врачом-токсикологом.[20] [21] [17] [22] [23]
Наличие тяжелого ацидоза указывает на активный и, вероятно, неполный метаболизм этиленгликоля, с опасением, что циркулирующая гликолевая кислота может быть преобразована в оксалат, что увеличивает риск ухудшения функции почек. Продолжительное замещение почек, хотя и менее эффективное, может рассматриваться, если прерывистый гемодиализ невозможен, особенно в условиях нестабильности гемодинамики. Решение об использовании гемодиализа является сложным и должно приниматься после консультации с врачом-токсикологом.[20] [21] [17] [22] [23]
Также могут быть рассмотрены дополнительные варианты лечения. Инфузия бикарбоната натрия может быть полезной, особенно при тяжелом метаболическом ацидозе, но не всегда считается стандартной рекомендацией. Глюконат кальция может быть показан при возникновении осложнений в результате гипокальциемии, но в противном случае его следует заменять осторожно и разумно, поскольку введение экзогенного кальция может усилить осаждение кристаллов оксалата кальция. Приступы на фоне гипокальциемии следует лечить бензодиазепинами.Теоретически, введение тиамина, пиридоксина и магния может помочь шунтировать метаболизм гликолевой кислоты от щавелевой кислоты к ее нетоксичным метаболитам, α-гидрокси-β-кетоадипиновой кислоте и глицину, соответственно, используя механизм, обсуждаемый в разделе патофизиологии.
Приступы на фоне гипокальциемии следует лечить бензодиазепинами.Теоретически, введение тиамина, пиридоксина и магния может помочь шунтировать метаболизм гликолевой кислоты от щавелевой кислоты к ее нетоксичным метаболитам, α-гидрокси-β-кетоадипиновой кислоте и глицину, соответственно, используя механизм, обсуждаемый в разделе патофизиологии.
Следует рассмотреть возможность госпитализации в отделение интенсивной терапии при наличии тяжелой симптоматики, в том числе обтурации, серьезных метаболических или электролитных нарушений. Следует также рассмотреть вопрос о приеме в реанимацию в зависимости от сложности лечения, включая использование диализа и, что более важно, требуется ли лечение этанолом.
Дифференциальный диагноз
Дифференциальный диагноз употребления токсичного алкоголя включает любую причину метаболического ацидоза. Важными токсикологическими соображениями при метаболическом ацидозе являются салицилаты, ацетаминофен, железо, оксид углерода, цианид, алкогольный кетоацидоз и прием внутрь других спиртов, таких как метанол, диэтиленгликоль или толуол.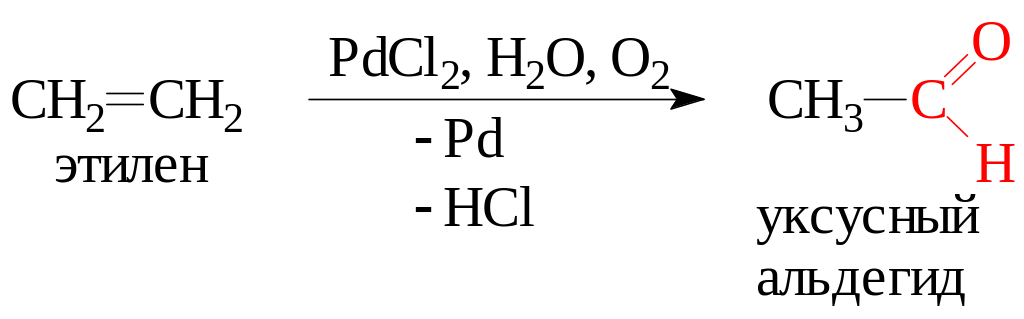 Также следует учитывать проглатывание агентов, содержащих более одного алкоголя или токсичных веществ. Нетоксикологические соображения должны включать алкогольный кетоацидоз, диабетический кетоацидоз, сепсис и уремию.[1]
Также следует учитывать проглатывание агентов, содержащих более одного алкоголя или токсичных веществ. Нетоксикологические соображения должны включать алкогольный кетоацидоз, диабетический кетоацидоз, сепсис и уремию.[1]
Управление токсичностью и побочными эффектами
Основой лечения является поддерживающая терапия и лечение фомепизолом. Фомепизол исключительно безопасен и не вызывает серьезных побочных эффектов. [24] Когда этанол используется в качестве противоядия, с ним может быть трудно справиться, требуя интенсивной терапии для тщательного титрования и интоксикации со связанными с ней осложнениями, такими как энцефалопатия и угнетение дыхания. [25] Диализ несет в себе риски и преимущества, включая снижение артериального давления, кровотечение из-за установки катетера и инфекцию.
Прогноз
Пациенты часто выздоравливают, когда своевременная диагностика и лечение проходят. Когда пациенты обращаются поздно или диагноз не распознается своевременно, может произойти значительная заболеваемость и смертность.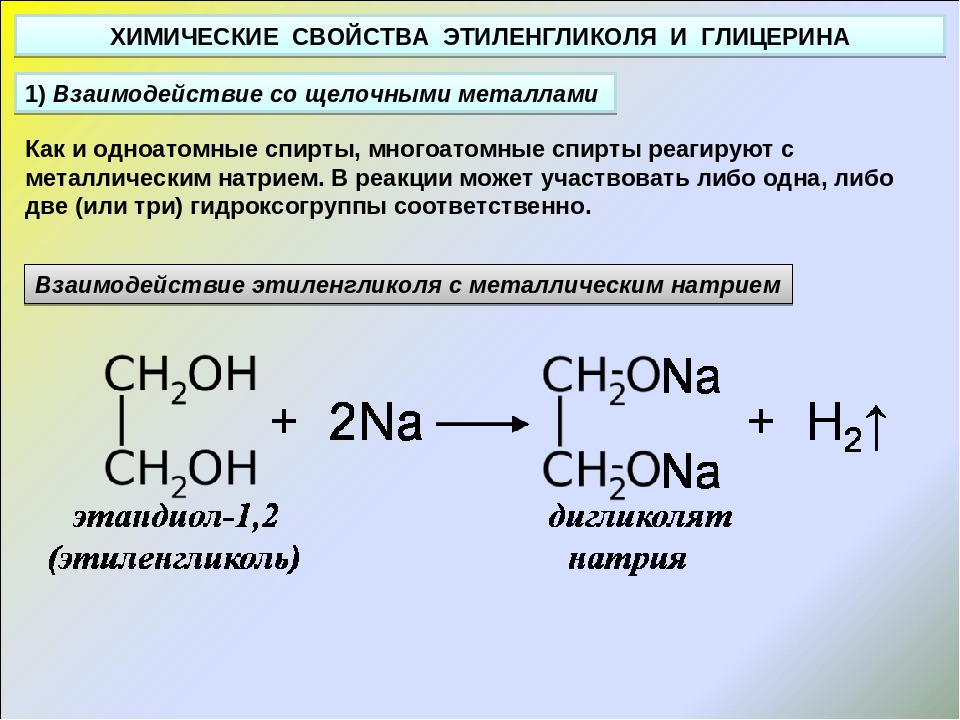 [1] [10]
[1] [10]
Осложнения
Когда пациенты переживают отравление этиленгликолем, обычно наблюдается выздоровление от любой ассоциированной нефропатии; хотя после выписки может потребоваться дополнительное нефрологическое лечение и диализ.
Консультации
Все пациенты с токсичностью этиленгликоля должны лечиться после консультации с токсикологом или местным токсикологическим центром.
Если токсиколог определил, что гемодиализ показан, то показана консультация нефролога.
Если этанол используется в качестве противоядия, рекомендуется лечение интенсивной терапии.
Сдерживание и обучение пациентов
Важно хранить все антифризы и родственные вещества в емкостях с этикетками и в недоступном для детей месте.
Жемчуг и другие проблемы
Осмолярный и анионный промежутки абсолютно не могут исключить токсическое отравление алкоголем.
Этиленгликоль претерпевает несколько метаболических стадий, при этом метаболиты гликолевой кислоты и щавелевой кислоты в первую очередь ответственны за ацидоз и повреждение почек соответственно.

Токсичность для органов-мишеней в первую очередь включает нефропатию, вызванную отложением кристаллов оксалата кальция.
Этиленгликоль осмотически активен, в то время как его метаболиты ответственны за связанный с ним метаболический ацидоз анионной щели.
Нормальный осмолярный зазор не обнадеживает и его следует ожидать при наличии ацидоза анионного зазора, который, как считается, связан с отравлением токсичным алкоголем.
Основа лечения — фомепизол, поддерживающая терапия и реанимация. Однако может быть показан диализ.
В отсутствие токсичности для органов-мишеней токсичность этиленгликоля обычно не требует диализа.
Когда пациенты выживают и у них возникает почечная дисфункция или недостаточность, восстановление функции почек является нормой, но может занять от нескольких недель до месяцев.
Улучшение результатов команды здравоохранения
Невозможно переоценить важность управления при консультации с медицинским токсикологом или экспертом токсикологического центра.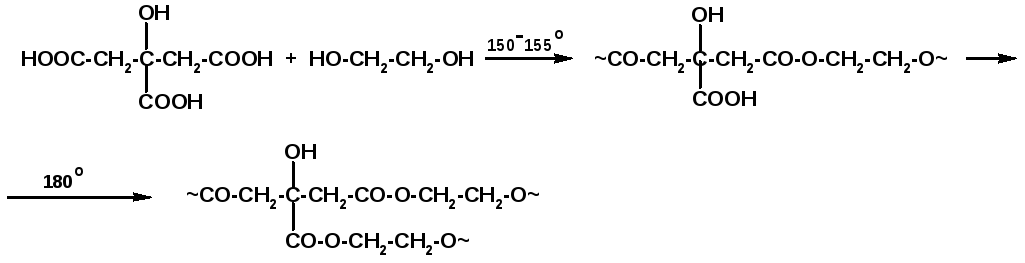
Ссылки
- 1.
- Ashurst JV, Nappe TM. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 26 июня 2021 г. Токсичность метанола. [PubMed: 29489213]
- 2.
- Драйвер Дж., Тардифф Р.Г., Седик Л., Вестер Р.К., Майбах Х.И. Чрескожная абсорбция [14C] этиленгликоля in vitro. J Expo Anal Environ Epidemiol. 1993 июль-сентябрь; 3 (3): 277-84. [PubMed: 8260837] ,
- , 3. ,
- , Уайт, NC, Литовиц, Т., Бенсон, Б.Е., Горовиц, Б.З., Марр-Лайон, Л., Уайт, МК.Влияние горьких веществ на потребление антифриза детьми. Клиника Педиатр (Phila). 2009 ноябрь; 48 (9): 913-21. [PubMed: 19571333]
- 4.
- Gummin DD, Mowry JB, Spyker DA, Brooks DE, Fraser MO, Banner W. Годовой отчет Национальной системы данных по ядам (NPDS) Американской ассоциации центров по контролю за отравлениями за 2016 год: 34-е место Годовой отчет. Clin Toxicol (Phila). 2017 декабрь; 55 (10): 1072-1252. [PubMed: 29185815]
- 5.
- Якобсен Д.
 , Хьюлетт Т.П., Уэбб Р., Браун С.Т., Ординарио А.Т., Макмартин К.Э.Отравление этиленгликолем: оценка кинетики и кристаллурии. Am J Med. 1988 Янв; 84 (1): 145-52. [PubMed: 3337119]
, Хьюлетт Т.П., Уэбб Р., Браун С.Т., Ординарио А.Т., Макмартин К.Э.Отравление этиленгликолем: оценка кинетики и кристаллурии. Am J Med. 1988 Янв; 84 (1): 145-52. [PubMed: 3337119] - 6.
- Moreau CL, Kerns W., Tomaszewski CA, McMartin KE, Rose SR, Ford MD, Brent J. Кинетика гликолата и клиренс гемодиализа при отравлении этиленгликолем. Исследовательская группа МЕТА. J Toxicol Clin Toxicol. 1998; 36 (7): 659-66. [PubMed: 9865233]
- 7.
- Сивилотти М.Л., Бернс М.Дж., Макмартин К.Е., Брент Дж. Токсикокинетика этиленгликоля во время терапии фомепизолом: значение для лечения.Для группы по изучению метилпиразола для токсичных спиртов. Ann Emerg Med. 2000 августа; 36 (2): 114-25. [PubMed: 10918102]
- 8.
- Ng PCY, Long BJ, Davis WT, Sessions DJ, Koyfman A. Диагностика и лечение токсического алкоголя: обзор неотложной медицины. Intern Emerg Med. 2018 Апрель; 13 (3): 375-383. [PubMed: 29427181]
- 9.
- Kraut JA, Mullins ME. Токсичные спирты.
 N Engl J Med. 18 января 2018; 378 (3): 270-280. [PubMed: 29342392]
N Engl J Med. 18 января 2018; 378 (3): 270-280. [PubMed: 29342392] - 10.
- Beauchamp GA, Valento M.Прием токсического алкоголя: быстрое распознавание и лечение в отделении неотложной помощи. Emerg Med Pract. 2016 сен; 18 (9): 1-20. [PubMed: 27538060]
- 11.
- Jacobsen D, McMartin KE. Отравления метанолом и этиленгликолем. Механизм отравления, клиника, диагностика и лечение. Med Toxicol. 1986 сентябрь-октябрь; 1 (5): 309-34. [PubMed: 3537623]
- 12.
- Якобсен Д., Остби Н., Бредесен Дж. Э. Исследования по отравлению этиленгликолем. Acta Med Scand. 1982; 212 (1-2): 11-5.[PubMed: 7124456]
- 13.
- Ховда К.Е., Хундери О.Н., Рудберг Н., Фройшов С., Якобсен Д. Анионные и осмолярные разрывы в диагностике отравления метанолом: клиническое исследование с участием 28 пациентов. Intensive Care Med. 2004 сентябрь; 30 (9): 1842-6. [PubMed: 15241587]
- 14.
- Ратнапалан С., Потылицина Ю., Тан Л. Х., Ройфман М., Корен Г.
 Измерение глотка малыша: токсикологические соображения. J Pediatr. 2003 июн; 142 (6): 729-30. [PubMed: 12838206]
Измерение глотка малыша: токсикологические соображения. J Pediatr. 2003 июн; 142 (6): 729-30. [PubMed: 12838206] - 15.
- Брент Дж.Фомепизол при отравлении этиленгликолем и метанолом. N Engl J Med. 2009 21 мая; 360 (21): 2216-23. [PubMed: 19458366]
- 16.
- МакМартин К., Якобсен Д., Ховда К.Э. Антидоты при отравлении спиртами, образующими токсичные метаболиты. Br J Clin Pharmacol. 2016 Март; 81 (3): 505-15. [Бесплатная статья PMC: PMC4767193] [PubMed: 26551875]
- 17.
- Брент Дж., Макмартин К., Филлипс С., Беркхарт К.К., Донован Дж. В., Уэллс М., Кулиг К. Фомепизол для лечения отравления этиленгликолем.Метилпиразол для группы исследования токсичных спиртов. N Engl J Med. 18 марта 1999 г .; 340 (11): 832-8. [PubMed: 10080845]
- 18.
- Jacobsen D, Ostensen J, Bredesen L, Ullstein E, McMartin K. 4-Метилпиразол (4-MP) эффективно удаляется гемодиализом на модели свиньи. Hum Exp Toxicol. 1996 июн; 15 (6): 494-6. [PubMed: 8793532]
- 19.

- Peterson CD. Дозы этанола для приема внутрь у пациентов с отравлением метанолом. Am J Hosp Pharm. 1981 июл; 38 (7): 1024-7. [PubMed: 7258202]
- 20.
- Jacobsen D, Ovrebø S, Ostborg J, Sejersted OM. Гликолят вызывает ацидоз при отравлении этиленгликолем и эффективно удаляется гемодиализом. Acta Med Scand. 1984; 216 (4): 409-16. [PubMed: 6516909]
- 21.
- Брент Дж. Текущее лечение отравления этиленгликолем. Наркотики. 2001; 61 (7): 979-88. [PubMed: 11434452]
- 22.
- Borron SW, Mégarbane B, Baud FJ. Фомепизол в лечении неосложненного отравления этиленгликолем. Ланцет. 1999, 4 сентября; 354 (9181): 831.[PubMed: 10485727]
- 23.
- Buchanan JA, Alhelail M, Cetaruk EW, Schaeffer TH, Palmer RB, Kulig K, Brent J. Обильное проглатывание этиленгликоля, обработанное одним фомепизолом, — жизнеспособный терапевтический вариант. J Med Toxicol. 2010 июн; 6 (2): 131-4. [Бесплатная статья PMC: PMC3550287] [PubMed: 20422336]
- 24.

- Hovda KE, Julsrud J, Øvrebø S, Brørs O, Jacobsen D. Исследования отравления этиленгликолем: один пациент — 154 госпитализации. Clin Toxicol (Phila). 2011 Июль; 49 (6): 478-84.[PubMed: 21824058]
- 25.
- Клин М.К., Натараджан С., Йохансон С., Патель Р., Канджи С. Безопасность инфузий этанола для лечения интоксикации метанолом или этиленгликолем: обсервационное исследование. CJEM. 2012 сентябрь; 14 (5): 283-9. [PubMed: 22967695]
Необычная причина изменения психического статуса и уроки, извлеченные из ведения болезни в острых условиях
Этиленгликоль содержится во многих бытовых товарах и является распространенным токсичным продуктом при приеме внутрь.Присутствуют острые глотания с измененными сенсориями и осмолярным зазором. Истинная токсичность этиленгликоля опосредуется его метаболитами, которые ответственны за метаболический ацидоз с увеличенной анионной щелью, повреждение почечных канальцев и кристаллурию, наблюдаемую позже при приеме внутрь.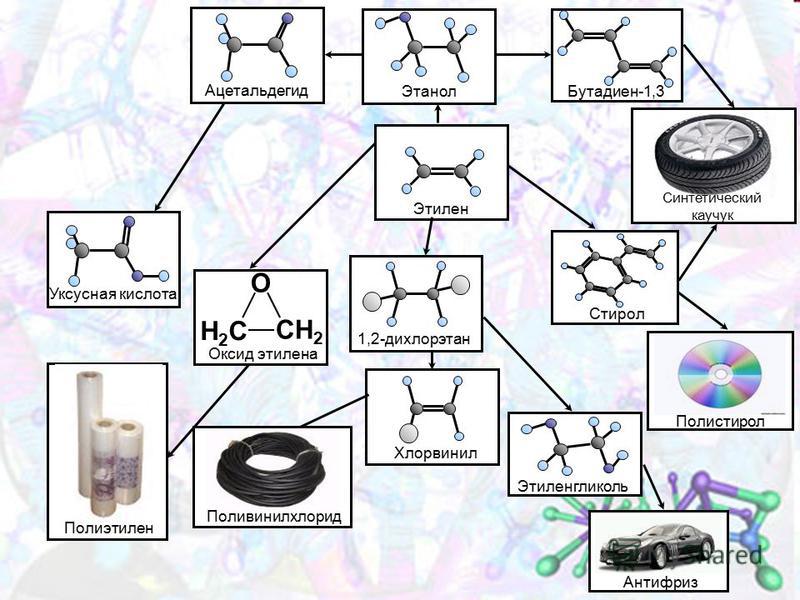 Ключевым моментом является раннее вмешательство; однако постановка диагноза часто откладывается, особенно у пожилых пациентов с измененным психическим статусом. Существует несколько лабораторных тестов, которые можно использовать для диагностики, количественной оценки приема внутрь и мониторинга лечения, включая определение лактатного и осмоляльного разрыва.Поскольку методы прямого измерения этиленгликоля часто недоступны, важно иметь высокую степень подозрения на основании этих косвенных лабораторных данных. Основой лечения является бикарбонат, фомепизол или этанол и, часто, гемодиализ. Подтвержденное уравнение можно использовать для оценки необходимой продолжительности гемодиализа, и даже если прямые измерения этиленгликоля недоступны, мониторинг закрытия анионных, лактатных и осмоляльных промежутков может помочь в лечении.Мы представляем случай пожилого мужчины с измененным психическим статусом, острым повреждением почек, метаболическим ацидозом с повышенным анионным разрывом и глубоким лактатным и осмолярным разрывом.
Ключевым моментом является раннее вмешательство; однако постановка диагноза часто откладывается, особенно у пожилых пациентов с измененным психическим статусом. Существует несколько лабораторных тестов, которые можно использовать для диагностики, количественной оценки приема внутрь и мониторинга лечения, включая определение лактатного и осмоляльного разрыва.Поскольку методы прямого измерения этиленгликоля часто недоступны, важно иметь высокую степень подозрения на основании этих косвенных лабораторных данных. Основой лечения является бикарбонат, фомепизол или этанол и, часто, гемодиализ. Подтвержденное уравнение можно использовать для оценки необходимой продолжительности гемодиализа, и даже если прямые измерения этиленгликоля недоступны, мониторинг закрытия анионных, лактатных и осмоляльных промежутков может помочь в лечении.Мы представляем случай пожилого мужчины с измененным психическим статусом, острым повреждением почек, метаболическим ацидозом с повышенным анионным разрывом и глубоким лактатным и осмолярным разрывом.
1. Введение
Этиленгликоль — это спирт, который содержится во многих бытовых продуктах, таких как антифризы, средства для борьбы с обледенением и жидкости для стеклоочистителей [1]. Без запаха, цвета и сладкого вкуса, он чаще всего употребляется в пищу детьми, животными и теми, кто ищет заменитель этанола, но также сообщалось о случаях убийства [2] и самоубийства.При пероральном приеме 786 мг / кг для человека, что составляет около 50 миллилитров или 1,7 унции этиленгликоля для 70-килограммового пациента, даже небольшой прием внутрь может оказаться летальным [3]. Токсичность этиленгликоля опосредуется его метаболитами, в основном гликолевой кислотой и оксалатом [4]. Эти метаболиты ответственны за патогенез симптомов, с которыми обращаются пациенты, которые классически относятся к глубокому ацидозу (изменение сенсориума и дыхания Куссмауля) и кристаллурии (туберкулезная гипокальциемия, олигурия, гематурия и боль в боку) [5].
Диагноз ставится на основании известного или предполагаемого проглатывания в соответствующих клинических условиях, при этом ключевую роль играет лабораторная оценка.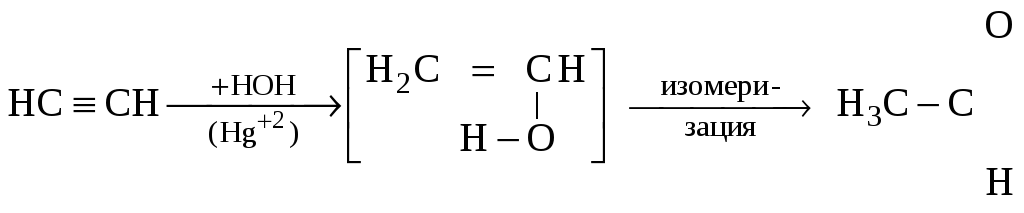 Хотя существуют тесты для определения этиленгликоля в сыворотке крови, они могут быть труднодоступными и имеют свои ограничения. Таким образом, для постановки диагноза клиницисты часто полагаются на клинические проявления и результаты анализов крови, такие как тяжелый и необъяснимый метаболический ацидоз анионной щели с осмолярной щелью.
Хотя существуют тесты для определения этиленгликоля в сыворотке крови, они могут быть труднодоступными и имеют свои ограничения. Таким образом, для постановки диагноза клиницисты часто полагаются на клинические проявления и результаты анализов крови, такие как тяжелый и необъяснимый метаболический ацидоз анионной щели с осмолярной щелью.
Профилактика последствий интоксикации этиленгликолем зависит от раннего выявления и вмешательства с целью минимизировать производство его токсичных метаболитов [6].Раннее терапевтическое вмешательство важно, поскольку большая часть этиленгликоля всасывается через желудочно-кишечный тракт в течение одного часа после приема внутрь. Основой лечения является бикарбонат натрия для лечения острого ацидоза, фомепизол или этанол для блокирования превращения этиленгликоля в его метаболиты и гемодиализ, если уровень этиленгликоля превышает 50 мг / дл. Следует отметить, что первоначальное лечение бикарбонатом натрия, хотя и необходимо для коррекции тяжелого ацидоза, может повышать pH мочи и увеличивать вероятность выпадения кристаллов оксалата кальция в осадок, способствуя повреждению почек и гипокальциемии.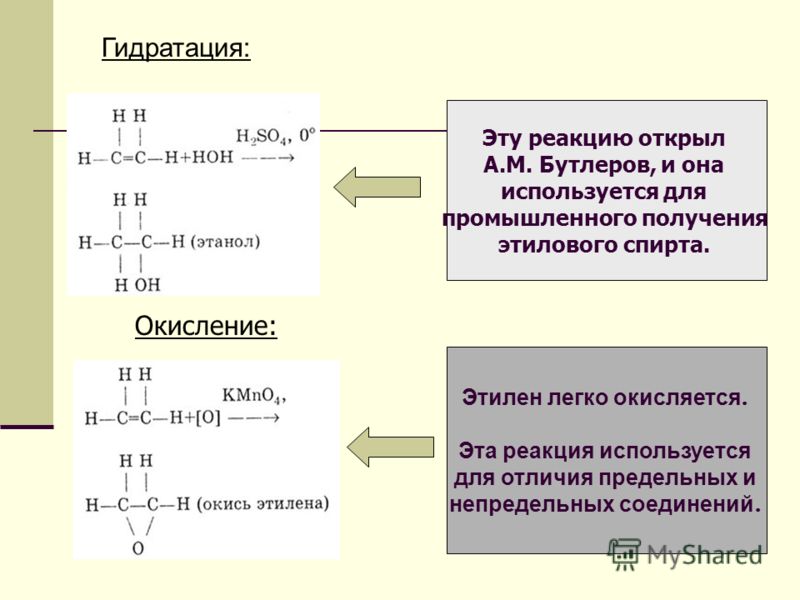 Это еще раз подчеркивает важность раннего выявления и эффективного вмешательства. Поскольку пациенты часто находятся в критическом состоянии, им часто требуется наблюдение в отделении интенсивной терапии для выявления вторичных осложнений в виде измененного психического статуса и сердечных аритмий. Здесь мы представляем случай случайного проглатывания этиленгликоля пожилым мужчиной, который потребовал вышеупомянутых терапевтических вмешательств.
Это еще раз подчеркивает важность раннего выявления и эффективного вмешательства. Поскольку пациенты часто находятся в критическом состоянии, им часто требуется наблюдение в отделении интенсивной терапии для выявления вторичных осложнений в виде измененного психического статуса и сердечных аритмий. Здесь мы представляем случай случайного проглатывания этиленгликоля пожилым мужчиной, который потребовал вышеупомянутых терапевтических вмешательств.
2. Описание клинического случая
78-летний мужчина с историей болезни, связанной с гипертонией, деменцией и предшествующей преходящей ишемической атакой, был доставлен в больницу своей дочерью по поводу измененных сенсорных ощущений и нарушения походки.Исходно пациент мог передвигаться без посторонней помощи. Последний раз его хорошо знали около 23:00 за день до его экстренного визита. По словам дочери, около 11:00 в день госпитализации у пациента были отмечены трудности с стоянием и сидением в вертикальном положении без посторонней помощи.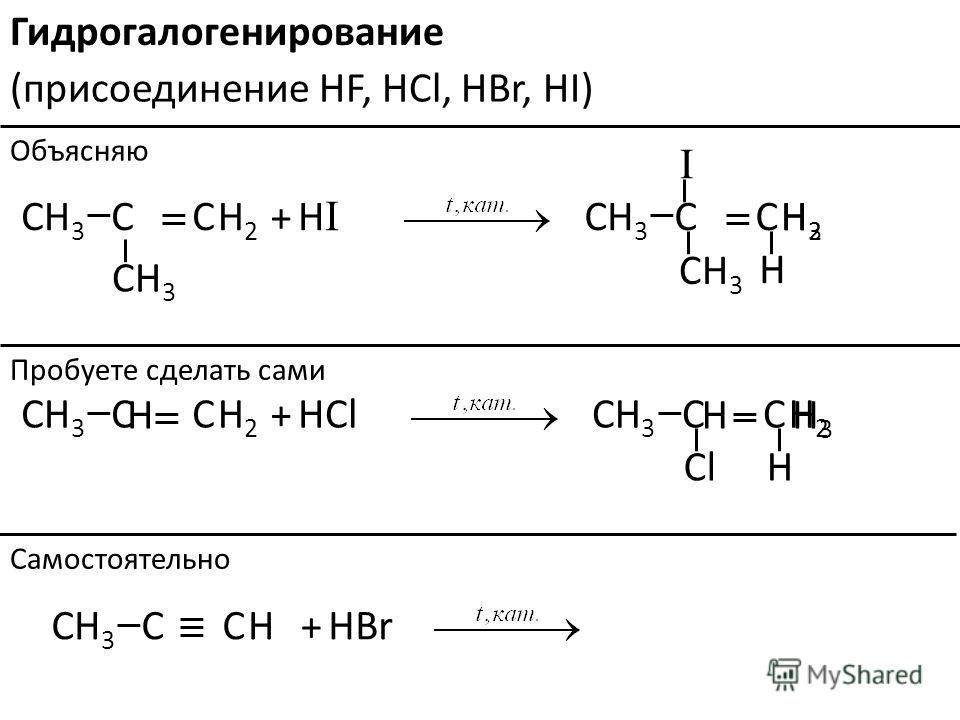 Его речь была искаженной и почти неразборчивой. Ранее он сообщил дочери, что «почувствовал себя пьяным» и не мог сосредоточиться на ее лице. Впоследствии, через пять часов, около 16:00, дочь доставила пациента в отделение неотложной помощи.
Его речь была искаженной и почти неразборчивой. Ранее он сообщил дочери, что «почувствовал себя пьяным» и не мог сосредоточиться на ее лице. Впоследствии, через пять часов, около 16:00, дочь доставила пациента в отделение неотложной помощи.
На момент осмотра пациент имел афебрильную, нормотензивную, тахикардию и тахипноэ. Пульсоксиметрия показала насыщение гемоглобина на 98% в комнатном воздухе. Результаты физикального обследования были нормальными, за исключением летаргии, дезориентации и реакции на глубокую боль движением всех конечностей. Его профиль крови показал острое повреждение почек с креатинином 1,24 мг / дл по сравнению с исходным значением 1,0 мг / дл (что эквивалентно падению скорости клубочковой фильтрации с 95 до 68 мл / мин / 1,73 м 2 ) и метаболический ацидоз повышенной анионной щели с pH 7.090, PaCO 2 10,0 мм рт.ст., бикарбонат сыворотки 8 ммоль / л и анионная щель 29 ммоль / л. Молочная кислота составляла 1,6 мМоль / л в венозном образце, отправленном в лабораторию; однако газы артериальной крови в месте оказания медицинской помощи выявили 27,0 ммоль / л молочной кислоты (Таблица 1).
Изначально уровень молочной кислоты в венах был отнесен на счет лабораторной ошибки, учитывая неизменно очень низкий уровень pH при повторных исследованиях газов артериальной крови. Несмотря на несколько болюсов жидкости и введение бикарбоната натрия, ацидоз и уровни лактата не улучшились.Дальнейшее исследование выявило осмолярный зазор 53 мОсм / кг, неопределяемый уровень метанола и уровень этиленгликоля в сыворотке 54 мг / дл. В это время повторяющиеся уровни молочной кислоты были отправлены как из венозной крови, так и из газа артериальной крови и продемонстрировали такое же значительное расхождение (1,3 против 22 мМоль / л, соответственно). Первоначально функция почек была стабильной, пациент выделял почти 2 литра мочи за 24 часа; однако в течение 48 часов у пациента появилась олигурия и ухудшилась функция почек. Скорректированный уровень кальция в сыворотке снизился с 9.7–7,9 мг / дл, что было связано с осаждением кристаллов оксалата кальция, поскольку исследование осадка мочи теперь выявило типичные кристаллы оксалата кальция в форме конверта (рис. 3. Обсуждение Когда пациенты обращаются в отделение неотложной помощи с измененным психическим статусом, дифференциальный диагноз обычно бывает широким.Хотя интоксикация всегда рассматривается, прием этиленгликоля часто остается в поле зрения лечащего врача, особенно у пациентов в возрасте семи лет. Однако интоксикация этиленгликолем не редкость. В своем годовом отчете Американская ассоциация центров по борьбе с отравлениями сообщила в общей сложности о 6600 случаях отравления этиленгликолем только в течение 2013 года, и это число постоянно растет с годами. В 2014 году это число выросло до 6809 случаев. В отчете этиленгликоль был третьим по распространенности химическим веществом, ответственным за смерть в результате нефармацевтических отравлений, после этанола и окиси углерода [7]. 3.1. Всасывание и токсичность Этиленгликоль быстро всасывается в желудочно-кишечном тракте в течение первого часа после приема внутрь. О случаях отравления после воздействия на кожу или дыхательные пути не сообщалось [9]. Проглатывание самого этиленгликоля приводит к опьянению и угнетению центральной нервной системы, мало чем отличающемуся от того, что наблюдается при отравлении этанолом. Циркуляция гликолевой кислоты в крови приводит к метаболическому ацидозу с повышенным анионным промежутком, что приводит к дыханию Куссмауля и глубокому притуплению сознания [4]. Прямое повреждение почечных канальцев традиционно связывали с гликолевой кислотой, но есть доказательства того, что гликолевый альдегид и глиоксилат могут быть основными метаболитами этиленгликоля, ответственными за этот механизм нефротоксичности и последующей острой почечной недостаточности, олигурии и гематурии (рис. 2). 3.2. Измерение этиленгликоля К сожалению, даже если врач подозревает отравление этиленгликолем, определенные методы определения этиленгликоля в сыворотке имеют ограничения, которые могут значительно задержать диагностику и лечение в ситуации, когда время имеет существенное значение. Углубленная оценка результатов и расхождений в стандартных лабораторных исследованиях играет ключевую роль в повышении клинических подозрений и диагностике интоксикации этиленгликолем.Глубокий метаболический ацидоз с высоким уровнем анионной щели, наблюдаемый при интоксикации этиленгликолем и / или метанолом, наблюдается при немногих других состояниях, и в большинстве из этих состояний в большинстве случаев также наблюдается сильно повышенный уровень молочной кислоты, такой как ишемия кишечника или эпилептический статус. Интоксикация этиленгликолем может привести к небольшому повышению уровня молочной кислоты, но этого обычно недостаточно для объяснения степени ацидоза [11, 14]. 3.3. Lactate Gap Один феномен, имеющий большое клиническое значение и полезный, — это разрыв молочной кислоты.В нескольких исследованиях было отмечено, что измерения молочной кислоты могут быть сильно, но ошибочно повышены при интоксикации этиленгликолем в зависимости от типа используемого анализатора. 3.4. Osmolal Gap Прием алкоголя часто также сопровождается повышенными осмоляльными промежутками в сыворотке крови. Хотя осмолярные промежутки до 15 мОсм могут быть нормальными на основании метода расчета [17], значительно повышенные и необъяснимые осмоляльные промежутки плазмы, превышающие 20-25 мОсм в правильном клиническом сценарии, должны вызывать подозрения относительно недавнего употребления алкоголя, такого как этанол, метанол, этиленгликоль или изопропиловый спирт. Поскольку вклад спирта в осмолярный зазор является прямой функцией молярной массы этого спирта, если известны осмолярный зазор и тип спирта, можно определить количество этого спирта в сыворотке.Например, осмолярный зазор 10 мОсм равен 62 мг / дл этиленгликоля. У нашего пациента был осмолярный зазор 51 мОсм, что предполагает начальный уровень этиленгликоля около 316 мг / дл. 3.5. Кристаллы мочиНаконец, еще одним свидетельством в пользу приема внутрь этиленгликоля является появление кристаллов оксалата кальция в моче и одновременное развитие гипокальциемии, предположительно из-за осаждения оксалата кальция.Однако обнаружение кристаллурии может отсутствовать изначально и принимать различные формы. Классические дигидратные кристаллы в форме оболочки присутствуют только при высоких концентрациях оксалата кальция, при этом игольчатые кристаллы моногидрата встречаются чаще, и их легко спутать с гиппуратом [11]. Следовательно, это поздняя и неспецифическая находка. 4. Ведение Управление проглатыванием этиленгликоля включает, прежде всего, обеспечение безопасности дыхательных путей, дыхания и кровообращения пациента. 4.1. Роль гемодиализа Как указывалось выше, у пациентов с тяжелым отравлением гемодиализ может спасти жизнь.По общему мнению, гемодиализ следует начинать, если уровень этиленгликоля превышает 50 мг / дл. Нормальная скорость клубочковой фильтрации не является препятствием для начала гемодиализа. Внутривенную жидкость следует заменить физиологическим раствором, чтобы избежать чрезмерной нагрузки бикарбонатом и снизить риск осаждения кристаллов оксалата кальция за счет повышения pH мочи. Уровень кальция будет поддерживаться в течение всего сеанса гемодиализа, поскольку концентрация кальция в диализате находится на физиологическом уровне.Если пациент получает фомепизол, крайне важно увеличить частоту дозирования с каждых 12 часов до четырех часов, поскольку фомепизол обладает значительной способностью к диализу. Гемодиализ следует продолжать до тех пор, пока уровень этиленгликоля не станет стабильно <20 мг / дл с успешным разрешением метаболического ацидоза [5]. 4.2. Предикторы восстановления почек Специальных исследований, посвященных предикторам восстановления почек после отравления этиленгликолем, не так много. 5. Заключение Диагностика токсичности этиленгликоля у пожилых и слабоумных пациентов является очень сложной задачей. Эта группа пациентов может иметь метаболический ацидоз и спутанность сознания из-за многих этиологий и подвержена риску быстрой декомпенсации. Следовательно, следование хорошо разработанным алгоритмам при оценке пациентов с метаболическим ацидозом остается наиболее эффективным инструментом для предотвращения пропуска любых будущих случаев приема этиленгликоля. Конкурирующие интересыАвторы заявляют, что у них нет конкурирующих интересов. Токсичность этиленгликоля: основы практики, патофизиология, этиологияАвтор Дэниел К. Киз, доктор медицины, магистр здравоохранения Заместитель председателя, по академическим вопросам, отделение неотложной медицины, больница Святого Джозефа Мерси; Клинический факультет, резидентура по неотложной медицине, медицинская школа Мичиганского университета; Клинический адъюнкт-профессор кафедры хирургии отделения неотложной медицины и токсикологии Юго-западной медицинской школы Техасского университета Дэниел Киз, доктор медицины, магистр здравоохранения, является членом следующих медицинских обществ: Американской ассоциации центров по борьбе с отравлениями, Американского колледжа Врачи неотложной помощи, Американский колледж медицинской токсикологии, Американский колледж руководителей врачей, Американский колледж врачей Раскрытие информации: раскрывать нечего. Соавтор (ы) Джон Т. Хирш, DO Врач-ординатор, отделение неотложной медицины, больница Сент-Мэри Мерси Джон Т. Хирш, DO является членом следующих медицинских обществ: Американский колледж врачей скорой помощи, Ассоциация резидентов скорой медицинской помощи Раскрытие информации : Нечего раскрывать. Али Хайдус Руководитель клинических исследований, Партнерская программа исследований в области неотложной медицины, Госпиталь Святой Марии Раскрытие информации: Ничего не нужно раскрывать. Специальная редакционная коллегия John T. VanDeVoort, PharmD Региональный директор по фармацевтике, больницам Sacred Heart и St Joseph John T. VanDeVoort, PharmD является членом следующих медицинских обществ: Американское общество фармацевтов систем здравоохранения Раскрытие информации: раскрывать нечего. Джон Дж. Бенитес, доктор медицины, магистр здравоохранения Доцент кафедры медицины, медицинской токсикологии, Медицинский центр Университета Вандербильта; Управляющий директор, Центр токсикологии Теннесси Джон Дж. Бенитес, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Американской академии клинической токсикологии, Американской академии неотложной медицины, Американского колледжа медицинской токсикологии, Американского колледжа профилактической медицины, подводного и Гипербарическое медицинское общество, Медицинское общество дикой природы, Американский колледж профессиональной и экологической медицины Раскрытие: Ничего не нужно раскрывать. Главный редактор Сейдж Винер, доктор медицины Доцент кафедры неотложной медицины, Медицинский центр Нижнего штата Нью-Йорка; Директор медицинской токсикологии, отделение неотложной медицины, Госпитальный центр округа Кингс Сейдж Винер, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии клинической токсикологии, Американской академии неотложной медицины, Американского колледжа медицинской токсикологии, Общества Академическая неотложная медицина Раскрытие информации: нечего раскрывать. Дополнительные участники Miguel C Fernandez, MD, FAAEM, FACEP, FACMT, FACCT Доцент кафедры хирургии / неотложной медицины и токсикологии Медицинской школы Техасского университета в Сан-Антонио; Медицинский и управляющий директор, Центр токсикологии Южного Техаса Мигель С. Фернандес, доктор медицины, FAAEM, FACEP, FACMT, FACCT является членом следующих медицинских обществ: Американской академии экстренной медицины, Американского колледжа врачей скорой помощи, Американского колледжа медицинской токсикологии , Общество академической неотложной медицины, Техасская медицинская ассоциация, Американский колледж профессиональной и экологической медицины Раскрытие: Ничего не раскрывать. Благодарности Абид А. Кагалвалла, MD Врач-резидент, Отделение неотложной медицины, Госпиталь Св. Джозефа Мерси, Система здравоохранения Мичиганского университета webmd.com»> Абид А. Кагалвалла, доктор медицины, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи, Американской медицинской ассоциации, Ассоциации резидентов неотложной медицинской помощи и Общества академической неотложной медициныРаскрытие: Ничего не нужно раскрывать. Оксид этилена — Информационные бюллетениЧто такое оксид этилена?Оксид этилена — легковоспламеняющийся газ, легко растворяющийся в воде. Это искусственное химическое вещество, используемое в основном для производства этиленгликоля (химического вещества, используемого для производства антифриза и полиэстера). Он также используется для стерилизации медицинского оборудования и принадлежностей. Как я могу подвергнуться воздействию оксида этилена?Воздействие оксида этилена может происходить при вдыхании или контакте с кожей. Какие пределы воздействия оксида этилена на человека установлены? Австралийские органы здравоохранения установили максимальную концентрацию окиси этилена в воздухе (в среднем за 40 часов в неделю) для рабочего места в размере 1800 микрограммов на кубический метр воздуха (1 грамм = 1 000 000 микрограммов). Что известно о типичных фоновых уровнях воздуха?В Австралии и за рубежом очень мало информации о типичных уровнях фонового воздуха. Известно, что в городском воздухе обычно очень мало оксида этилена, а более высокие уровни обнаруживаются в непосредственной близости от промышленных предприятий, таких как стерилизационные установки. Как оксид этилена может повлиять на мое здоровье? Вдыхание относительно высоких уровней этиленоксида может вызвать раздражение глаз, кожи и дыхательных путей и повлиять на нервную систему (например, головные боли, тошнота, рвота, потеря памяти, онемение) у людей.Длительное воздействие оксида этилена на высоких уровнях, встречающееся на некоторых рабочих местах, также было связано с небольшим или умеренным увеличением заболеваемости некоторыми видами рака. Кроме того, исследования на животных показывают, что длительное воздействие может вызвать рак. Есть также некоторые свидетельства того, что риск выкидыша повышается среди рабочих, работающих с высоким содержанием оксида этилена. Насколько вероятно, что оксид этилена может вызвать рак?Сообщалось о случаях лейкемии и других видов рака у рабочих, подвергшихся воздействию высоких уровней оксида этилена.Хотя нет убедительных доказательств того, что это химическое вещество вызывает рак, Всемирная организация здравоохранения классифицировала оксид этилена как вызывающий рак агент (канцероген), а Управление по охране окружающей среды США считает оксид этилена веществом, которое, вероятно, вызывает рак. В целом, NSW Health считает, что оксид этилена следует рассматривать как канцероген. Регулируется ли оксид этилена?Согласно экологическим законам штата Новый Южный Уэльс, выброс окиси этилена на заводе Unomedical в Мона-Вейл регулируется Советом Питтуотера. Узнайте, подвергались ли вы воздействию оксида этилена. Существует два вида тестов, которые могут определить, подвергался ли человек воздействию оксида этилена. Один тест измеряет оксид этилена в крови, а другой тест измеряет его в вашем дыхании. Обнаружение этиленгликоля (C2H6O2), газовый информационный бюллетеньЭтиленгликоль Формула: C 2 H 6 O 2 | CAS: 107-21-1Обнаружение этиленгликоля: Этиленгликоль не имеет запаха, поэтому запах не предупреждает об опасной концентрации.Пары этиленгликоля легче воздуха. Обнаружение этиленгликоля на транспорте Этиленгликоль — ключевой ингредиент автомобильных антифризов и охлаждающих жидкостей, помогающий предохранить двигатель от перегрева и замерзания зимой. Этиленгликоль является основным компонентом средств защиты от обледенения, используемых в различных транспортных средствах, включая автомобили, лодки и самолеты, а также на взлетно-посадочных полосах аэропортов в холодные зимние месяцы.
Опасность для здоровья при воздействии этиленгликоля на разных уровнях Раннее обнаружение этиленгликоля для уменьшения множественных последствий для здоровья Этиленгликоль вызывает лишь легкое раздражение слизистых оболочек или кожи и медленно и плохо всасывается через кожу. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||

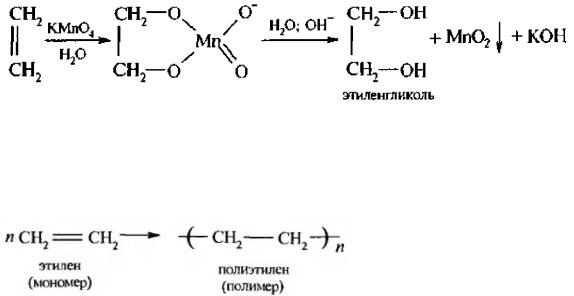
 8 °C
8 °C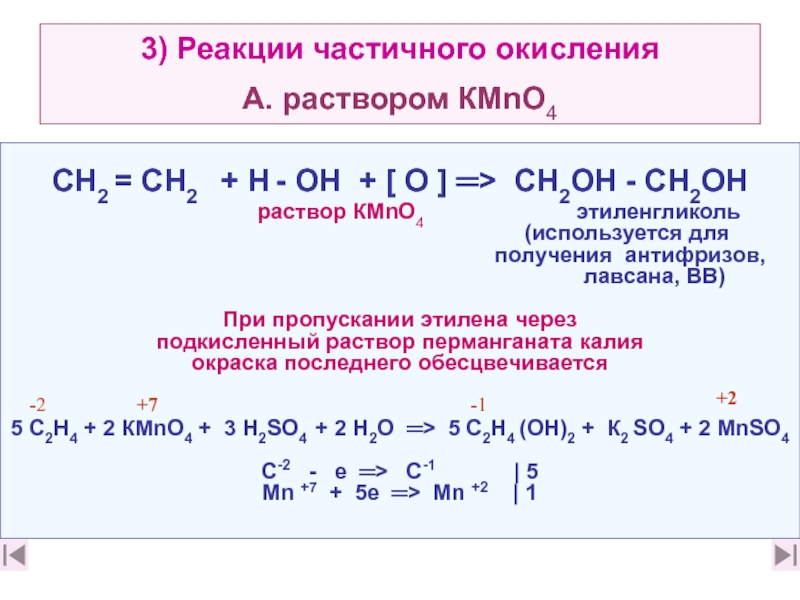
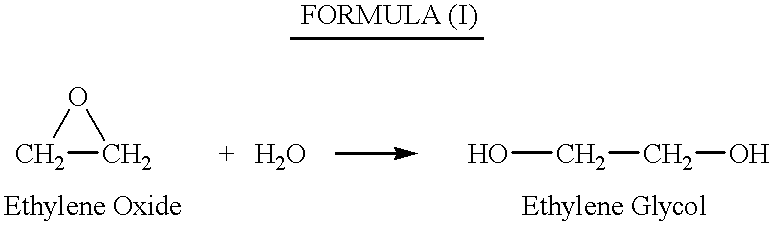
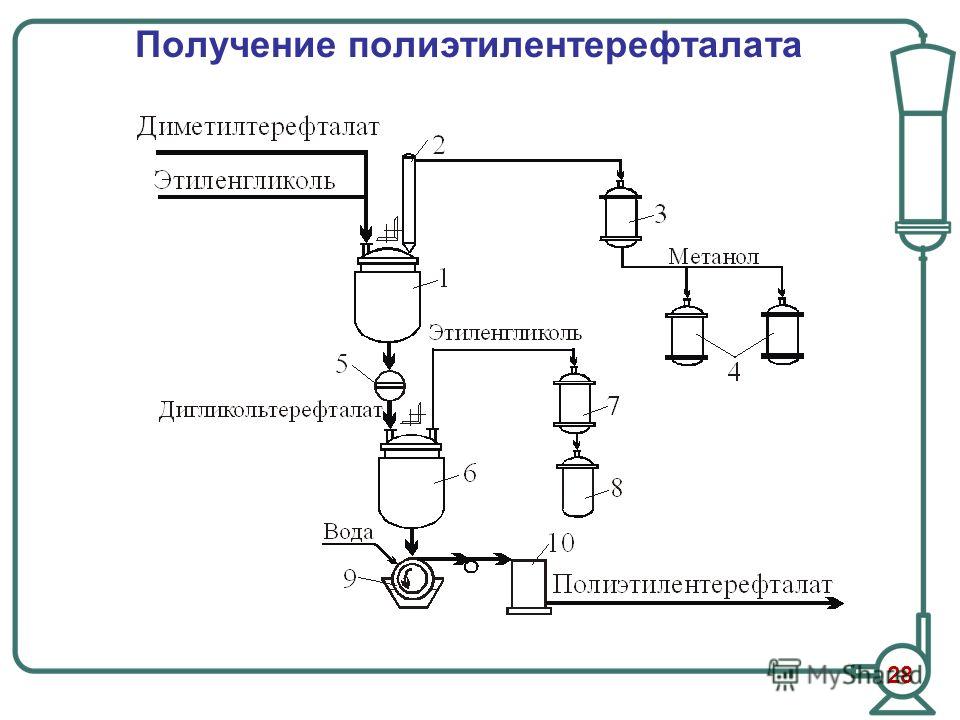
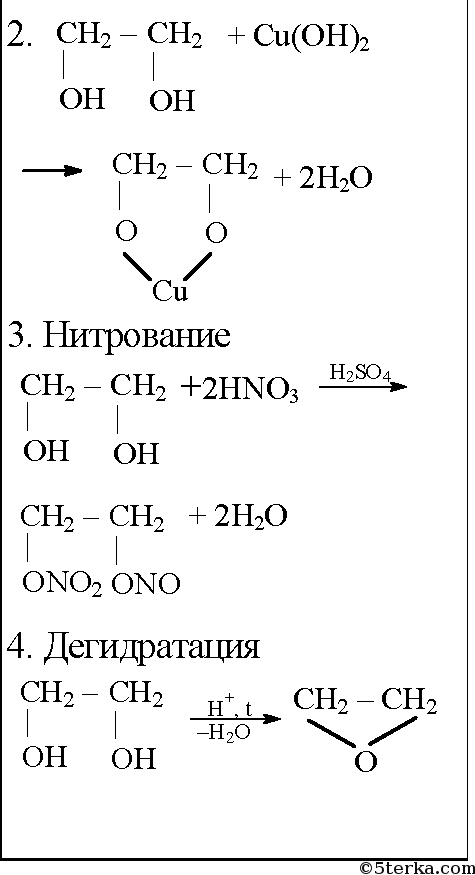
 , Хьюлетт Т.П., Уэбб Р., Браун С.Т., Ординарио А.Т., Макмартин К.Э.Отравление этиленгликолем: оценка кинетики и кристаллурии. Am J Med. 1988 Янв; 84 (1): 145-52. [PubMed: 3337119]
, Хьюлетт Т.П., Уэбб Р., Браун С.Т., Ординарио А.Т., Макмартин К.Э.Отравление этиленгликолем: оценка кинетики и кристаллурии. Am J Med. 1988 Янв; 84 (1): 145-52. [PubMed: 3337119] N Engl J Med. 18 января 2018; 378 (3): 270-280. [PubMed: 29342392]
N Engl J Med. 18 января 2018; 378 (3): 270-280. [PubMed: 29342392] Измерение глотка малыша: токсикологические соображения. J Pediatr. 2003 июн; 142 (6): 729-30. [PubMed: 12838206]
Измерение глотка малыша: токсикологические соображения. J Pediatr. 2003 июн; 142 (6): 729-30. [PubMed: 12838206]

 Было проведено тщательное расследование причин этого предполагаемого тяжелого лактоацидоза, но четкой этиологии выявлено не было.Признаков сепсиса или постиктальных симптомов не было, компьютерная томография головы отрицательна для инсульта, а глюкоза и бета-гидроксибутират были в пределах нормы. Кроме того, не было никаких признаков гангренозной ткани, а хирургические и рентгенологические исследования были отрицательными на ишемию кишечника или грыжу ущемления. Кроме того, пациент был гемодинамически стабильным с нормальными ферментами печени, что делало системную гипоперфузию или снижение клиренса молочной кислоты весьма маловероятным.
Было проведено тщательное расследование причин этого предполагаемого тяжелого лактоацидоза, но четкой этиологии выявлено не было.Признаков сепсиса или постиктальных симптомов не было, компьютерная томография головы отрицательна для инсульта, а глюкоза и бета-гидроксибутират были в пределах нормы. Кроме того, не было никаких признаков гангренозной ткани, а хирургические и рентгенологические исследования были отрицательными на ишемию кишечника или грыжу ущемления. Кроме того, пациент был гемодинамически стабильным с нормальными ферментами печени, что делало системную гипоперфузию или снижение клиренса молочной кислоты весьма маловероятным. Впоследствии пациент был помещен в отделение интенсивной терапии и продолжил внутривенное введение бикарбоната натрия для коррекции основного ацидоза и фомепизола для блокирования превращения этиленгликоля под действием алкогольдегидрогеназы в токсичные метаболиты и начато на экстренном гемодиализе.Также назначали тиамин и пиридоксин, чтобы облегчить преобразование гликолата в менее токсичные метаболиты. Были привлечены серийные лаборатории для мониторинга ацидоза и уровней этиленгликоля. Когда pH нормализовался и уровень этиленгликоля оставался <20 мг / дл, гемодиализ и фомепизол были прекращены.
Впоследствии пациент был помещен в отделение интенсивной терапии и продолжил внутривенное введение бикарбоната натрия для коррекции основного ацидоза и фомепизола для блокирования превращения этиленгликоля под действием алкогольдегидрогеназы в токсичные метаболиты и начато на экстренном гемодиализе.Также назначали тиамин и пиридоксин, чтобы облегчить преобразование гликолата в менее токсичные метаболиты. Были привлечены серийные лаборатории для мониторинга ацидоза и уровней этиленгликоля. Когда pH нормализовался и уровень этиленгликоля оставался <20 мг / дл, гемодиализ и фомепизол были прекращены.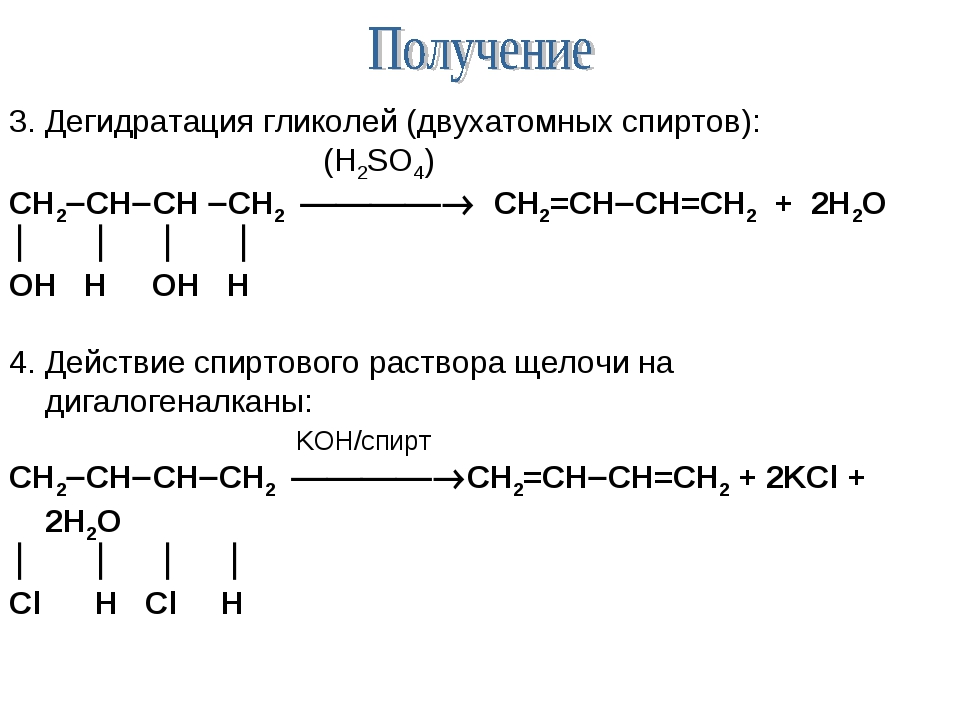 1). Хотя психическое состояние пациента улучшилось по сравнению с исходным уровнем, почечная функция продолжала ухудшаться, и он стал зависимым от диализа. Он был выписан на длительный периодический гемодиализ с неопределенным потенциалом восстановления почек.
1). Хотя психическое состояние пациента улучшилось по сравнению с исходным уровнем, почечная функция продолжала ухудшаться, и он стал зависимым от диализа. Он был выписан на длительный периодический гемодиализ с неопределенным потенциалом восстановления почек. Однако следует отметить, что сообщение об этих случаях токсикологической службе зависит исключительно от усмотрения и инициативы лечащего врача, и, следовательно, истинное число случаев, вероятно, недооценивается. В Великобритании Национальная информационная служба по ядам сообщила в общей сложности о 91 случае отравления этиленгликолем, который занимает четвертое место по распространенности после ацетаминофена, наркотиков, злоупотребляющих наркотиками, и злоупотребления психоактивными веществами. В следующем году это число выросло только до 92 [8]. Это число значительно меньше, чем в США, но авторы не будут строить предположений о причине, и не было никаких ссылок, изучающих различия.
Однако следует отметить, что сообщение об этих случаях токсикологической службе зависит исключительно от усмотрения и инициативы лечащего врача, и, следовательно, истинное число случаев, вероятно, недооценивается. В Великобритании Национальная информационная служба по ядам сообщила в общей сложности о 91 случае отравления этиленгликолем, который занимает четвертое место по распространенности после ацетаминофена, наркотиков, злоупотребляющих наркотиками, и злоупотребления психоактивными веществами. В следующем году это число выросло только до 92 [8]. Это число значительно меньше, чем в США, но авторы не будут строить предположений о причине, и не было никаких ссылок, изучающих различия. Токсичность этиленгликоля опосредуется его метаболитами (рис. 2) [4]. Этиленгликоль, как и другие спирты, метаболизируется в печени.При окислении в печени через алкогольдегидрогеназу и альдегиддегидрогеназу образуется гликолевый альдегид, а затем гликолевая кислота соответственно. Дальнейший метаболизм приводит к глиоксилату, который может быть преобразован в менее токсичные метаболиты, если тиамин и пиридоксин доступны, и конечный конечный продукт, щавелевая кислота.
Токсичность этиленгликоля опосредуется его метаболитами (рис. 2) [4]. Этиленгликоль, как и другие спирты, метаболизируется в печени.При окислении в печени через алкогольдегидрогеназу и альдегиддегидрогеназу образуется гликолевый альдегид, а затем гликолевая кислота соответственно. Дальнейший метаболизм приводит к глиоксилату, который может быть преобразован в менее токсичные метаболиты, если тиамин и пиридоксин доступны, и конечный конечный продукт, щавелевая кислота. Было обнаружено, что это конкретное повреждение не зависит от образования кристаллов оксалата кальция [10]. Поскольку оксалат соединяется с кальцием с образованием оксалата кальция, возникающая гипокальциемия может привести к параличу нервов и тетании. Также могут развиваться судороги и аритмии. Оксалат кальция выпадает в осадок с мочой и приводит к дальнейшему повреждению почек из-за кристалл-индуцированной нефропатии с периодической болью в боку [11]. Поскольку пик уровня этиленгликоля составляет от одного до четырех часов после перорального приема, а период полураспада этиленгликоля составляет от трех до девяти часов [11], незамедлительное распознавание и вмешательство являются обязательными для минимизации производства токсичных метаболитов.
Было обнаружено, что это конкретное повреждение не зависит от образования кристаллов оксалата кальция [10]. Поскольку оксалат соединяется с кальцием с образованием оксалата кальция, возникающая гипокальциемия может привести к параличу нервов и тетании. Также могут развиваться судороги и аритмии. Оксалат кальция выпадает в осадок с мочой и приводит к дальнейшему повреждению почек из-за кристалл-индуцированной нефропатии с периодической болью в боку [11]. Поскольку пик уровня этиленгликоля составляет от одного до четырех часов после перорального приема, а период полураспада этиленгликоля составляет от трех до девяти часов [11], незамедлительное распознавание и вмешательство являются обязательными для минимизации производства токсичных метаболитов.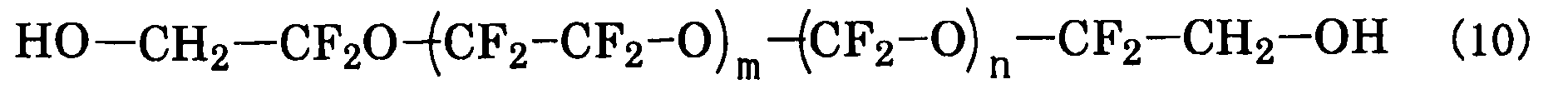 Газовая хроматография — наиболее распространенный метод определения этиленгликоля в сыворотке крови, но он не является широко доступным и часто является методом «рассылки». В исследовании, проведенном Черч и Уиттинг, ни в одной из обследованных больниц не было газовых хроматографических колонок для тестирования этиленгликоля, а время «отправки» составило более одного часа [12].Растворители для спиртов могут не включать этиленгликоль и приводить клинициста к неправильному выводу об отсутствии этиленгликоля, в то время как ферментативные анализы, как известно, дают ложноположительные результаты у пациентов с повышенным уровнем лактата или лактатдегидрогеназы [13]. Кроме того, пациенты, поступившие с опозданием, могут иметь нормальный уровень этиленгликоля, но могут быть в критическом состоянии, поскольку этиленгликоль уже метаболизирован до его токсичных метаболитов. Поэтому признание ключевых результатов более доступными лабораторными исследованиями в правильных клинических условиях имеет первостепенное значение.
Газовая хроматография — наиболее распространенный метод определения этиленгликоля в сыворотке крови, но он не является широко доступным и часто является методом «рассылки». В исследовании, проведенном Черч и Уиттинг, ни в одной из обследованных больниц не было газовых хроматографических колонок для тестирования этиленгликоля, а время «отправки» составило более одного часа [12].Растворители для спиртов могут не включать этиленгликоль и приводить клинициста к неправильному выводу об отсутствии этиленгликоля, в то время как ферментативные анализы, как известно, дают ложноположительные результаты у пациентов с повышенным уровнем лактата или лактатдегидрогеназы [13]. Кроме того, пациенты, поступившие с опозданием, могут иметь нормальный уровень этиленгликоля, но могут быть в критическом состоянии, поскольку этиленгликоль уже метаболизирован до его токсичных метаболитов. Поэтому признание ключевых результатов более доступными лабораторными исследованиями в правильных клинических условиях имеет первостепенное значение. Что касается нашего пациента, количественное определение этиленгликоля было выполнено с использованием газовой хроматографии Agilent ™ 7890A в соответствии с протоколом лаборатории токсикологического университета нашего центра (Detroit Medical Center, DMC). Сыворотка пациента была собрана в красный вакуумный контейнер и транспортировалась при комнатной температуре. Сыворотку хранили в холодильнике при температуре от 2 до 8 ° C. Рабочие стандарты были приготовлены путем смешивания объединенного стандарта этиленгликоля 25 мг / дл и пропиленгликоля 25 мг / дл с внутренним стандартом, содержащим 1,2-бутандиол 1000 мг / дл.Также использовали сыворотку без лекарств BioRad ™ и летучие вещества сыворотки, содержащие этиленгликоль. Контроли и образцы пациентов помещали в пробирки. В каждую пробирку добавляли установленное количество стандарта. Затем контроли и образцы пациентов переносили в фильтр Amicon ™, а фильтрат, не содержащий белков, переносили во флакон для инъекций с вкладышем для микропроб.
Что касается нашего пациента, количественное определение этиленгликоля было выполнено с использованием газовой хроматографии Agilent ™ 7890A в соответствии с протоколом лаборатории токсикологического университета нашего центра (Detroit Medical Center, DMC). Сыворотка пациента была собрана в красный вакуумный контейнер и транспортировалась при комнатной температуре. Сыворотку хранили в холодильнике при температуре от 2 до 8 ° C. Рабочие стандарты были приготовлены путем смешивания объединенного стандарта этиленгликоля 25 мг / дл и пропиленгликоля 25 мг / дл с внутренним стандартом, содержащим 1,2-бутандиол 1000 мг / дл.Также использовали сыворотку без лекарств BioRad ™ и летучие вещества сыворотки, содержащие этиленгликоль. Контроли и образцы пациентов помещали в пробирки. В каждую пробирку добавляли установленное количество стандарта. Затем контроли и образцы пациентов переносили в фильтр Amicon ™, а фильтрат, не содержащий белков, переносили во флакон для инъекций с вкладышем для микропроб. Образцы, стандарты и контроли обрабатывали в Agilent 7890A с автосамплером 6850 согласно протоколу токсикологии DMC.
Образцы, стандарты и контроли обрабатывали в Agilent 7890A с автосамплером 6850 согласно протоколу токсикологии DMC.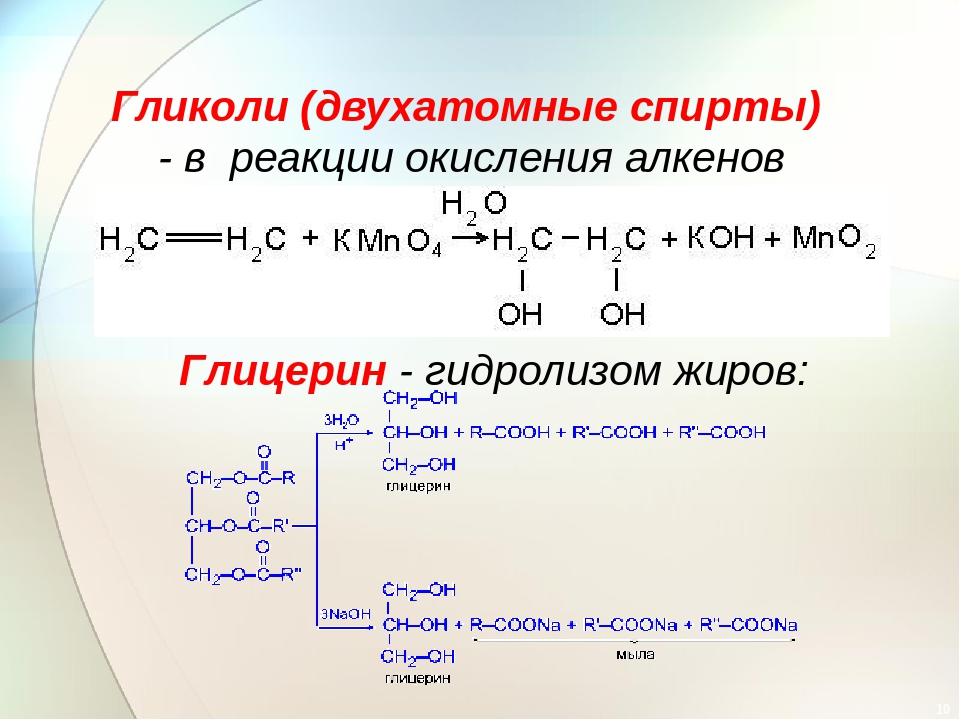 В частности, некоторые стационарные анализаторы цельной крови, в которых используется L-лактатоксидаза, могут перекрестно реагировать с гликолатом или глиоксилатом, что приводит к значительному увеличению количества ложноположительных результатов по лактату [15, 16]. Эти анализаторы обычно используются в отделениях неотложной помощи и лабораториях STAT для анализа газов артериальной крови. Напротив, лабораторные анализаторы сыворотки, которые используются для рутинного анализа образцов венозной крови, имеют меньшую перекрестную реакцию и показывают очень минимальное повышение уровня лактата.Этот разрыв в лактате между газом артериальной крови и образцом венозной крови свидетельствует о наличии токсичных метаболитов этиленгликоля, которые перекрестно реагируют с анализатором на месте оказания медицинской помощи. Этот разрыв в лактате, если он присутствует, можно использовать для диагностики интоксикации этиленгликолем даже при поздних проявлениях, а также для мониторинга клиренса метаболитов [16].
В частности, некоторые стационарные анализаторы цельной крови, в которых используется L-лактатоксидаза, могут перекрестно реагировать с гликолатом или глиоксилатом, что приводит к значительному увеличению количества ложноположительных результатов по лактату [15, 16]. Эти анализаторы обычно используются в отделениях неотложной помощи и лабораториях STAT для анализа газов артериальной крови. Напротив, лабораторные анализаторы сыворотки, которые используются для рутинного анализа образцов венозной крови, имеют меньшую перекрестную реакцию и показывают очень минимальное повышение уровня лактата.Этот разрыв в лактате между газом артериальной крови и образцом венозной крови свидетельствует о наличии токсичных метаболитов этиленгликоля, которые перекрестно реагируют с анализатором на месте оказания медицинской помощи. Этот разрыв в лактате, если он присутствует, можно использовать для диагностики интоксикации этиленгликолем даже при поздних проявлениях, а также для мониторинга клиренса метаболитов [16]. В нашем случае имелся значительный дефицит молочной кислоты, что отчасти побудило исследовать возможную интоксикацию этиленгликолем, и после начала гемодиализа этот разрыв уменьшился (Таблица 1).
В нашем случае имелся значительный дефицит молочной кислоты, что отчасти побудило исследовать возможную интоксикацию этиленгликолем, и после начала гемодиализа этот разрыв уменьшился (Таблица 1). Исходный спирт изначально вносит вклад как в осмоляльный, так и в анионный промежутки. Однако после того, как этиленгликоль метаболизируется, останется только анионный промежуток без осмоляльного промежутка. Это явление может помочь лечащим врачам отследить примерное время приема пищи.
Исходный спирт изначально вносит вклад как в осмоляльный, так и в анионный промежутки. Однако после того, как этиленгликоль метаболизируется, останется только анионный промежуток без осмоляльного промежутка. Это явление может помочь лечащим врачам отследить примерное время приема пищи. Тяжелый ацидоз и нарушение чувствительности могут потребовать эндотрахеальной интубации и гипервентиляции. Введение бикарбоната натрия у этих пациентов выполняет две функции: устранение ацидоза и депротонирование гликолевой кислоты и щавелевой кислоты до гликолата и оксалата, что снижает вероятность их проникновения в ткани органов-мишеней. Однако отсрочка начала гемодиализа для удаления оксалата и непрерывная инфузия бикарбоната может привести как к ухудшению гипокальциемии, так и к увеличению риска осаждения кристаллов оксалата кальция из-за повышения pH мочи.Следующим шагом является ингибирование алкогольдегидрогеназы фомепизолом или этанолом. Согласно текущим клиническим руководствам, фомепизол или этанол следует назначать в случаях концентрации этиленгликоля в сыворотке крови> 20 мг / дл, недавнего приема внутрь с осмолярным зазором> 10 мМоль или серьезных клинических подозрений при трех из следующих: pH артериальной крови <7,3, бикарбонат сыворотки <20 ммоль / л, осмолярный промежуток> 10 ммоль или кристаллы оксалата в моче [18].
Тяжелый ацидоз и нарушение чувствительности могут потребовать эндотрахеальной интубации и гипервентиляции. Введение бикарбоната натрия у этих пациентов выполняет две функции: устранение ацидоза и депротонирование гликолевой кислоты и щавелевой кислоты до гликолата и оксалата, что снижает вероятность их проникновения в ткани органов-мишеней. Однако отсрочка начала гемодиализа для удаления оксалата и непрерывная инфузия бикарбоната может привести как к ухудшению гипокальциемии, так и к увеличению риска осаждения кристаллов оксалата кальция из-за повышения pH мочи.Следующим шагом является ингибирование алкогольдегидрогеназы фомепизолом или этанолом. Согласно текущим клиническим руководствам, фомепизол или этанол следует назначать в случаях концентрации этиленгликоля в сыворотке крови> 20 мг / дл, недавнего приема внутрь с осмолярным зазором> 10 мМоль или серьезных клинических подозрений при трех из следующих: pH артериальной крови <7,3, бикарбонат сыворотки <20 ммоль / л, осмолярный промежуток> 10 ммоль или кристаллы оксалата в моче [18]. Критерии для начала антидотной терапии при известной или предполагаемой интоксикации этиленгликолем [18] следующие: Этиленгликоль в сыворотке> 20 мг / дл (3.2 мМоль / л), или Задокументированная недавняя история проглатывания токсичных количеств этиленгликоля и осмолярный промежуток> 10 мОсм / л, или Подозрение на проглатывание этиленгликоля и по крайней мере два из следующих: (1) pH артериальной крови <7,3 (2 ) Бикарбонат сыворотки <20 мМоль / л (мЭкв / л) (3) Осмолярный разрыв> 10 мОсм / л (4) Оксалатная кристаллурия. Следует отметить, что эти рекомендации основаны на мнениях экспертов, а не на клинических исследованиях. Гемодиализ показан при тяжелом ацидозе, уровне этиленгликоля> 50 мг / дл или при признаках поражения органов-мишеней, то есть при почечной недостаточности.Фомепизол предпочтительнее из-за более легкого дозирования и уменьшения побочных эффектов [19]. Тиамин, магний и пиридоксин действуют как кофакторы в различных реакциях, которые способствуют превращению глиоксиловой кислоты в менее токсичные метаболиты, такие как глицин (а позже и гиппуровая кислота) и α -гидрокси- β -кетоадипиновая кислота.
Критерии для начала антидотной терапии при известной или предполагаемой интоксикации этиленгликолем [18] следующие: Этиленгликоль в сыворотке> 20 мг / дл (3.2 мМоль / л), или Задокументированная недавняя история проглатывания токсичных количеств этиленгликоля и осмолярный промежуток> 10 мОсм / л, или Подозрение на проглатывание этиленгликоля и по крайней мере два из следующих: (1) pH артериальной крови <7,3 (2 ) Бикарбонат сыворотки <20 мМоль / л (мЭкв / л) (3) Осмолярный разрыв> 10 мОсм / л (4) Оксалатная кристаллурия. Следует отметить, что эти рекомендации основаны на мнениях экспертов, а не на клинических исследованиях. Гемодиализ показан при тяжелом ацидозе, уровне этиленгликоля> 50 мг / дл или при признаках поражения органов-мишеней, то есть при почечной недостаточности.Фомепизол предпочтительнее из-за более легкого дозирования и уменьшения побочных эффектов [19]. Тиамин, магний и пиридоксин действуют как кофакторы в различных реакциях, которые способствуют превращению глиоксиловой кислоты в менее токсичные метаболиты, такие как глицин (а позже и гиппуровая кислота) и α -гидрокси- β -кетоадипиновая кислота. Однако их роль невелика, и клиницисты не должны полагаться исключительно на них при лечении острой токсичности (рис. 2) [11].
Однако их роль невелика, и клиницисты не должны полагаться исключительно на них при лечении острой токсичности (рис. 2) [11]. Продолжительность гемодиализа зависит от уровня этиленгликоля в начале. Подтвержденное уравнение можно использовать для оценки времени, необходимого в часах:, где — общий объем воды в организме в литрах, — это натуральный логарифм, — это начальная концентрация этиленгликоля в мМоль / л и составляет 80 процентов от клиренса мочевины диализатора в мл. / мин, который зависит от производителя и может быть легко найден с помощью поисковых систем [20].У нашего пациента вес составлял 90 кг (45 кг воды), уровень этиленгликоля в начале диализа составлял 54 мг / дл (равен 8,7 мМоль / л), а клиренс диализатора мочевины используемого нами фильтра составлял 266 мл / л. мин при кровотоке 300 мл / мин. Мы оценили необходимую продолжительность гемодиализа в два часа. Если бы гемодиализ был начат, когда его предполагаемый уровень этиленгликоля составлял 316 мг / дл, ему потребовалось бы более 8 часов гемодиализа.
Продолжительность гемодиализа зависит от уровня этиленгликоля в начале. Подтвержденное уравнение можно использовать для оценки времени, необходимого в часах:, где — общий объем воды в организме в литрах, — это натуральный логарифм, — это начальная концентрация этиленгликоля в мМоль / л и составляет 80 процентов от клиренса мочевины диализатора в мл. / мин, который зависит от производителя и может быть легко найден с помощью поисковых систем [20].У нашего пациента вес составлял 90 кг (45 кг воды), уровень этиленгликоля в начале диализа составлял 54 мг / дл (равен 8,7 мМоль / л), а клиренс диализатора мочевины используемого нами фильтра составлял 266 мл / л. мин при кровотоке 300 мл / мин. Мы оценили необходимую продолжительность гемодиализа в два часа. Если бы гемодиализ был начат, когда его предполагаемый уровень этиленгликоля составлял 316 мг / дл, ему потребовалось бы более 8 часов гемодиализа.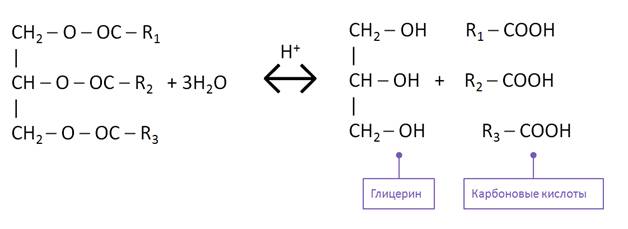 В ретроспективном исследовании Lung et al. Пациенты, у которых были более низкие шансы на выздоровление, с большей вероятностью имели кому или судороги, имели глубокий ацидоз или получали терапию (фомепизол или диализ) более чем через 6 часов после обращения [21]. Следует отметить, что в большинстве случаев, описанных в литературе, участвуют молодые пациенты, поэтому вероятность выздоровления в этой популяции может быть выше. К сожалению, наш пациент был пожилым, имел другие сопутствующие заболевания и обратился поздно с тяжелым ацидозом, что снизило шансы на выздоровление.
В ретроспективном исследовании Lung et al. Пациенты, у которых были более низкие шансы на выздоровление, с большей вероятностью имели кому или судороги, имели глубокий ацидоз или получали терапию (фомепизол или диализ) более чем через 6 часов после обращения [21]. Следует отметить, что в большинстве случаев, описанных в литературе, участвуют молодые пациенты, поэтому вероятность выздоровления в этой популяции может быть выше. К сожалению, наш пациент был пожилым, имел другие сопутствующие заболевания и обратился поздно с тяжелым ацидозом, что снизило шансы на выздоровление.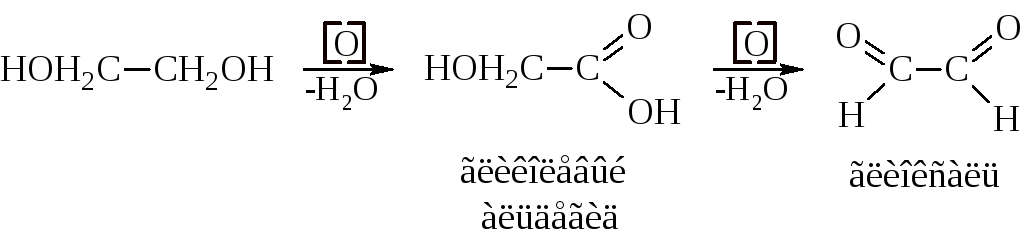 Принимая во внимание неясные обстоятельства случаев проглатывания нашим пациентом, мы почувствовали необходимость предупредить службы защиты взрослых, чтобы исключить какие-либо злонамеренные намерения со стороны лица, осуществляющего уход.Пациент по-прежнему находится на диализе, и вскоре выздоровления не ожидается.
Принимая во внимание неясные обстоятельства случаев проглатывания нашим пациентом, мы почувствовали необходимость предупредить службы защиты взрослых, чтобы исключить какие-либо злонамеренные намерения со стороны лица, осуществляющего уход.Пациент по-прежнему находится на диализе, и вскоре выздоровления не ожидается.




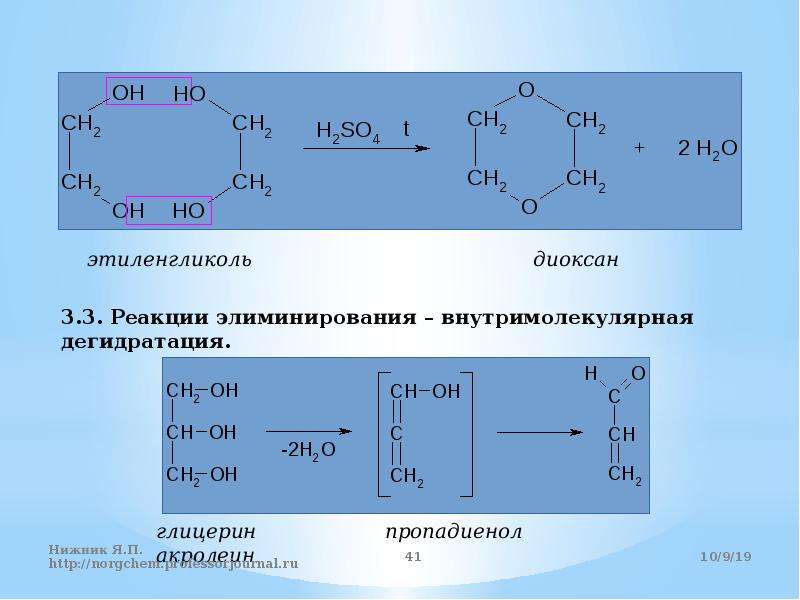 Однако эти тесты не могут использоваться для прогнозирования того, как это повлияет на ваше здоровье, и в основном используются для мониторинга уровней воздействия на рабочем месте.
Однако эти тесты не могут использоваться для прогнозирования того, как это повлияет на ваше здоровье, и в основном используются для мониторинга уровней воздействия на рабочем месте. Этиленгликоль также входит в состав гидравлических тормозных жидкостей.
Этиленгликоль также входит в состав гидравлических тормозных жидкостей.