Какое напряжение у заряженного автомобильного аккумулятора: При каком напряжении аккумулятора машина не заводится – При каком напряжении аккумулятора машина не заводится — autopower2015.ru
Каково напряжение заряженного автомобильного аккумулятора и от чего зависит этот показатель
Одним из важных показателей, обеспечивающих уровень работоспособности машины, является напряжение заряженного автомобильного аккумулятора. Каждый автовладелец должен знать о том, как измерять U АКБ и сколько вольт должен показывать заряженный аккумулятор, если он находится в продуктивном рабочем состоянии. Знание этого показателя необходимо для того, чтобы правильно оценивать текущее состояние аккумулятора автомобиля и вовремя обеспечить ему необходимую подзарядку, если показатель будет значительно меньше нормы.
Каким должно быть U АКБ в норме
Сразу стоит отметить, что сверхточных показателей здесь нет. Практика показывает, что запустить двигатель возможно даже тогда, когда уровень напряжения снижается больше, чем на 50%. Однако, для того чтобы не «посадить» батарею и не быть застигнутым врасплох тем, что аккумулятор «внезапно разрядился», водителю обязательно нужно регулярно контролировать батарею, периодически делая замеры на ее клеммах.
Если речь идет о понятии выходного напряжения, на АКБ оно может быть указано цифрой в 12 В. Однако на практике амплитуда этого показателя может колебаться в большую или меньшую сторону. Это зависит от интенсивности эксплуатации АКБ и состояния ее внутренних химических составляющих.
Владельцу автомобиля следует запомнить несколько цифр, которые без преувеличения можно назвать показателями первостепенной важности:
- Напряжение от 12,4 до 12,8 В — нормальные фактические показатели, состояние АКБ рабочее, разрядка минимальна.
- Ниже 12 В — батарея разряжена более, чем на 50%. Ездить можно, но аккумулятор скоро будет нуждаться в зарядке.
- Ниже 11,6 В — критическое снижение показателя, батарея разряжена почти или полностью, ей срочно требуется зарядка.
Итак, правильный ответ на вопрос о том, какое напряжение должно быть у автомобильной АКБ в норме, — цифры 12,4-12,8 В.
Практика показывает, что «полная» батарея, которая заряжалась недавно, имеет U 12,7 В. Если АКБ уже подразрядилась, число уменьшается, начиная от 12,3 В и ниже.
Таблица заряда аккумулятора по напряжению →
Что такое нагрузка и почему она необходима
Очень важно знать о том, что приведенные выше цифры номинального напряжения аккумулятора (12,4-12,8 В) не означают, что батарея способна долго выдержать нагрузку в виде двигателя внутреннего сгорания. Ведь замеры именно таким образом производятся в состоянии покоя батареи, а не в процессе ее работы. Поэтому есть метод проверки фактической работоспособности автомобильного аккумулятора с помощью такого прибора, как нагрузочная вилка.
Правила использования нагрузочной вилки:
- силу тока нужно выставлять, исходя из показателя емкости АКБ — при емкости батареи 60 Ач сила тока должна быть 120 А, то есть в два раза больше;
- нагрузку проводить в течение 3-5 секунд, этого достаточно;
- помнить о том, что 5-6 В — это критическое падение U, батарея почти разряжена, либо уровень ее емкости очень мал;
- при нормальном рабочем состоянии аккумулятора после окончания нагрузки должно произойти быстрое восстановление его напряжения до исходного уровня (12 вольт, либо немного выше).
Нагрузочная вилка надевается на плюсовую клемму автомобильного аккумулятора. Минусовая клемма фиксируется широким железным зажимом (можно использовать плоскогубцы). Нагрузочная вилка может измерять уровень напряжения как в разомкнутой цепи, когда батарея находится в покое, так и создавать замкнутую цепь при подаче тока от 150 до 200 А.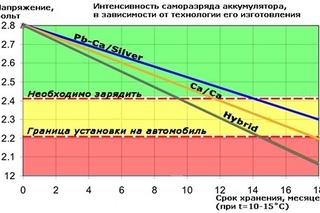
При имитации запуска двигателя U батареи падает. В норме его снижение не должно составлять 9-10 В. Если оно продолжает падать, пока работает вилка, значит, аккумулятор слабый.
Принцип работы электролита АКБ и его роль в разное время года
Немаловажно знать и основную суть химических процессов, протекающих внутри свинцово-кислотной аккумуляторной батареи для того, чтобы ориентироваться в тех ситуациях, когда уровень ее напряжения изменяется.
Чем больше разряжается батарея в процессе эксплуатации автомобиля, тем быстрее расходуется кислотная среда внутри нее, что обеспечивает быстрое снижение плотности электролитического состава. Когда же батарея заряжается, при расходе воды кислота, наоборот, начинает образовываться, и плотность электролита становится больше. В норме при заряженной батарее (12,7 В) плотность электролита должна составлять 1,27 гр/см3. Этот показатель можно измерить ареометром — принцип работы этого прибора предельно прост.
В норме при заряженной батарее (12,7 В) плотность электролита должна составлять 1,27 гр/см3. Этот показатель можно измерить ареометром — принцип работы этого прибора предельно прост.
Что касается традиционного снижения U батареи автомобиля в зимнее время, эту проблему можно решить, регулярно контролируя все ее показатели, о которых уже говорилось выше. Такой контроль поможет, прежде всего, определить, нуждается ли АКБ в зарядке. Если зимой производить обслуживание аккумулятор вовремя и следить за тем, чтобы напряжение и фактическая работоспособность не падали ниже нормы, в сильные морозы аккумулятор сохранит достаточное количество плотности электролита для наиболее продуктивной работы.
Итак, напряжение заряженного автомобильного аккумулятора зависит от очень многих показателей. Ведущую роль здесь играет внимательность автолюбителя и умение проводить необходимые своевременные манипуляции с аккумулятором для того, чтобы АКБ работала долго и исправно, не требуя ремонта.
Каким током и напряжением заряжать автомобильный аккумулятор
03.05.2017
Для заряда АКБ, кроме зарядного устройства, необходим так же тестер, измеряющий напряжение.
Ключевые моменты в процессе заряда АКБ:
1. Не превышать напряжение заряда 14,4 Вольта*.
2. Контролировать напряжение заряда тестером**.
3. Если напряжение поднимается 15-16 Вольт и выше, и нет регулировок тока и напряжения в ЗУ, прекратить заряд***.
4. При наличии регулировки тока в ЗУ: выставить ограничение max. тока в начале заряда, а затем в процессе заряда уменьшить его (контролируя напряжение заряда тестером)***.
5. Обычно увеличение силы тока регулировкой в зарядном устройстве поднимает и напряжение заряда****
*Напряжение заряда свинцово-кислотного автомобильного аккумулятора 14.4 В! Не превышайте это напряжение по двум очень важным причинам:
— при более высоком напряжении аккумулятор начинает кипеть: выделять ГРЕМУЧУЮ СМЕСЬ из водорода и кислорода, которая может взорваться!
 Произойдет ускоренное старение АКБ.
Произойдет ускоренное старение АКБ.** В большинстве недорогих зарядных устройств напряжение заряда не ограничено 14,4 Вольт, а может достигать нежелательных 15-16 Вольт. В этом случае необходимо, контролировать напряжение заряда тестером, а если тестера нет, то выкрутив пробки и наблюдая за тем, чтобы электролит не кипел. Если АКБ начала кипеть при зарядке, а напряжение заряда понизить нельзя (нет регулировки), то лучше всего прекратить такой заряд.
*** Высокое напряжение заряда 15-16 Вольт за считанные часы может испортить Ваш аккумулятор.
**** Ток заряда не должен превышать 1/10 емкости аккумулятора, то есть максимальный ток для батареи 60Ач — 6 Ампер, а для 100Ач — 10 Ампер.
****Если есть регулировка уровня тока заряда в вашем ЗУ — ограничьте максимальный ток заряда. Особенно это важно при начальном этапе заряда сильно разряженных АКБ. На практике чаще всего ток заряда не регулируется, а просто на самом устройстве указан его максимально возможный ток. В этом случае к аккумулятору емкости 60Ач покупается ЗУ с максимальным током заряда не выше 5-6 Ампер.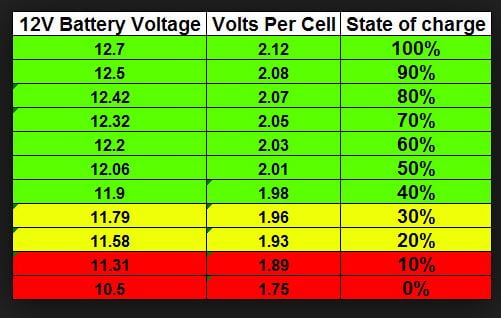 Если в вашем зарядном регулируется сила тока заряда, обратите внимание на напряжение заряда! Во многих зарядках увеличение тока заряда автоматически увеличивает и напряжение заряда!!!
Если в вашем зарядном регулируется сила тока заряда, обратите внимание на напряжение заряда! Во многих зарядках увеличение тока заряда автоматически увеличивает и напряжение заряда!!!
Самое главное требование к процессу заряда АКБ — не превышать напряжение на клеммах выше 14,4-14,6 Вольт.
Как правильно заряжать аккумулятор | АВТОЧАС
Как для зарядки необслуживаемого аккумулятора с помощью зарядного устройства так и для зарядки обслуживаемого АКБ следует соблюдать некоторые правила. Зарядное устройство является конденсаторным.
Аккумулятор в авто служит постоянным источником электротока. При его подключении нужно соблюдать полярность. Чтобы добиться выполнения этого условия, на местах подключения имеются метки — и на АКБ, и на зарядном устройстве (ЗУ).
Следует учитывать, что при случайной смене полярности батарея разряжается. Вследствие глубокого разряда (когда аккумулятор посажен целиком) возможен выход из строя аккумуляторной батареи, следствием чего может стать невозможность зарядки её с помощью ЗУ.
Перед тем, как подключить зарядное устройство, необходимо снять АКБ с авто и полностью устранить с неё вероятные загрязнения. Кислотные потёки эффективно удаляются с помощью влажной ветоши, которую смачивают в содовом растворе (концентрация соды в воде составляет 10%). О наличии кислоты говорит вспенивание раствора в момент нанесения его на корпус аккумулятора.
На обслуживаемом аккумуляторе выкручивают пробки, расположенные на «банках», чтобы обеспечить заливание кислоты. В ходе зарядки аккумулятора в нём возникают газы, нуждающиеся в свободном выходе. Нужно проверить уровень электролита и в случае, если он ниже нормы, долить дистиллированную воду.
%rtb-4%
Какое напряжение необходимо для зарядки автомобильного аккумулятора
Для зарядки аккумулятора необходима подача электротока, которого недостаёт для того, чтобы полностью зарядить АКБ. Существуют следующие виды ЗУ:
- Автоматические — их недостаток заключается в высокой цене. Когда аккумулятор, ёмкость которого составляет 50 А*ч, наполовину заряжен, первоначально устанавливают электрический ток силой 25 А, затем происходит динамичное уменьшение силы тока.
 Когда аккумулятор заряжается полностью, ток прекращает поступать. С помощью автоматического зарядного устройства зарядка аккумулятора происходит в течение четырёх-шести часов.
Когда аккумулятор заряжается полностью, ток прекращает поступать. С помощью автоматического зарядного устройства зарядка аккумулятора происходит в течение четырёх-шести часов. - Полуавтоматические — стоят дешевле и более распространены на рынке. Однако требуют полностью ручной настройки. При ёмкости аккумулятора 50 А*ч, чтобы его полностью зарядить, необходимо подать максимум 30 А*ч. На зарядное устройство выставляют 3 А, необходимо 10 часов, чтобы обеспечить полную зарядку аккумулятора с помощью такого зарядного устройства. Чтобы убедиться в зарядке, спустя 10 часов следует установить на зарядном устройстве силу тока 0,5 А, а затем заряжать аккумулятор на протяжении ещё пяти-десяти часов. Данный способ зарядки безопасен для аккумулятора, имеющего большую ёмкость. Единственный недостаток — продолжительность зарядки, составляющая примерно сутки.
Зарядка при большей силе тока (свыше 3 А) вызывает перезарядку АКБ и её перегревание, которые значительно сокращают ресурс аккумулятора.
Для правильной эксплуатации АКБ необходимо исключить глубокий разряд и своевременно проводить подзарядку при помощи зарядного устройства, что обеспечит работу кислотного аккумулятора на срок три-семь лет.
Как зарядить аккумулятор если нет зарядного устройства
Простейший способ зарядки аккумулятора — запуск авто посредством «прикуривания» от другой машины. Затем необходимо ездить на авто в течение примерно 20 минут. Чтобы зарядка от генератора была эффективной, нужно динамично двигаться на высоких передачах или же ездить на одной низкой передаче. Основное условие — уровень оборотов коленвала должен быть в диапазоне от 2900 до 3200 об/мин. Это позволит генератору обеспечивать необходимый электроток, позволяющий осуществить подзарядку батареи. Этот метод подойдёт исключительно при частичном разряде аккумулятора, но не при полном. По окончанию поездки понадобится всё равно полностью зарядить аккумулятор.
Нередко автовладельцы стремятся получить возможность зарядки автомобильного аккумулятора зарядными устройствами для мобильных гаджетов.
Главное условие подачи электротока от ЗУ к аккумулятора — наличие на выходе зарядного устройства напряжения, превышающего напряжение тока на выходах АКБ. Однако напряжение батарей мобильных устройств обычно не выше 7 В. При наличии под рукой ЗУ от мобильного гаджета, имеющего требуемое напряжение 12 В, не удастся решить проблему, поскольку сопротивление автомобильной АКБ выражается целыми Омами.
Поэтому подключение ЗУ от мобильного гаджета к выходам автомобильной АКБ приведёт к короткому замыканию на выводах блока питания ЗУ. В блоке сработает защита, вследствие которой такое зарядное устройство не подаёт электрический ток на АКБ. Когда отсутствует защита, возникает риск поломки блока питания вследствие сильной нагрузки.
Нельзя заряжать от разных блоков питания, в которых конструктивно не предусмотрена возможность регулирования силы подаваемого электрического тока. Специальное зарядное устройство для автомобильного аккумулятора на своём выходе имеет необходимые значения напряжения и силы электротока для зарядки АКБ. Одновременно можно управлять постоянной величиной электрического тока.
Одновременно можно управлять постоянной величиной электрического тока.
%rtb-4%
Зарядка нового аккумулятора
Новая АКБ подразумевает немедленную установку её на авто для эксплуатации. По этой причине он должн быть полностью заряжен. Необходимо проверить его по следующим параметрам:
- отсутствие повреждений корпуса, нарушений целостности;
- замер электрического напряжения, имеющегося на выходах;
- плотность электролита;
- дата производства аккумулятора.
Первоначально нужно снять защитную плёнку, провести осмотр корпуса на наличие потёков, трещин и прочих недостатков. При обнаружении даже незначительных дефектов нужна замена аккумулятора.
Потом следует определить напряжение, имеющееся на клеммах аккумулятора. Для этого используется вольтметр, точность которого большой роли не играет. Недопустимо напряжение менее 12 В, поскольку оно говорит о низком заряде АКБ, что для новой АКБ недопустимо.
Плотность электролита измеряется с помощью ареометра.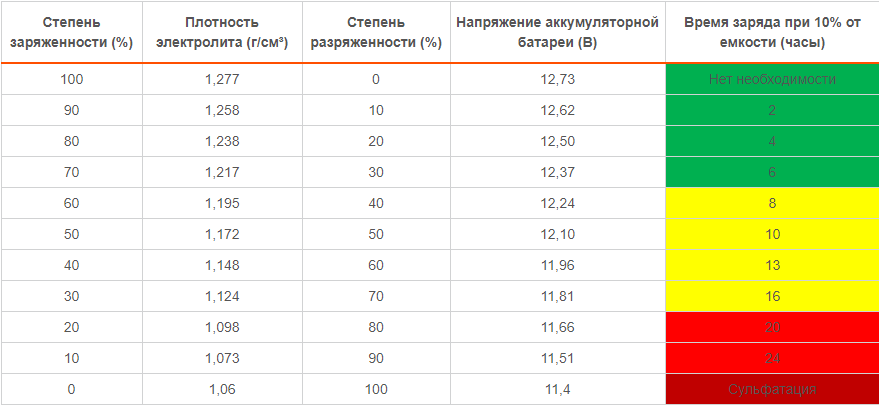 По уровню плотности косвенно можно судить о заряде АКБ.
По уровню плотности косвенно можно судить о заряде АКБ.
АКБ, которые были выпущены раньше, чем за шесть месяцев до даты приобретения, покупать не стоит, поскольку готовая к применению АКБ склонна к саморазряду.
Как проверить автомобильный аккумулятор
Как проверить автомобильный аккумулятор мультиметром
Проверить аккумулятор мультиметром — несложный процесс. Первое, что нужно сделать, это убедиться, что у вас есть доступ к двум клеммам в верхней части батареи.
Аккумуляторы обычно располагаются в моторном отсеке сбоку от двигателя и часто имеют пластиковую крышку, которая отсоединяется, поднимается или иногда требует удаления пары болтов. Также может быть крышка положительного (+) вывода, которая обычно отрывается.
Haynes пошаговые инструкции покажут вам, где найти аккумулятор, и упростят задачу по его замене. Здесь вы найдете руководство
Когда батарея обнажена, будьте осторожны, чтобы никакие металлические предметы не касались клемм, поэтому не кладите на нее гаечные ключи или другие инструменты.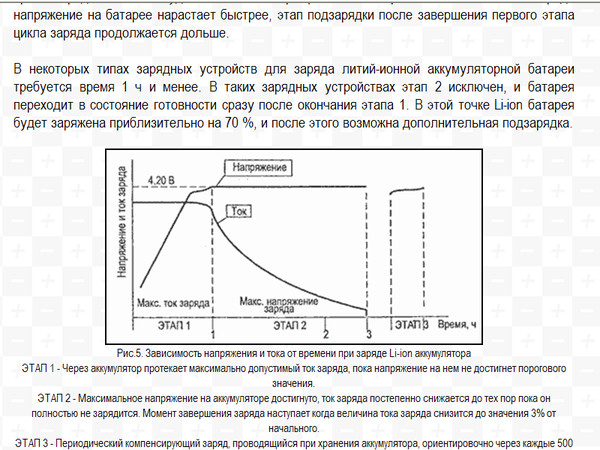
С помощью мультиметра вы хотите измерить напряжение постоянного тока (это обозначено сплошной линией и пунктирной линией над буквой V). Установите циферблат на 20. Это позволит вам точно измерять 0-20 вольт.
Поднесите красный щуп к положительной клемме, а черный щуп к отрицательной клемме. Клеммы будут отмечены «+» и «-». Если вы получаете показание с минусом перед ним (-12,6, а не 12,6), значит, датчики ошиблись.
В идеале напряжение покоя должно быть не ниже 12,6 В. Имейте в виду, что когда аккумулятор опускается до 12,2 В, он фактически заряжен только на 50%, а при напряжении ниже 12 В он классифицируется как разряженный.
Что делать, если разрядился аккумулятор автомобиля
Если батарея постоянно разряжается, это может быть из-за «паразитной потери».Здесь что-то электрическое — например, свет или двигатель — разряжает аккумулятор, даже если двигатель выключен. Помимо очевидного (настройка телефона на запись видео перед тем, как положить его в багажник или перчаточный ящик, чтобы увидеть, горит ли лампочка), вы можете либо отсоединить провода от аккумулятора, либо полностью вынуть его из автомобиля.
Затем полностью зарядите аккумулятор, оставьте его на 12 часов и проверьте его. Если аккумулятор держит заряд, когда он не подключен к автомобилю, он не неисправен.
ПОЛЕЗНЫЙ СОВЕТ: перед тем, как отсоединить аккумулятор, убедитесь, что вы знаете код стереосистемы — иначе вы можете обнаружить, что он не будет работать при повторном подключении!
Почини СВОЮ машину сегодня с помощью Руководства Haynes, в печатном или электронном виде!
Как проверить автомобильный аккумулятор на мертвые ячейки
Многие новые автомобильные аккумуляторы относятся к категории запечатанных, не требующих обслуживания. Но некоторые старые батареи позволяют получить доступ к отдельным ячейкам. Ячейки будут иметь либо отдельные крышки, либо пластиковую крышку, которая закрывает все ячейки, либо некоторые ячейки.
Ячейки содержат смесь воды и серной кислоты, так что вам не стоит слишком возиться внутри них.
Вы можете купить тестер аккумуляторов в виде ареометра, который измеряет удельную плотность аккумуляторной кислоты и может определить, «мертвые» ли какие-либо элементы.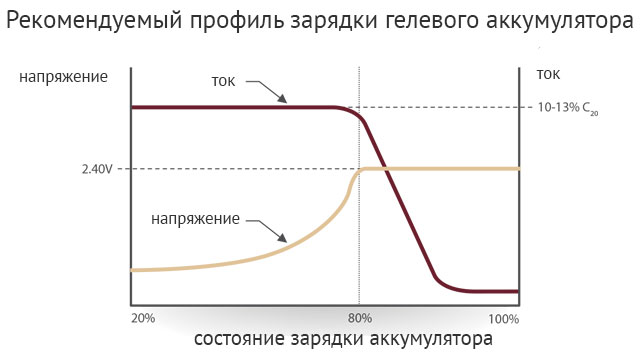
Однако знание того, что элемент «мертв», не имеет для вас большей пользы, чем знание того, что батарея не держит заряд, поэтому проверка напряжения покоя является столь же эффективной диагностикой.
Что внутри автомобильного аккумулятора? Узнайте в «Анатомии автомобильного аккумулятора»
Что такое аккумулятор? — учиться.sparkfun.com
Добавлено в избранное Любимый 21 годВведение
Батареи представляют собой совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция.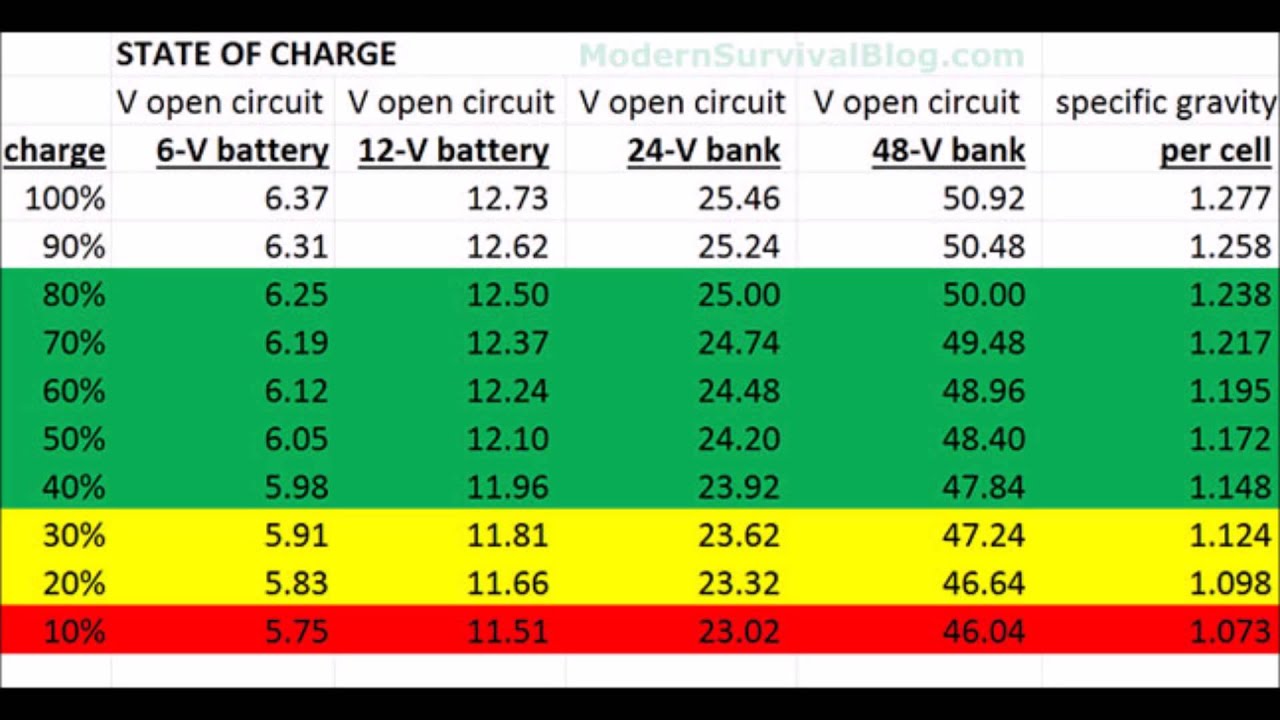 Эта реакция заставляет электроны проходить через цепь и обратно к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Эта реакция заставляет электроны проходить через цепь и обратно к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбрасывать после использования, известны как первичные батареи . Аккумуляторы, которые можно перезаряжать, называются вторичными аккумуляторами .
Литий-полимерные батареи, например, можно заряжать
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную проверять машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к сети (как в старые добрые времена).Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218 Это ваши стандартные щелочные батареи на 9 вольт от Rayovac.Даже не думайте пытаться их перезарядить. Используйте их с…
Используйте их с…
История
Термическая батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, соединенных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушачьей лапки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления в гальванической куче
Уильям Круикшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Желобковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «элемент Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, а свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначались для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Цинк-угольная батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ Commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Компания Asahi Chemical из Японии построила первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, было изобретено, произведено и устарело гораздо больше химических элементов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но вы поняли.Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде.Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, способное переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения.
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Для большинства аккумуляторов требуется способ удержания их химических компонентов. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, мягких пластиковых пакетов и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри анода или вокруг него, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окисление , а реакция на катоде использует дополнительные электроны в процессе, известном как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
При некоторых реакциях окисления образуются ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже когда батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задыхаются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», чтобы достичь чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Разряженная батарея
Химические вещества в батарее в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, когда говорят о напряжении, емкости батареи, возможности источника тока и так далее.
Ячейка
Элемент — это один анод и катод, разделенные электролитом, который используется для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг на друга
Первичная
Первичные клетки содержат химический состав, который нельзя обратить вспять. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, иначе известные как «аккумуляторные батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo-элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение его цикла разряда.
Вместимость
Емкость аккумулятора — это величина электрического заряда, который он может доставить при определенном напряжении. Большинство батарей рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батарей показывают зависимость напряжения батареи от емкости, например, эти тесты батарей AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей цепи, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-Rate
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это сила тока, необходимая для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при повышенном потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких скоростях C.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или меньше.
MIT предлагает фантастическое руководство по спецификациям и терминологии батарей, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот Photon Battery Shield питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки на 1,5 В соединены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо обязательно использовать специальную схему, известную как «балансир», чтобы обеспечить равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельный
Если напряжение отдельной ячейки соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какая-либо разница в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серияи параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать батареи последовательно и параллельно. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, поскольку может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батарейки и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Как работает аккумулятор и 3 способа его испортить
Одно из самых полезных электронных устройств, доступных нам, также является одним из самых распространенных.Современные аккумуляторы используются во многих из наших любимых технологий, что можно почти простить за то, что вы не тратите время на изучение их работы.
Но теперь для вас настало время расширить свою базу знаний, поняв, как работает смартфон в вашем кармане, каковы распространенные разновидности аккумуляторов и что вы можете сделать, чтобы продлить срок их службы.
Краткая история батарей
Алессандро Вольта продемонстрировал первую работающую электромагнитную батарею в 1800 году.Его стопка медных и цинковых пластин, разделенных пропитанными рассолом бумажными дисками, вырабатывала стабильное напряжение в течение «разумного» периода времени. Это было известно как гальваническая батарея и стало предшественником поколения экспериментов с батарейным питанием.
В 1836 году Джон Фредерик Дэниелл стандартизировал конструкцию батареи.Медный горшок, наполненный раствором медного купороса, погруженный в неглазурованный глиняный сосуд, наполненный серной кислотой, и цинковый электрод стали де-факто стандартом аккумуляторов, распространенным в бесчисленных электрических телеграфных сетях.
Перенесемся в Оксфордский университет, 1979 год.Джон Гуденаф и Коичи Мидзусима продемонстрировали работающий перезаряжаемый элемент с диапазоном 4 В, в котором оксид лития-кобальта использовался в качестве положительного электрода и металлического лития в качестве отрицательного. Предшественник литиевого элемента в том виде, в каком мы его знаем, родился — но был коммерциализирован только в 1991 году Sony и Asahi Kasei в своих портативных электронных устройствах.
Что такое современная батарея?
Мы используем термин современная батарея для описания электрохимических элементов, которые питают наши портативные технологические устройства.Батареи делятся на две общие категории:
- Одноразовые: одноразовые батарейки с электродами, которые необратимо меняются во время использования.
- Аккумуляторные: многоразовые батареи с электродами, восстанавливаемыми обратным током.
В большинстве современных портативных электронных устройств используется литиевая батарея, наиболее распространенной из которых является литий-ионный ( Li-ion ) элемент. Вы также можете встретить литий-полимерный ( Li-Po ) элемент, который имеет такой же электрохимический состав и общий химический состав, что и его аналог, но стоит дороже в производстве и имеет более низкую плотность энергии.
Тем не менее, Li-Po аккумуляторы по-прежнему популярны из-за их легкого веса, гибкости конструкции и улучшенных рабочих характеристик при более высоких и низких температурах, с чем Li-ion может бороться.
Литий-ионные батареи обычно содержат интеркалированное соединение лития, такое как оксид лития-кобальта (LiCoO 2 ) в качестве одного электрода, графит в качестве второго и органический растворитель в качестве электролита.Это соединение используется из-за его высокой плотности энергии и медленной потери заряда, когда он не используется, а также из-за того, что не требуется циклическое переключение памяти для продления срока службы батареи.
Все литиевые батареи содержат температурный коэффициент давления.Это отказоустойчивый переключатель или датчик, предназначенный для предотвращения перегрева батареи в экстремальных условиях или чрезмерного использования — процесса, который обычно делает батарею бесполезной из-за необратимого повреждения химических соединений, которые делают возможным процесс заряда / разряда.
Процесс зарядки
Литиевые батареи стали предпочтительными для портативных технологий благодаря их высокой плотности энергии и перезаряжаемым качествам.
Во время процесса зарядки ионы лития перемещаются через электролит от положительного электрода из оксида лития-кобальта к отрицательному электроду из графита.При разряде или использовании ионы возвращаются через электролит, от отрицательного к положительному. Этот процесс происходит при относительно высоком напряжении — 3,7 вольт по сравнению с щелочной батареей AA при 1,5 вольт — вот почему литиевые батареи стали предпочтительным портативным источником питания для многих потребительских электронных устройств.
Литиевые батареи также входят в состав более крупных аккумуляторных блоков, таких как аккумулятор для ноутбука.Эти аккумуляторные блоки содержат ряд литий-ионных элементов, связанных в один более крупный компонент, и будут содержать ряд дополнительных компонентов:
- Температурный датчик : Датчик, контролирующий температуру внутри упаковки в попытке сохранить безопасность и долговечность ячеек.
- Регулятор напряжения : Датчик и схема для контроля и регулирования выходной мощности / емкости каждой ячейки внутри блока
- Battery Charge State : Датчик, информирующий операционную систему о текущем состоянии заряда (например, 47% заряда)
- Разъем : Коннектор для портативного компьютера, зависит от марки.
Литиевые батареи могут выполнить тысячи циклов заряда / разряда, прежде чем качество элемента начнет действительно ухудшаться, но есть несколько способов испортить батарею, потенциально подвергая себя опасности.
Обслуживание батареи
Положительный электрод, встречающийся в большинстве литиевых батарей, LiCoO 2 , может представлять ряд опасностей в случае повреждения элемента.В отличие от ряда других вариантов батарей, использование горючего компаунда под давлением может привести к экстремальным результатам. Чтобы уменьшить это, элементы литиевых батарей подвергаются ряду испытаний на безопасность, многие из которых более строгие, чем их аналоги на основе кислоты.
Тепло
Было несколько случаев воспламенения литиевых батарей в условиях экстремальной жары.Батареи под воздействием теплового воздействия в сочетании с любым дополнительным, неожиданным давлением или коротким замыканием могут «взорваться», оставив разрушенную батарею и, чаще всего, поврежденный элемент портативной техники.
Каждая литиевая батарея имеет встроенный сепаратор внутри элемента.Это различает положительный и отрицательный электроды в процессе заряда / разряда. Если этот разделитель будет перфорирован или поврежден, существует вероятность контакта электродов. Это приводит к быстрому нагреву аккумулятора, что может привести к взрыву.
Батарея имеет вентиляционный механизм, чтобы предотвратить такое возникновение, но, в конечном счете, из-за природы удаляемого химического соединения, вероятность взрывной реакции все еще сохраняется из-за тепла, выделяемого химической реакцией.
Номинальные значения разрядки
Литиевые батареи предпочитают частичный разряд, а не «глубокий» или «полный».У них нет зарядной памяти, поэтому частичный разряд не повлияет на будущую производительность.
Однако «глубокая» разрядка i.е. полный разряд батареи вызовет падение напряжения литиевой батареи и может привести к необратимому повреждению батареи.
Процесс старения
Литиевые батареи стареют.Предполагается, что их максимальный срок службы составляет от 2 до 4 лет в зависимости от количества циклов заряда / разряда. Это не означает, что вам следует отслеживать количество раз, когда вы используете батарею, поскольку это было бы довольно сложно. Но отказ от использования новой батареи и оставление ее на полке не продлит срок службы батареи — батареи все равно прослужат те же 2-4 года.
Также стоит проверить, когда была произведена батарея, при покупке нового портативного технического продукта.Если он простаивал на складе в течение года, срок службы батареи уже истощился. Свяжитесь с производителем продукта и по возможности попросите новую батарею.
Существуют современные приложения для управления батареями, которые утверждают, что могут со временем обратить вспять текущую приемлемую деградацию ячеек, например, batteryOS, продукт, который будет запущен в феврале 2015 года.
Li-Air
В литиевых батареях следующего поколения будет использоваться химический состав литий-воздух, обеспечивающий чрезвычайно высокую плотность энергии во все более легких конструкциях.Литий-воздушные батареи получают преимущество в плотности энергии по сравнению с традиционными аналогами за счет использования большого количества кислорода для индукции тока, вместо того, чтобы хранить необходимый химический окислитель внутри.
К сожалению, до того, как коммерчески жизнеспособный продукт Li-Air появится в наших портативных устройствах, все еще необходимы исследования в ряде ключевых областей.
Помогло ли это вам понять батареи в ваших портативных устройствах? Дайте нам знать, что вы думаете ниже!
Кредиты на изображения: Батареи через Wikimedia Commons, Voltaic Pile через Wikimedia Commons, Литий-ионные батареи через Wikimedia Commons, Литий-полимерные батареи через Wikimedia Commons, 3GS со сломанной батареей через Wikimedia Commons, Пустая батарея через Pixabay, Плотность энергии батареи через Wikimedia Commons
Epic Games подала новую юридическую жалобу на AppleEpic хочет, чтобы ее снова разрешили в App Store после того, как Apple запустила ее прошлым летом.
Об авторе Гэвин Филлипс (Опубликовано 695 статей)Гэвин — младший редактор для Windows and Technology Explained, постоянный участник Really Useful Podcast и редактор дочернего сайта MakeUseOf, посвященного криптографии, Blocks Decoded.У него есть степень бакалавра (с отличием) в области современного письма с использованием методов цифрового искусства, разграбленных на холмах Девона, а также более десяти лет профессионального писательского опыта. Он любит много пить чая, настольные игры и футбол.
Больше От Гэвина ФиллипсаПодпишитесь на нашу рассылку новостей
Подпишитесь на нашу рассылку, чтобы получать технические советы, обзоры, бесплатные электронные книги и эксклюзивные предложения!
Еще один шаг…!
Подтвердите свой адрес электронной почты в только что отправленном вам электронном письме.

 Когда аккумулятор заряжается полностью, ток прекращает поступать. С помощью автоматического зарядного устройства зарядка аккумулятора происходит в течение четырёх-шести часов.
Когда аккумулятор заряжается полностью, ток прекращает поступать. С помощью автоматического зарядного устройства зарядка аккумулятора происходит в течение четырёх-шести часов.