Молярная масса этиленгликоля: Какую массу этиленгликоля получим. задача 3 параграф 22 химия 10 класс Рудзиис
ICSC 1568 — ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ
ICSC 1568 — ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ| ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ | ICSC: 1568 (Октябрь 2004) |
| CAS #: 110-71-4 |
| UN #: 2252 |
| EINECS #: 203-794-9 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Очень легко воспламеняется.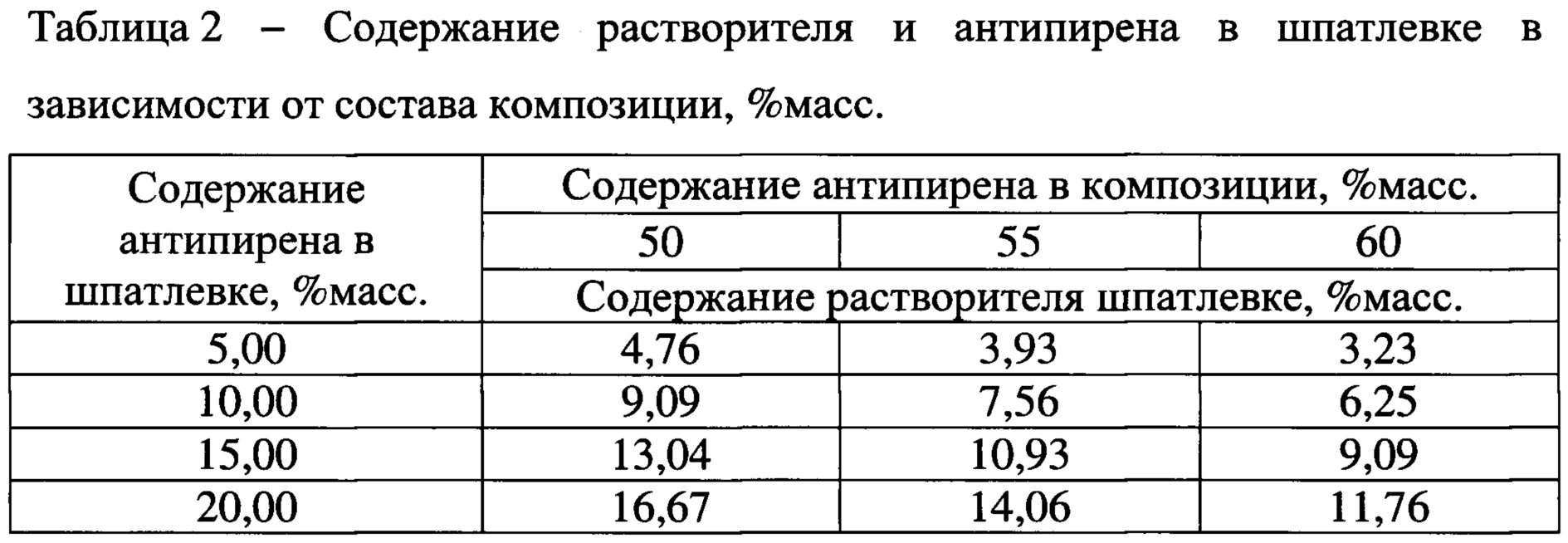 |
НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, вентиляция, взрывозащищенное электрическое оборудование и освещение. | Использовать распыленную воду, пену, порошок, двуокись углерода. В случае пожара: охлаждать бочки и т.д. распыляя воду. |
| См. ЭФФЕКТ ОТ ДЛИТЕЛЬНОГО ИЛИ ПОВТОРНОГО ВОЗДЕЙСТВИЯ. ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. | |
| Кожа | МОЖЕТ АБСОРБИРОВАТЬСЯ! | Защитные перчатки. Защитная одежда. |
Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Тошнота. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. |
| ЛИКВИДАЦИЯ УТЕЧЕК | |
|---|---|
Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе. Удалить все источники воспламенения. Вентилировать. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Удалить все источники воспламенения. Вентилировать. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Прохладное место. Обеспечить огнестойкость. Отдельно от сильных окислителей. | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ | ICSC: 1568 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C4H10O2 / CH3OCH2CH2OCH3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Перед дистилляцией следует проверить наличие перекисей и удалить их в случае обнаружения.
|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: F, T; R: 60-61-11-19-20; S: 53-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Формула Этиленгликоля структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C2H6O2
Химический состав Этиленгликоля
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 2 | 38,7% |
| H | Водород | 1,008 | 6 | 9,7% |
| O | Кислород | 2 | 51,6% |
Молекулярная масса: 62,068
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50 % в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров.
 Это второе основное применение;
Это второе основное применение; - Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.

- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1—2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему).
Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
Разница между этиленгликолем и диэтиленгликолем | Сравните разницу между похожими терминами — Наука
Разница между этиленгликолем и диэтиленгликолем — Наука
Ключевое различие — этиленгликоль и Диэтилен ГликольВ ключевое отличие между этиленгликолем и диэтиленгликолем заключается в том, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образована комбинацией двух молекул этиленгликоля через эфирную связь.
Этиленгликоль и диэтиленгликоль — это органические соединения, которые находят применение в производстве охлаждающих жидкостей для двигателей. У них есть тесно связанные структуры; диэтиленгликоль представляет собой комбинацию молекул этиленгликоля.
1. Обзор и основные отличия
2. Что такое этиленгликоль
3. Что такое диэтиленгликоль
4. Сходства между этиленгликолем и диэтиленгликолем.
5. Параллельное сравнение — этиленгликоль и диэтиленгликоль в табличной форме
6. Резюме
Что такое этиленгликоль?
Этиленгликоль — это спирт, имеющий химическую формулу C2ЧАС6О2. Название этого соединения по ИЮПАК: этан-1,2-диол. При комнатной температуре и давлении это бесцветная жидкость без запаха, сладкая на вкус и вязкая. Эта жидкость умеренно токсична. Молярная масса этиленгликоля 62 г / моль. Температура плавления этой жидкости составляет -12,9 ° C, а температура кипения — 197,3 ° C. Этиленгликоль смешивается с водой, поскольку имеет группы -ОН, способные образовывать водородные связи.
Есть два способа производства этиленгликоля; производство в промышленных масштабах и биологический путь производства этиленгликоля. В промышленном масштабе этиленгликоль получают из этилена. Этилен превращается в оксид этилена, который затем превращается в этиленгликоль посредством реакции между оксидом этилена и водой. Эта реакция катализируется кислотами или основаниями. Если реакция проводится в среде с нейтральным pH, тогда реакционная смесь должна быть снабжена тепловой энергией. Биологический путь производства этиленгликоля заключается в разложении полиэтилена кишечными бактериями гусеницы восковой моли.
Что такое диэтиленгликоль?
Диэтиленгликоль — это органическое соединение, имеющее химическую формулу C4ЧАС10О3. При комнатной температуре это жидкость без цвета и запаха. Однако он гигроскопичен и ядовит. Имеет сладкий вкус. Диэтиленгликоль смешивается с водой и спиртами, так как он способен образовывать водородные связи. Молярная масса этого соединения 106,12 г / моль. Температура плавления диэтиленгликоля составляет -10,45 ° C, а температура кипения составляет 245 ° C.
Молярная масса этого соединения 106,12 г / моль. Температура плавления диэтиленгликоля составляет -10,45 ° C, а температура кипения составляет 245 ° C.
Наиболее распространенный путь производства диэтиленгликоля — частичный гидролиз этиленоксида. этилен превращается в оксид этилена; таким образом, оксид этилена является промежуточным продуктом. В результате реакции частичного гидролиза образуется диэтиленгликоль путем объединения двух молекул этиленгликоля через эфирную связь.
В чем сходство этиленгликоля и диэтиленгликоля?
- И этиленгликоль, и диэтиленгликоль являются спиртовыми соединениями.
- Оба способны образовывать водородные связи.
- Оба являются бесцветными жидкостями при комнатной температуре.
В чем разница между этиленгликолем и диэтиленгликолем?
Этиленгликоль против диэтиленгликоля | |
Этиленгликоль — это спирт, имеющий химическую формулу C2ЧАС6О2. | Диэтиленгликоль — это органическое соединение, имеющее химическую формулу C4ЧАС10О3. |
| Молярная масса | |
| Молярная масса этиленгликоля 62 г / моль. | Молярная масса диэтиленгликоля 106,12 г / моль. |
| Молекулярная структура | |
| Этиленгликоль — это отдельная молекула, производная от окиси этилена. | Диэтиленгликоль представляет собой комбинацию двух молекул этиленгликоля через эфирную связь. |
| Эфирная связь | |
| В этиленгликоле эфирная связь отсутствует. | Эфирная связь связывает две молекулы этиленгликоля. |
| Температура плавления и кипения диэтилена | |
| Температура плавления этиленгликоля составляет -12,9 ° C, а температура кипения составляет 197,3 ° C. | Температура плавления диэтиленгликоля составляет -10,45 ° C, а температура кипения составляет 245 ° C. |
| Производство | |
| Сначала этилен превращается в оксид этилена, который, в свою очередь, превращается в этиленгликоль при взаимодействии с водой. | Диэтиленгликоль получают путем частичного гидролиза этиленоксида. |
Резюме —
Этиленгликоль против Диэтилен ГликольИ этиленгликоль, и диэтиленгликоль производятся из одного и того же исходного материала; этилен. Разница между этиленгликолем и диэтиленгликолем заключается в том, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образована комбинацией двух молекул этиленгликоля через эфирную связь.
Разница между этиленгликолем и диэтиленгликолем (Наука и природа)
Ключевая разница — этиленгликоль против Diethylene гликоль ключевое отличие между этиленгликолем и диэтиленгликолем является то, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образуется путем сочетания двух молекул этиленгликоля через эфирную связь.
Этиленгликоль и диэтиленгликоль являются органическими соединениями, которые используются в производстве охлаждающих жидкостей для двигателей. Они имеют тесно связанные структуры; диэтиленгликоль представляет собой комбинацию молекул этиленгликоля.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое этиленгликоль
3. Что такое диэтиленгликоль
4. Сходство между этиленгликолем и диэтиленгликолем
5. Сравнение бок о бок — этиленгликоль и диэтиленгликоль в табличной форме
6. Резюме
Что такое этиленгликоль?
Этиленгликоль представляет собой спирт, имеющий химическую формулу С2ЧАС6О2. Название IUPAC этого соединения этан-1,2-диол. При комнатной температуре и давлении это бесцветная жидкость без запаха, сладкая на вкус и вязкая. Эта жидкость умеренно токсична. Молярная масса этиленгликоля составляет 62 г / моль. Температура плавления этой жидкости составляет -12,9 ° С, а температура кипения составляет 197,3 ° С. Этиленгликоль смешивается с водой, поскольку он имеет -ОН группы, способные образовывать водородные связи.
Этиленгликоль смешивается с водой, поскольку он имеет -ОН группы, способные образовывать водородные связи.
Рисунок 01: Химическая структура этиленгликоля
Есть два способа производства этиленгликоля; промышленное производство и биологический маршрут производства этиленгликоля. В промышленном производстве этиленгликоль производится из этилена. Этилен превращается в этиленоксид, который затем превращается в этиленгликоль по реакции между этиленоксидом и водой. Эта реакция катализируется кислотами или основаниями. Если реакция проводится в среде с нейтральным рН, то реакционная смесь должна быть снабжена тепловой энергией. Биологический путь производства этиленгликоля заключается в разложении полиэтилена кишечными бактериями гусеницы восковой моли..
Что такое диэтиленгликоль?
Диэтиленгликоль представляет собой органическое соединение, имеющее химическую формулу C4ЧАС10О3. При комнатной температуре это жидкость без цвета и запаха. Однако он гигроскопичен и ядовит. Имеет сладкий вкус. Диэтиленгликоль смешивается с водой и спиртами, потому что он способен образовывать водородные связи. Молярная масса этого соединения составляет 106,12 г / моль. Температура плавления диэтиленгликоля составляет -10,45 ° С, а температура кипения составляет 245 ° С..
Однако он гигроскопичен и ядовит. Имеет сладкий вкус. Диэтиленгликоль смешивается с водой и спиртами, потому что он способен образовывать водородные связи. Молярная масса этого соединения составляет 106,12 г / моль. Температура плавления диэтиленгликоля составляет -10,45 ° С, а температура кипения составляет 245 ° С..
Рисунок 02: Химическая структура диэтиленгликоля
Наиболее распространенным путем производства диэтиленгликоля является частичный гидролиз этиленоксида. этилен превращается в этиленоксид; таким образом, этиленоксид является промежуточным соединением. Реакция частичного гидролиза дает диэтиленгликоль путем сочетания двух молекул этиленгликоля через эфирную связь.
Каковы сходства между этиленгликолем и диэтиленгликолем?
- И этиленгликоль, и диэтиленгликоль являются спиртовыми соединениями..
- Оба способны образовывать водородные связи.
- Обе бесцветные жидкости при комнатной температуре.
В чем разница между этиленгликолем и диэтиленгликолем?
Этиленгликоль против диэтиленгликоля | |
Этиленгликоль представляет собой спирт, имеющий химическую формулу С2ЧАС6О2. | Диэтиленгликоль представляет собой органическое соединение, имеющее химическую формулу C4ЧАС10О3. |
| Молярная масса | |
| Молярная масса этиленгликоля составляет 62 г / моль. | Молярная масса диэтиленгликоля составляет 106,12 г / моль. |
| Молекулярная структура | |
| Этиленгликоль представляет собой отдельную молекулу, полученную из этиленоксида. | Диэтиленгликоль представляет собой комбинацию двух молекул этиленгликоля через эфирную связь. |
| Эфир Бонд | |
| В этиленгликоле нет эфирной связи. | Эфирная связь связывает две молекулы этиленгликоля. |
| Точка плавления и точка кипенияДиэтилен | |
| Температура плавления этиленгликоля составляет -12,9 ° С, а температура кипения составляет 197,3 ° С.. | Температура плавления диэтиленгликоля составляет -10,45 ° С, а температура кипения составляет 245 ° С. . . |
| производство | |
| Сначала этилен превращается в этиленоксид, который, в свою очередь, превращается в этиленгликоль при взаимодействии с водой.. | Диэтиленгликоль получают частичным гидролизом этиленоксида. |
Резюме —
Этиленгликоль против Diethylene гликольКак этиленгликоль, так и диэтиленгликоль получают из одного и того же исходного материала; этилен. Разница между этиленгликолем и диэтиленгликолем заключается в том, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образуется путем сочетания двух молекул этиленгликоля через эфирную связь..
Ссылка:
1. «Диэтиленгликоль». Википедия, Фонд Викимедиа, 3 апреля 2018. Доступно здесь
2. «Этиленгликоль». Википедия, Фонд Викимедиа, 3 апреля 2018. Доступно здесь
Изображение предоставлено:
1. «Химическая структура этиленгликоля» (CC BY-SA 3. 0) через Commons Wikimedia
0) через Commons Wikimedia
2. «Структура диэтиленгликоля» by Yikrazuul — собственная работа, (общественное достояние) через Commons Wikimedia
Молекулярная масса этиленгликоля
Молярная масса HOCh3Ch3OH = 62,06784 г/моль
Перевести граммы этиленгликоля в моли или моли этиленгликоля в граммы
Расчет молекулярной массы:
1,00794 + 15,9994 + 12,0107 + 1,00794*2 + 12,0107 + 1,00794*2 + 15,9994 + 1,00794
| Элемент | Символ | Атомная масса | Количество атомов | Процент по массе |
| Водород | Х | 1.00794 | 6 | 9,744% |
| Углерод | С | 12. 0107 0107 | 2 | 38,702% |
| Кислород | О | 15,9994 | 2 | 51,555% |
Обратите внимание, что все формулы вводятся с учетом регистра.
Вы имели в виду найти молекулярную массу одной из этих подобных формул?
HOCh3Ch3OH
HoCh3Ch3OH
В химии формульный вес представляет собой величину, вычисляемую путем умножения атомного веса (в атомных единицах массы) каждого элемента в химической формуле на число атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные массы и вычислить молекулярную массу вещества.
Нахождение молярной массы начинается с граммов на моль (г/моль). При расчете молекулярной массы химического соединения она сообщает нам, сколько граммов содержится в одном моле этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Если формула, используемая при расчете молекулярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно рассчитать, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Массы формулособенно полезны при определении относительных масс реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные из химического уравнения, иногда называют весами уравнения.
Обычный запрос на этом сайте — конвертировать граммы в моли.Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Атомные веса, используемые на этом сайте, получены из NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как можно рассчитать молярную массу (среднюю молекулярную массу), основанную на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Мы используем самые распространенные изотопы. Вот как можно рассчитать молярную массу (среднюю молекулярную массу), основанную на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Каковы молярность, моляльность и молярная доля этиленгликоля («C»_2″H»_6″O»_2) в водном растворе, содержащем 40 % по массе растворенного вещества? Плотность раствора составляет «1,06 г/мл».
#[«C»_2″H»_6″O»_2] = «6,83 М»#
#m_(«C»_2″H»_6″O»_2) = «10,741 моль/кг»#
#chi_(«C»_2″H»_6″O»_2) = 0.1621#
Читайте дальше, чтобы узнать, как это было сделано.
Это всего лишь упражнение по изменению границ того, что у вас есть, и расчету различных типов концентраций.
Раствор водный, поэтому растворителем является вода, поэтому плотность близка к #»1 г/мл»#.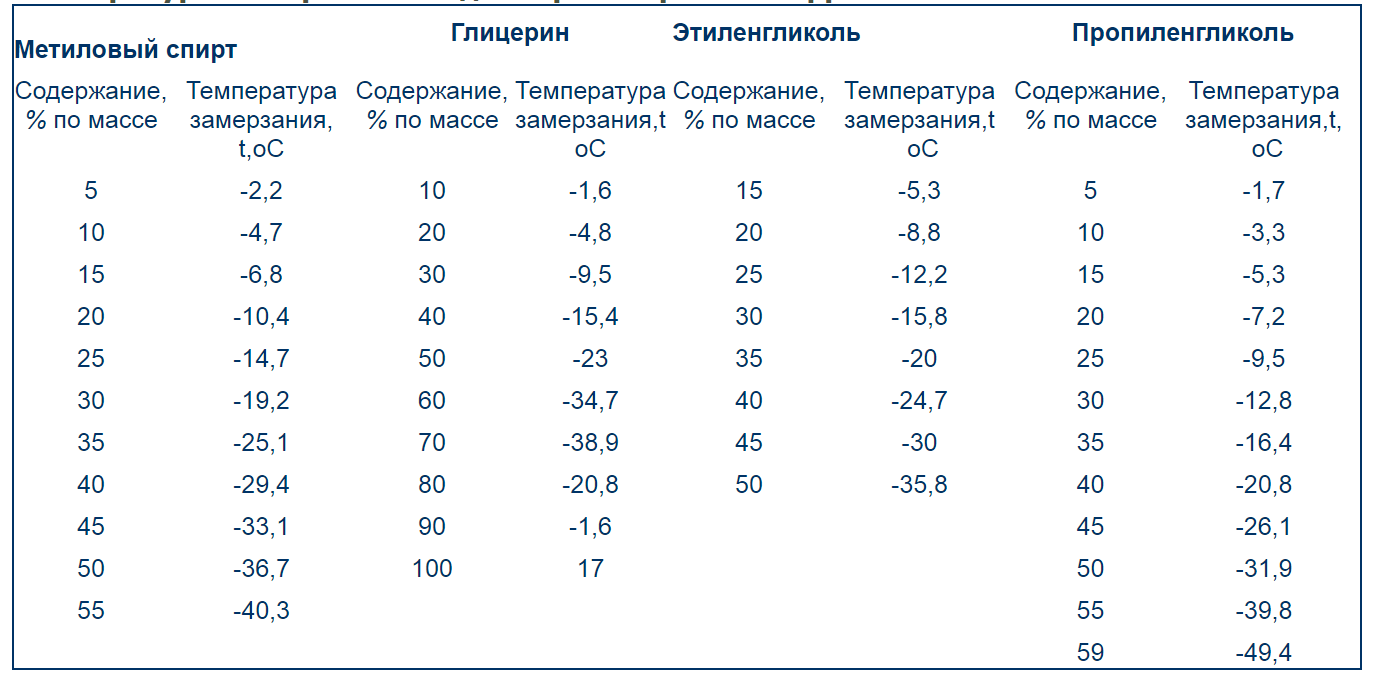 Зная процент по массе, который равен:
Зная процент по массе, который равен:
#»% вес/вес» = «масса растворенного вещества»/»масса раствора»xx100%#
мы можем принять #»1000 г»# растворителя для удобства (учитывая, что моляльность указана на #»кг»# растворителя), чтобы получить:
#»40% вес/вес» => 0.40 = «x г растворенного вещества»/»(1000 + x) г раствора»#
Решая #x#, мы можем получить массу растворенного вещества:
#0,40(1000 + х) = х#
#=> 400 + 0,40х = х#
#=> 400 = (1 — 0,40)x#
#=> x = 400/(1 — 0,40) = 666,бар(66)##»г растворенного вещества»#
Следовательно, мы можем получить моль растворенного вещества и моль растворителя:
#цвет(зеленый)(n_»раствор») = (666,бар(66) «г растворенного вещества»)/(2xx12,011 + 6xx1,0079 + 2xx15,99″9 г/моль») = цвет(зеленый) («10.741 моль этиленгликоля»)#
#color(green)(n_»растворитель») = («1000 г растворителя»)/(«18,015 г/моль») = color(green)(«55,509 моль воды»)#
Отсюда у нас есть вся информация, необходимая для расчета концентрации.
МОЛЯРНОСТЬ
Для молярности:
#color(blue)([«C»_2″H»_6″O»_2]) = «mols solute»/»L раствор»#
#= «10,741 моль растворенного вещества»/(((1000 + 666,бар(66)) отменить»г раствор» xx отменить»мл»/(1,06 отменить»г») xx «л»/(1000 отменить»мл») )#
#=##цвет(синий)(«6.83 м»)#
МОЛАЛЬНОСТЬ
Моляльность была упрощена, потому что мы выбрали массу растворителя как #»1000 г»#, т.е. #»1 кг»#:
#color(blue)(m_(«C»_2″H»_6″O»_2)) = «моль растворенного вещества»/»кг растворителя»#
#= «10,741 моль растворенного вещества»/»1 кг воды»#
#=##цвет(синий)(«10,741 моль/кг»)#
Естественно, мы выбрали #»1000 г»# воды, чтобы не ошибиться в этом вычислении, если моляры были правильными (деление на 1 легко сделать правильно).
МОЛЬНАЯ ДОЛЯ
Молярная доля:
#color(blue)(chi_(«C»_2″H»_6″O»_2)) = n_»раствор»/(n_»раствор» + n_»растворитель»)#
#= «10,741 моль растворенного вещества»/(«10,741 моль растворенного вещества» + «55,509 моль воды»)#
#=##цвет(синий)(0.
1621)#
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
| 1 | 107-21-1 | Этиленгликоль | C2H6O2 | 62.0837 | -13 ℃ | смешиваться | ||||
| 2 111-46-6 | диэтиленгликоль | C4h20O3 106.12 | -10 ℃ | |||||||
| 3 112-27- 6 | Триэтиленгликоль | C6h24O4 150,173 | -7 ℃ | РАСТВОРИМЫЕ | ||||||
| 4 2615-15-8 | hexaethylene гликоля | C14h40O2 230,387 | 5-7 ℃ | |||||||
| 5 | 112-60-7 | Тетраэтиленгликоль | C8h28O5 | 194. 225 225 | -4.1 ℃ | Разъявичный | 2 | 6 | 25322-68-3 | Poly (этиленгликоль) | 3 3-65 ℃ | 370034 | 2 | 7 | 111-55-7 | Этиленгликоль диацетат | C6H20O4 | C6H20O4 | 146.141 | -41 | -41 ℃ | 160 г / л (20 ℃) | 160034
Глава 1.7: Крот и молярная массаКрот В теории Дальтона каждое химическое соединение имеет определенную комбинацию атомов и что отношения чисел атомов присутствующих элементов обычно представляют собой небольшие целые числа. Мы также описали закон кратных пропорций , который утверждает, что отношения масс элементов, образующих ряд соединений, являются небольшими целыми числами.Проблема для Дальтона и других ранних химиков состояла в том, чтобы обнаружить количественную связь между числом атомов в химическом веществе и его массой. Поскольку массы отдельных атомов настолько ничтожны (порядка 10 90 659 -23 90 660 г/атом), химики не измеряют массу отдельных атомов или молекул. В лаборатории, например, массы соединений и элементов, используемых химиками, обычно колеблются от миллиграммов до граммов, тогда как в промышленности химические вещества покупаются и продаются в килограммах и тоннах. Многие знакомые предметы продаются в числовых количествах с необычными названиями. Например, банки с газировкой продаются в упаковках по шесть штук, яйца продаются дюжинами (12), а карандаши часто продаются оптом (12 дюжин, или 144). Листы бумаги для принтера упакованы в пачки по 500 штук, что кажется большим количеством. Однако атомы настолько малы, что даже 500 атомов слишком малы, чтобы их можно было увидеть или измерить с помощью наиболее распространенных методов. моль определяется как количество вещества, которое содержит число атомов углерода ровно 12 г изотопно чистого углерода-12. Согласно самым последним экспериментальным измерениям, эта масса углерода-12 содержит 6,022142 × 10 23 атомов, но для большинства целей 6,022 × 10 23 обеспечивает достаточное количество значащих цифр. Так же, как 1 моль атомов содержит 6,022 × 10 23 атомов, 1 моль яйца содержит 6.022 × 10 23 яиц. Число в моле называется числом Авогадро: 6,022142 x 10 23 , в честь итальянского ученого 19-го века, который первым предложил, как измерить количество молекул в газе. Поскольку массу газа также можно измерить на чувствительных весах, знание количества молекул и их общей массы позволяет нам просто определить массу отдельной молекулы в граммах. Крот обеспечивает мост между атомным миром (аму) и лабораторией (граммы).Он позволяет определить количество молекул или атомов путем их взвешивания. Числовое значение числа Авогадро, обычно записываемое как Нет, является следствием произвольного значения одного килограмма, блока металла Pt-Ir, называемого международным прототипом килограмма, и выбора эталона для шкалы единиц атомной массы, одного атома. углерода-12. Моль C-12 по определению весит ровно 12 г, а число Авогадро определяется путем подсчета количества атомов. Это не так просто. Число Авогадро — фундаментальная константа, которая определяется наименее точно. Определение моля, то есть решение основывать его на 12 г углерода-12, является произвольным, но оно было принято после некоторого обсуждения между химиками и физиками, спорящими о том, следует ли использовать встречающийся в природе углерод, смесь С-12. 12 и С-13, или водород. Важным моментом является то, что 90 653 1 моль углерода — или чего-либо еще, будь то атомы, компакт-диски или дома — всегда имеет одно и то же число объектов: 6,022 × 10 90 654 90 659 90 653 23 90 654 90 660 90 653 . В следующем видео проф.Стив Бун показывает, как можно использовать гипотезу Авогадро для измерения молекулярных масс He, N 2 и CO2. Следуйте и запишите измерения, чтобы получить относительные массы. Когда мы рассматриваем поведение газов в блоке 5, мы можем использовать данные для расчета молекулярной массы каждого газа. Этот метод был до изобретения масс-спектрометра лучшим способом измерения молекулярной массы молекул газа
Обратите внимание на шаблонУ одного крота всегда одинаковое количество предметов: 6.022 × 10 23 . Чтобы оценить величину числа Авогадро, возьмем моль пенни. Сложенный вертикально моль пенни будет иметь высоту 4,5 × 10 90 659 17 90 660 миль, или почти в шесть раз больше диаметра галактики Млечный Путь. Если бы моль пенни распределить поровну между всем населением Земли, каждый человек получил бы более одного триллиона долларов. Ясно, что моль настолько велика, что ее можно использовать только для измерения очень маленьких объектов, таких как атомы. Концепция моля позволяет нам подсчитать определенное количество отдельных атомов и молекул путем взвешивания измеримых количеств элементов и соединений. Чтобы получить 1 моль атомов углерода-12, мы должны взвесить 12 г изотопно чистого углерода-12. Однако, поскольку каждый элемент имеет разную атомную массу, моль каждого элемента имеет разную массу, даже если он содержит одинаковое количество атомов (6,022 × 10 23 ). Это аналогично тому, что дюжина очень больших яиц весит больше, чем дюжина маленьких яиц, или что общий вес 50 взрослых людей больше, чем общий вес 50 детей.Из-за способа определения моля для каждого элемента количество граммов в моле совпадает с количеством атомных единиц массы в атомной массе элемента. Например, масса 1 моля магния (атомная масса = 24,305 а.е.м.) равна 24,305 г. Поскольку атомная масса магния (24,305 а.е.м.) чуть более чем в два раза превышает массу атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем в два раза превышает массу 1 моля углерода. Гиперразветвленные сополимеры полиэтиленгликоля: абсолютные значения молярной массы, свойства в разбавленном растворе и гидродинамическая гомология | Интернет-исследования в области здравоохранения и окружающей среды (HERO)ID ГЕРОЯ 4424980 Тип ссылки Журнальная статья Заголовок Сверхразветвленные сополимеры полиэтиленгликоля: абсолютные значения молярной массы, свойства в разбавленном растворе и гидродинамическая гомология Авторы) Перевязко, И; Зайверт, Ян; Шемер, М; Фрей, Х; Шуберт, США; Павлов, ГМ Год 2015 Рецензируется ли эксперт? да Журнал Макромолекулы Объем 48 Проблема 16 Номера страниц 5887-5898 DOI 10. 1021/acs.macromol.5601020 1021/acs.macromol.5601020Идентификатор Web of Science WOS:000360324400051Абстрактный Гиперразветвленные сополимеры полиэтиленгликоля были синтезированы случайной анионной многоразветвленной сополимеризацией этиленоксида с раскрытием цикла с глицидом в качестве агента разветвления, приводящей к структуре полиэтиленгликоля с глицериновыми точками разветвления.Расширение доступного диапазона молярных масс за счет новых стратегий синтеза, ограниченная степень контроля над степенью полимеризации была достигнута путем изменения растворителя в этой сополимеризации. Как правило, характеристика абсолютной молярной массы гиперразветвленных полимеров все еще представляет собой нерешенную проблему. Серия сверхразветвленных сополимеров поли(этиленгликоль)-со-(глицерин) (hbPEG) широкого диапазона молярных масс (1400 < M < 1 700 000 г моль(-1)) степень разветвления (DB) = 0 .Методами молекулярной гидродинамики как в воде, так и в диметилформамиде исследованы 04-0,54 и умеренная полидисперсность (M-w/M-n), близкая к 2,1 +/0,2. Модификация антимикробного пептида низкомолекулярным поли(этиленгликолем) | Журнал биохимииПолучить помощь с доступомИнституциональный доступ Доступ к контенту с ограниченным доступом в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Доступ на основе IPКак правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с проверкой подлинности IP. Войдите через свое учреждениеВыберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору. Войти с помощью читательского билетаВведите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю. Члены обществаМногие общества предлагают своим членам доступ к своим журналам с помощью единого входа между веб-сайтом общества и Oxford Academic. Из журнала Oxford Academic:
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество. Некоторые общества используют личные аккаунты Oxford Academic для своих членов. Личный кабинетЛичную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок. Некоторые общества используют личные учетные записи Oxford Academic для предоставления доступа своим членам. Институциональная администрация Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью.
Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. Просмотр ваших зарегистрированных учетных записейВы можете одновременно войти в свою личную учетную запись и учетную запись своего учреждения.Щелкните значок учетной записи в левом верхнем углу, чтобы просмотреть учетные записи, в которые вы вошли, и получить доступ к функциям управления учетной записью. Выполнен вход, но нет доступа к содержимомуOxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю. . |



 Это второе основное применение;
Это второе основное применение;
 1621)#
1621)# Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. 227
227 )
) 93
93 Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в химической реакции, химикам совершенно необходимо знать, сколько атомов или молекул содержится в измеряемой в лаборатории величине — заданной массе образца. Единицей, обеспечивающей эту связь, является моль (моль). Количество вещества, которое содержит то же количество единиц (например, атомов или молекул), что и число атомов углерода ровно в 12 г изотопно чистого углерода-12., от латинского моль , что означает «кучу» или «кучу». куча» (, а не от маленького подземного животного!).
Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в химической реакции, химикам совершенно необходимо знать, сколько атомов или молекул содержится в измеряемой в лаборатории величине — заданной массе образца. Единицей, обеспечивающей эту связь, является моль (моль). Количество вещества, которое содержит то же количество единиц (например, атомов или молекул), что и число атомов углерода ровно в 12 г изотопно чистого углерода-12., от латинского моль , что означает «кучу» или «кучу». куча» (, а не от маленького подземного животного!). Любая легко измеримая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица.Для этой цели используется моль.
Любая легко измеримая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица.Для этой цели используется моль.

 -12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4.002602 а.е.м.) составляет 4,002602 г, что составляет примерно одну треть массы 1 моля углерода-12. Используя понятие моля, мы можем теперь переформулировать теорию Дальтона: 1 моль соединения образуется путем соединения элементов в количествах, молярные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
-12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4.002602 а.е.м.) составляет 4,002602 г, что составляет примерно одну треть массы 1 моля углерода-12. Используя понятие моля, мы можем теперь переформулировать теорию Дальтона: 1 моль соединения образуется путем соединения элементов в количествах, молярные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода. Аналитическое ультрацентрифугирование, измерения характеристической вязкости, поступательной диффузии и ЭХ были объединены. Молярные массы hbPEG оценивали путем сравнения скорости седиментации и коэффициентов поступательной диффузии, т.е. применяя зависимость Сведберга. Показано, что использование линейного ПЭГ для калибровки ЭХ приводит к значительно заниженным значениям молярных масс hbPEG.Самые большие образцы hbPEG имели гидродинамический радиус около 14 нм в водном растворе. Полученные скейлинговые соотношения Куна-Марка-Хаувинка-Сакурады показывают линейные тренды во всем диапазоне молярных масс. Обнаруженные скейлинговые индексы практически соответствуют гомологическому ряду, характеризующемуся прямой пропорциональностью между молярной массой и объемом макромолекул, составляющих этот ряд. Обсуждено влияние разветвления на размеры молекул и гидродинамические характеристики, оценены соответствующие коэффициенты сжатия.
Аналитическое ультрацентрифугирование, измерения характеристической вязкости, поступательной диффузии и ЭХ были объединены. Молярные массы hbPEG оценивали путем сравнения скорости седиментации и коэффициентов поступательной диффузии, т.е. применяя зависимость Сведберга. Показано, что использование линейного ПЭГ для калибровки ЭХ приводит к значительно заниженным значениям молярных масс hbPEG.Самые большие образцы hbPEG имели гидродинамический радиус около 14 нм в водном растворе. Полученные скейлинговые соотношения Куна-Марка-Хаувинка-Сакурады показывают линейные тренды во всем диапазоне молярных масс. Обнаруженные скейлинговые индексы практически соответствуют гомологическому ряду, характеризующемуся прямой пропорциональностью между молярной массой и объемом макромолекул, составляющих этот ряд. Обсуждено влияние разветвления на размеры молекул и гидродинамические характеристики, оценены соответствующие коэффициенты сжатия. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту следующими способами:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту следующими способами: Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.
 д.
д.