Плотность этиленгликоля при различных температурах: Теплофизические свойства водного раствора этиленгликоля, концентрация и температура замерзания, теплопроводность и теплоемкость, кинематическая и динамическая вязкость
Теплофизические свойства водного раствора этиленгликоля, концентрация и температура замерзания, теплопроводность и теплоемкость, кинематическая и динамическая вязкость
Вода, как теплоноситель, обладает идеальными свойствами — высокой теплоемкостью и теплопроводностью, практически нулевой вязкостью, незначительным тепловым расширением, практически неограниченными природными ресурсами и самое важное — повсеместной доступностью, практически нулевой стоимостью и абсолютной экологической безопасностью. И единственным. непреодолимым недостатком — низкой (нулевой) температурой замерзания и при этом замерзая расширяется, образуя очень твердую и прочную кристаллическую решетку, давление которой не способны выдержать никакие инженерные устройства, механизмы и системы.
Производства пищевых продуктов и фармпроизводства, системы промышленного кондиционирования требуют поддержания в помещениях необходимой температуры, что невозможно обеспечить без применения незамерзающих (низкозамерзающих) жидкостей — антифризов, хладагентов, теплоносителей. В качестве незамерзающей жидкости в последние годы широко применяются водные растворы гликолей — этиленгликоля и пропиленгликоля.
В качестве незамерзающей жидкости в последние годы широко применяются водные растворы гликолей — этиленгликоля и пропиленгликоля.
Поподробнее рассмотрим теплофизические свойства и характеристики водного раствора этиленгликоля. Водный раствор этиленгликоля обладает:
- 1) Более высокой плотностью по сравнению с водой как теплоносителем, на 8%-9% и плотность раствора повышается с увеличением концентрации этиленгликоля.
- 2) Теплоемкость и теплопроводность уменьшаются ( по сравнению с водой) в пределах до 20% с ростом концентрации этиленгликоля и снижением рабочей температуры в минусовой зоне.
- 3) Кинематическая и динамическая вязкость выше чем у воды 2-3 раза в зоне положительных температур и возрастают в 8-10 раз при повышении концентрации до практических предельных 65% и соответственно понижении температуры кристаллизации до минус -65°C.
Повышенная вязкость водного раствора этиленгликоля в зоне отрицательных рабочих температур приводит к значительному возрастании гидравлических потерь на трение в трубопроводах и на преодоление гидравлических сопротивлений во всех узлах системы охлаждения и промышленного кондиционирования ( см.
Все эти факторы, как следствие, приведут к особым исключительным ситуациям (условиям) при эксплуатации инженерных систем в различных климатических условиях. И их следует учесть при проектировании и эксплуатации систем отопления и промышленного кондиционирования.
Табл. 1. Теплофизические свойства 20% водного раствора этиленгликоля, температура кристаллизации минус — 10°C
| Температура раствора, t°C | Плотность, кг/м**3 | Теплоемкость, Ср, кДж/(кг*К) | Теплопроводность, Вт/(м*К) | Динамическая вязкость, *10-3[Н*с/м**2] | Кинематическая вязкость, *10-6[(м**2/с] |
| -10°C | 1038 | 3,85 | 0,498 | 5,19 | 5,0 |
| 0°C | 1036 | 3,87 | 0,500 | 3,11 | 3,0 |
| 20°C | 1030 | 3,90 | 0,512 | 1,65 | 1,6 |
| 40°C | 1022 | 3,93 | 0,521 | 1,02 | 1,0 |
| 60°C | 1014 | 3,96 | 0,531 | 0,71 | 0,7 |
| 80°C | 1006 | 3,99 | 0,540 | 0,523 | 0,52 |
| 100°C | 997 | 4,02 | 0,550 | 0,409 | 0,41 |
Табл.
| Температура раствора, t°C | Плотность, кг/м**3 | Теплоемкость, Ср, кДж/(кг*К) | Теплопроводность, Вт/(м*К) | Динамическая вязкость, *10-3[Н*с/м**2] | Кинематическая вязкость, *10-6[(м**2/с] |
| -20°C | 1069 | 3,51 | 0,462 | 11,76 | 11,0 |
| 0°C | 1063 | 3,56 | 0,466 | 4,89 | 4,6 |
| 20°C | 1055 | 3,62 | 0,470 | 2,32 | 2,2 |
| 40°C | 1044 | 3,68 | 0,473 | 1,57 | 1,5 |
| 60°C | 1033 | 3,73 | 0,475 | 1,01 | 0,98 |
| 80°C | 1022 | 3,78 | 0,478 | 0,695 | 0,68 |
| 100°C | 1010 | 3,84 | 0,480 | 0,515 | 0,51 |
Табл. 3. Теплофизические свойства 54% водного раствора этиленгликоля, температура кристаллизации минус — 40°C
3. Теплофизические свойства 54% водного раствора этиленгликоля, температура кристаллизации минус — 40°C
| Температура раствора, t°C | Плотность, кг/м**3 | Теплоемкость, Ср, кДж/(кг*К) | Теплопроводность, Вт/(м*К) | Динамическая вязкость, *10-3[Н*с/м**2] | Кинематическая вязкость, *10-6[(м**2/с] |
| -40°C | 1108 | 3,04 | 0,416 | 110,8 | 100 |
| -20°C | 1100 | 3,11 | 0,409 | 27,50 | 25 |
| -10°C | 1096 | 3,15 | 0,407 | 17,56 | 18,5 |
| 0°C | 1092 | 3,19 | 0,405 | 10,37 | 9,5 |
| 20°C | 1082 | 3,26 | 0,402 | 4,87 | 4,5 |
| 40°C | 1069 | 3,34 | 0,398 | 2,57 | 2,4 |
| 60°C | 1057 | 3,41 | 0,394 | 1,59 | 1,5 |
| 80°C | 1045 | 3,49 | 0,390 | 1,05 | 1,0 |
| 100°C | 1032 | 3,56 | 0,385 | 0,722 | 0,7 |
Вернуться в начало ОБЗОРА >>
Мы за взаимовыгодное сотрудничество
Плотность теплоносителя
ноябрь, 2017г.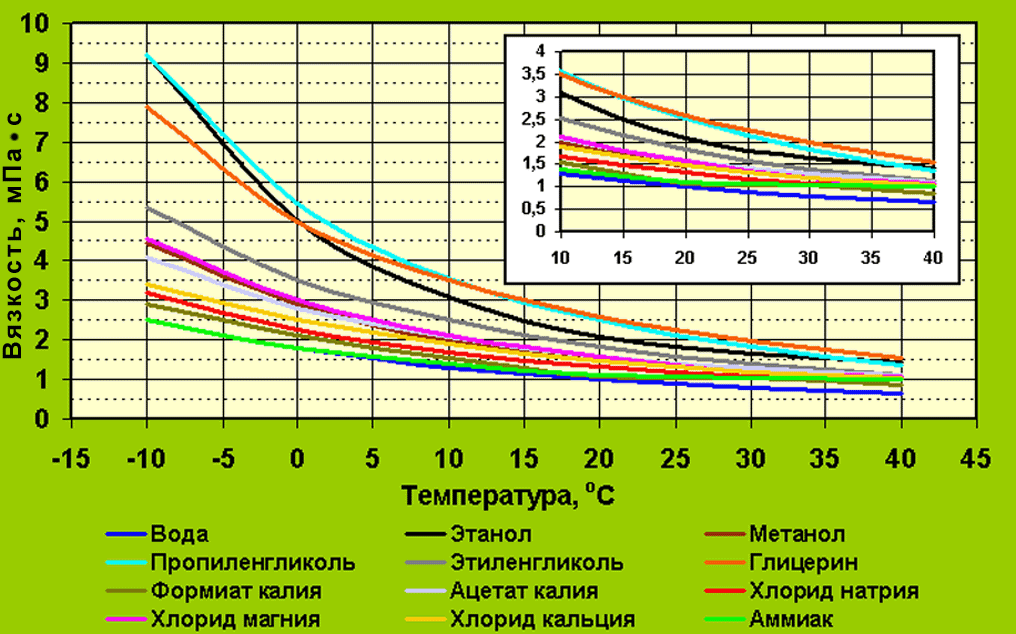
ЧТО ТАКОЕ ПЛОТНОСТЬ
Плотность — одна из основных характеристик теплоносителя (хладоносителя, антифриза).
Плотность равна отношению массы тела к его объёму.
В физике плотность обозначают греческой буквой ρ (ро).
Плотность = масса/объём ρ=m/V, где m — масса, V — объём.
При измерении плотности жидкости используют единицу плотности г/см3 ( кг/м3).
Очевидно, что плотность жидкости зависит от ее температуры: при понижении температуры объем жидкости уменьшается, следовательно, ее плотность – повышается. И наоборот.
В Украине принято оперировать плотностями жидкостей при +200С.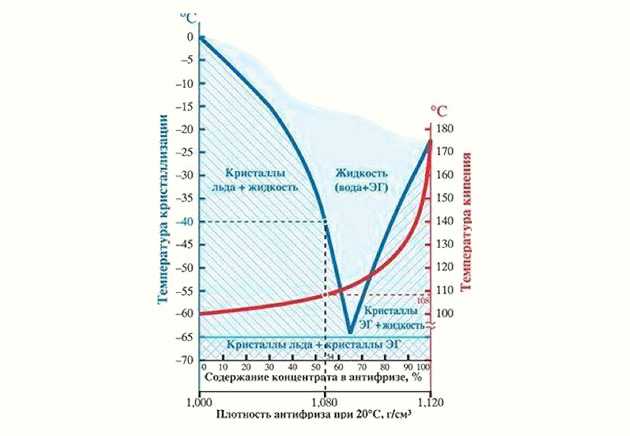
Плотности воды и гликолей при +200С, г/см3 (Краткий справочник по химии):
— вода – 1,00
— пропиленгликоль – 1,04
— этиленгликоль – 1,11
— глицерин – 1,26
Очевидно, что плотность водных растворов гликолей больше 1,00 г/см3 и тем выше, чем больше концентрация гликоля. Ингибиторы коррозии и другие функциональные добавки еще больше повышают плотность теплоносителя.
ЧЕМ ИЗМЕРЯЮТ ПЛОТНОСТЬ
фото 1
В современных лабораториях плотность жидкости может измеряться высокоточным электронным плотномером. Однако наиболее простой и доступный прибор – ареометр (фото 1).
фото 2
Ареометр представляет собой стеклянную трубку, нижняя часть которой заполнена дробью. На верхней узкой части нанесена шкала, которая проградуирована в значениях плотности.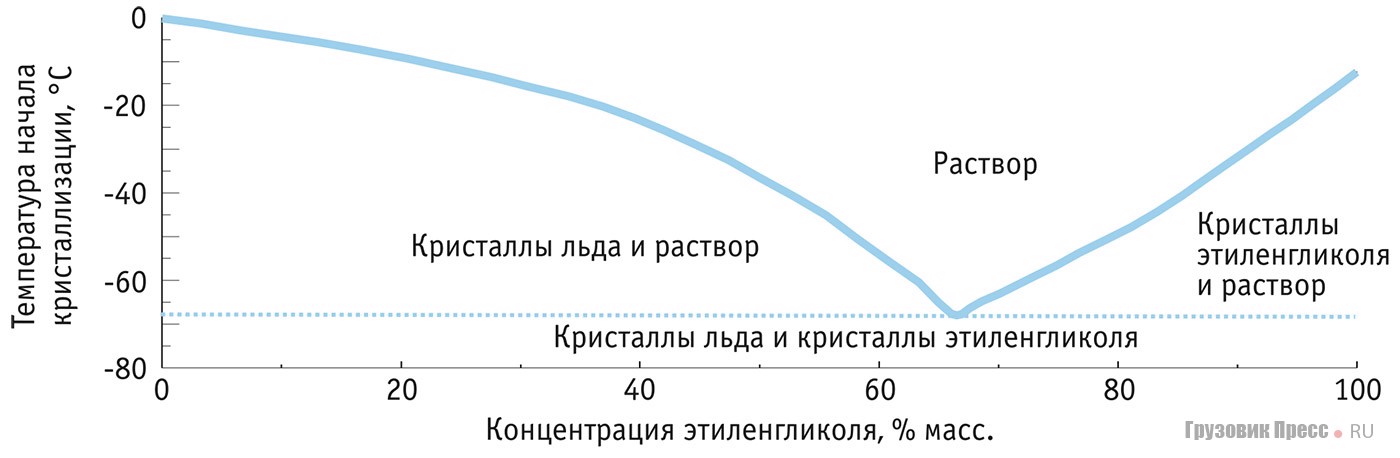 Для измерения плотности жидкости ареометр помещается в сосуд с этой жидкостью так, чтобы он свободно плавал в нем. Значения плотности считываются по шкале ареометра, по нижнему краю мениска жидкости (фото 2).
Для измерения плотности жидкости ареометр помещается в сосуд с этой жидкостью так, чтобы он свободно плавал в нем. Значения плотности считываются по шкале ареометра, по нижнему краю мениска жидкости (фото 2).
МОЖНО ЛИ ПО ПЛОТНОСТИ ОПРЕДЕЛИТЬ ТЕМПЕРАТУРУ ЗАМЕРЗАНИЯ ТЕПЛОНОСИТЕЛЯ
Плотность теплоносителя и его температура кристаллизации – вещи безусловно связанные. Чем выше плотность антифриза, тем больше концентрация гликоля в нем и тем ниже его температура кристаллизации.
В различных источниках можно увидеть таблицы соответствия температуры кристаллизации определенной плотности. Например:
пропиленгликоль 40% | 1,032 | -20 |
пропиленгликоль 45% | 1,035 | -26 |
Предположим, монтажник на объекте отобрал из контура образец жидкости, померял его плотность и получил значение 1,035 г/см3. Затем посмотрел в таблицу и решил, что у него залит раствор пропиленгликоля 45% и жидкость не замерзнет до -260С.
Затем посмотрел в таблицу и решил, что у него залит раствор пропиленгликоля 45% и жидкость не замерзнет до -260С.
Возможны следующие варианты, при которых выводы монтажника были неправильными:
фото 3
- В контуре залит раствор этиленгликоля 28% с плотностью 1,035 г/см3, и его температура начала кристаллизации – около -120С.
- В контуре залит раствор глицерина 15%, его плотность 1,035 г/см3 , а температура начала кристаллизации – около -30С.
- В контуре залит раствор пропиленгликоля 40%. Монтажник померял его плотность при температуре +120С (а не +200С) и она составила 1,035 г/см3. Таким образом, теплоноситель в контуре сможет циркулировать лишь до -200С, а не до -260С.
Мы рассмотрели некоторые примеры ошибочных выводов, из которых становится очевидным, что использовать аналитические зависимости можно только тогда, когда абсолютно точно известен состав исследуемого продукта.
Так же часто, как разнообразные таблицы, упоминаются ареометры или градусники для автомобильного тосола. Считается, что с их помощью можно определить температуру кристаллизации охлаждающей жидкости (фото 3).
По внешнему виду приспособления понятно, что это – ареометр и измеряет он не что иное, как плотность жидкости в г/см3. Производитель приспособления назначил соответствие продукту определенной плотности определенную температуру кристаллизации и нарисовал вместо шкалы плотности температурную шкалу. По сути, та же таблица «плотность – температура кристаллизации». Только неизвестно, какой продукт принят за эталон. Видимо, подобный градусник может показать ориентировочные значения для охлаждающих жидкостей (хладоносителей, антифризов) на основе этиленгликоля. Хотя все, что было изложено в предыдущем примере, верно и для данного приспособления.
Вывод, который следует сделать из всего вышеизложенного:
ПЛОТНОСТЬ – важная характеристика теплоносителя (хладоносителя, антифриза), но не единственная.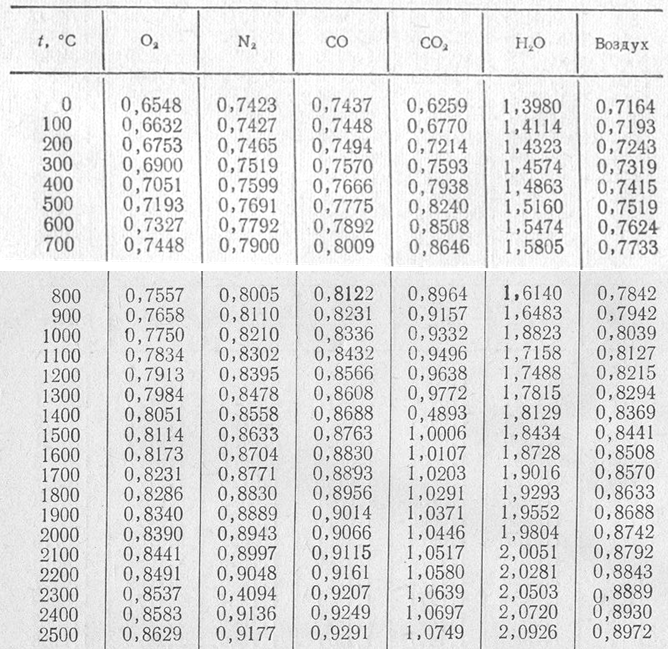 Качество теплоносителя определяет общепринятая система показателей. Кроме плотности в нее входят:
Качество теплоносителя определяет общепринятая система показателей. Кроме плотности в нее входят:
— внешний вид;
— температура начала кристаллизации;
— рН;
— щелочность;
— фракционный состав;
— вспенивание;
— коррозионное воздействие на металлы;
— набухание резины.
Объемные свойства водных растворов этиленгликолей в интервале температур 293,15–318,15 K
На этой странице гликоль (ТЭГ) измеряли при температуре от 293,15 до 318,15 К и моляльности в диапазоне от 0,0488 до 0,5288 моль·кг -1 . Объемы всех исследованных растворов при определенной температуре линейно зависели от моляльности растворенного вещества; по этой зависимости были определены парциальные молярные объемы при бесконечном разбавлении для всех растворенных веществ. Было обнаружено, что парциальные молярные объемы при бесконечном разбавлении не зависят от концентрации и незначительно увеличиваются с повышением температуры. Парциальные молярные объемы при бесконечном разбавлении или предельные кажущиеся молярные объемы этиленгликолей подгоняли к линейному уравнению с количеством оксиэтиленовых групп () в молекуле растворенного вещества. Из этого уравнения был получен постоянный вклад концевых () и () групп в объемные свойства. Коэффициент теплового расширения () для всех исследованных растворов рассчитывался при температурах от 29от 3,15 до 318,15 К. Коэффициенты теплового расширения для всех растворенных веществ увеличиваются с повышением температуры и моляльности. Значения () превышали значение коэффициента теплового расширения чистой воды.
Парциальные молярные объемы при бесконечном разбавлении или предельные кажущиеся молярные объемы этиленгликолей подгоняли к линейному уравнению с количеством оксиэтиленовых групп () в молекуле растворенного вещества. Из этого уравнения был получен постоянный вклад концевых () и () групп в объемные свойства. Коэффициент теплового расширения () для всех исследованных растворов рассчитывался при температурах от 29от 3,15 до 318,15 К. Коэффициенты теплового расширения для всех растворенных веществ увеличиваются с повышением температуры и моляльности. Значения () превышали значение коэффициента теплового расширения чистой воды.
1. Введение
Эффекты смешивания для тысяч химических соединений и их смесей, используемых в промышленности, довольно трудно узнать; следовательно, большое значение имеет знание термодинамических свойств, таких как плотности, а также избыточные молярные объемы, парциальные молярные объемы и кажущиеся молярные объемы органических смесей при различных температурах. Большое значение в физической химии имеют сольватация растворенного вещества в определенном растворителе и различные типы взаимодействий растворяемое вещество-растворитель и растворитель-растворитель [1].
Большое значение в физической химии имеют сольватация растворенного вещества в определенном растворителе и различные типы взаимодействий растворяемое вещество-растворитель и растворитель-растворитель [1].
Анализ многокомпонентных жидких смесей с точки зрения молярной доли или моляльности, а также их термодинамических и объемных свойств важен для проектирования промышленных процессов. Эти свойства также важны при поиске моделей, способных связать молекулярную структуру и макроскопические свойства жидкостей [2]. При образовании жидкой смеси происходят изменения взаимодействий молекул, и становится очевидной разница в упаковке компонентов. При наличии развитой сети водородных связей хотя бы в одном из растворителей свойства смеси изменяются особым образом [3].
Физические свойства жидких смесей очень важны для понимания природы молекулярных взаимодействий между молекулами жидких смесей. Такие свойства жидких смесей полезны при конструировании различного транспортного и технологического оборудования в химической промышленности [4].
Амфифильная молекула имеет одновременно полярную и неполярную группу. В водных растворах эти молекулы могут самоассоциироваться в агрегаты, называемые мицеллами [5], где контакт между водой и углеводородом значительно снижается, в то время как полярные группы сохраняют свою гидратацию. При этом основной вклад в свободную энергию вносит устранение неблагоприятных контактов углеводород-вода, взаимодействий головных групп и межагрегатных взаимодействий [6, 7].
Гидратационные свойства растворенных веществ, т. е. органических молекул и биомолекул в водных смесях, вообще комплексно отражают совокупный эффект различных гетерогенных взаимодействий вокруг растворенного вещества. Гидрофильная и гидрофобная гидратация и взаимодействие являются центральными темами химии и физики жидкого состояния. Стык гидрофильного и гидрофобного эффектов друг с другом приводит к деструктивному или, при определенных условиях, кооперативному взаимодействию [8].
Этиленгликоли представляют собой очень интересные растворители благодаря наличию окси- и гидроксильных групп в одной и той же молекуле. Благодаря этому наблюдается образование внутри- и межмолекулярных водородных связей между группами –О– и –ОН одной и той же или разных молекул этиленгликолей [9]. Несмотря на интересные характеристики и промышленное значение, термодинамические свойства смесей, содержащих этиленгликоли, изучены недостаточно полно [10].
Благодаря этому наблюдается образование внутри- и межмолекулярных водородных связей между группами –О– и –ОН одной и той же или разных молекул этиленгликолей [9]. Несмотря на интересные характеристики и промышленное значение, термодинамические свойства смесей, содержащих этиленгликоли, изучены недостаточно полно [10].
В настоящей работе приведены значения плотности бинарных смесей этиленгликоля (ЭГ), диэтиленгликоля (ДЭГ) и триэтиленгликоля (ТЭГ) с водой в интервале температур от 298,15 до 318,15 К. Значения плотностей коррелируют с температурой и моляльность. Экспериментальные данные были использованы для расчета парциальных мольных объемов и коэффициентов теплового расширения.
2. Экспериментальный
2.1. Химические вещества
Все используемые растворители были аналитической чистоты и приобретены у Fluka AG. Были измерены плотности и показатели преломления чистых жидкостей, и результаты приведены в таблице 1 вместе с литературными данными для сравнения. Эти жидкости выдерживали над свежеактивированными молекулярными ситами типа 4.А (Union Carbide) в течение нескольких дней перед использованием для уменьшения содержания воды. В таблице 1 приведены некоторые химические и физические свойства всех химических веществ, использованных в этом исследовании.
Эти жидкости выдерживали над свежеактивированными молекулярными ситами типа 4.А (Union Carbide) в течение нескольких дней перед использованием для уменьшения содержания воды. В таблице 1 приведены некоторые химические и физические свойства всех химических веществ, использованных в этом исследовании.
2.2. Приготовление растворов
Все растворы готовили путем растворения соответствующего количества (по массе) каждого растворенного вещества в деионизированной дистиллированной воде. Растворы различной молярности в диапазоне от 0,0466 до 0,5297 моль·кг -1 для каждого растворенного вещества готовили в мерной колбе объемом 25 см 3 с использованием цифровых весов (Sartorius BL210 S) с точностью до ±0,0001 г. Все растворы оставляли не менее чем на 24 часа перед измерениями для достижения равновесия. Плотности и показатели преломления чистых жидкостей сравниваются с литературными данными (табл. 1).
2.3. Измерения плотности
Цифровой плотномер Anton Paar (модель DMA 60/601) использовали для определения плотности чистых жидкостей и бинарных смесей.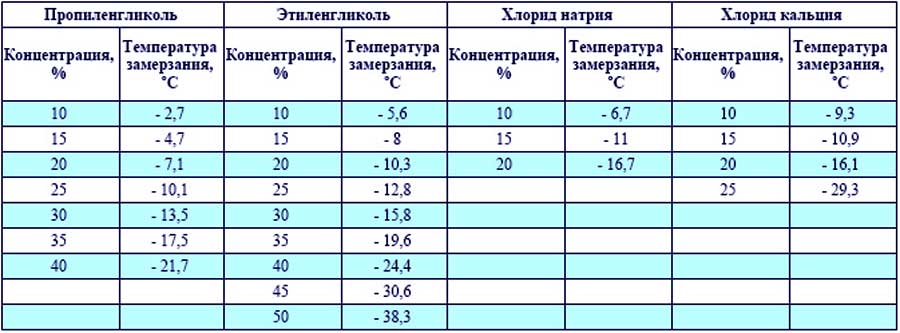 Измерения плотности основаны на изменении собственной частоты лампового генератора, заполненного пробой жидкости, по отношению к воздуху. Измерительная ячейка выполнена в отдельном корпусе в комплекте с противовесом осциллятора и разъемами для термостата. Осциллятор или трубка для образца, изготовленная из боросиликатного стекла, вплавлена в стеклянный цилиндр с двойными стенками, что позволяет осуществлять контроль температуры за счет циркуляции воды по пути с постоянной температурой. Температуру водяного тракта поддерживали постоянной с точностью до 0,01 К с помощью цифрового термостата Haake. Точность измерения плотности оценивается лучше, чем 10 -4 (г·см -3 ).
Измерения плотности основаны на изменении собственной частоты лампового генератора, заполненного пробой жидкости, по отношению к воздуху. Измерительная ячейка выполнена в отдельном корпусе в комплекте с противовесом осциллятора и разъемами для термостата. Осциллятор или трубка для образца, изготовленная из боросиликатного стекла, вплавлена в стеклянный цилиндр с двойными стенками, что позволяет осуществлять контроль температуры за счет циркуляции воды по пути с постоянной температурой. Температуру водяного тракта поддерживали постоянной с точностью до 0,01 К с помощью цифрового термостата Haake. Точность измерения плотности оценивается лучше, чем 10 -4 (г·см -3 ).
3. Результаты и обсуждение
3.1. Плотность
Экспериментально измеренные плотности бинарных смесей (вода + этиленгликоли) при 293,15, 298,15, 303,15, 308,15, 313,15 и 318,15 К приведены в табл. 2. Полученные результаты плотностей всех бинарных смесей представлены в виде графика функция моляльности раствора (м/моль·кг -1 ), (рис.
Экспериментальные плотности различных бинарных смесей в исследованных диапазонах моляльностей подчиняются уравнению вида [13]
Коэффициенты , , и для графиков () и () показаны в таблице 3 вместе со стандартным отклонением, , определяемым формулой где () и () — наблюдаемое и расчетное значения плотности соответственно, — количество экспериментальных точек, — количество коэффициентов в (1). Подобранные значения константы () в (1) хорошо сравниваются со средней плотностью воды для различных определений плотности воды, полученных в ходе серии экспериментов, проведенных для каждого растворенного вещества при каждой температуре.
3.2. Парциальные молярные объемы
Объемы исследуемых растворов, содержащих моль растворенного вещества на килограмм растворителя, рассчитывали по [14] где – молекулярная масса растворенного вещества, () – плотность раствора.
Концентрационная зависимость может быть описана формулой [15] где (), (г·см -3 ) — плотность чистого растворителя, (см 3 ·моль -1 ) — парциальный молярный объем растворенного вещества при бесконечном разбавлении, , , и т. д. являются вириальными коэффициентами согласно теории растворения Макмиллана-Майера [16] и представляют собой вклад в избыточные термодинамические свойства парных, триплетных и высших агрегатов.
Для исследованных растворов установлено, что объемы раствора при определенной температуре для каждого растворенного вещества линейно зависят от концентрации растворенного вещества; т. е. соотношение (4) сводится к Из этого соотношения парциальный молярный объем при бесконечном разбавлении () для каждого растворенного вещества при определенной температуре может быть определен по графикам () как функция моляльности () (рис. 2). Значения () вместе со стандартными ошибками приведены в табл. 4. Значения () не зависят от концентрации и немного увеличиваются с повышением температуры.
Парциальные молярные объемы при бесконечном разбавлении или предельные кажущиеся молярные объемы олигомеров ЭГ можно описать линейными уравнениями: где – количество оксиэтиленовых (СН 2 СН 2 О) групп в молекуле. Эти уравнения определяют постоянный вклад оксиэтиленовой (CH 2 CH 2 O) группы и концевой (OH) группы в объемные свойства. Линейность () с молекулярной массой, а затем и с молекулярной массой характерна для стержнеобразных молекул, а с другой стороны, разумно предположить такую форму для молекул первого олигомера. Значение объемного вклада этоксильной группы в диапазоне от 36,34 до 36,87 см 3 ·моль −1 хорошо согласуется со значением, полученным Vergara et al. [17] (37,18 см 3 ·моль −1 ) или указанное Киринчичем и Клофутаром [18] (36,9 см 3 ·моль −1 ) или значение, полученное из теории группового вклада (36,1 см
Значение объемного вклада этоксильной группы в диапазоне от 36,34 до 36,87 см 3 ·моль −1 хорошо согласуется со значением, полученным Vergara et al. [17] (37,18 см 3 ·моль −1 ) или указанное Киринчичем и Клофутаром [18] (36,9 см 3 ·моль −1 ) или значение, полученное из теории группового вклада (36,1 см
Парциальные молекулярные объемы при бесконечном разбавлении (см 3 · молекула −1 ) для исследованных жидких растворенных веществ при 298,15 K были рассчитаны по формуле: где – постоянная Авогадро. Молекулярные объемы чистых жидких растворенных веществ (см 3 · молекула -1 ) при 298,15 К были рассчитаны по формуле где () — плотность чистого растворенного вещества. Сравнение парциальных молекулярных объемов при бесконечном разбавлении () всех растворенных веществ с их молекулярными объемами () показывает, что первые меньше вторых. Значения и вместе со значениями их отношения () приведены в табл. 5. Значения парциальных избыточных молекулярных объемов рассчитывали из Эти величины, характеризующие объемные изменения, связанные с переходом одной молекулы растворенного вещества из чистого растворенного вещества в раствор при бесконечном разбавлении, имеют отрицательный рост по величине с увеличением оксиэтиленовых звеньев и уменьшение с повышением температуры.
Молекулярные объемы чистых жидких растворенных веществ (см 3 · молекула -1 ) при 298,15 К были рассчитаны по формуле где () — плотность чистого растворенного вещества. Сравнение парциальных молекулярных объемов при бесконечном разбавлении () всех растворенных веществ с их молекулярными объемами () показывает, что первые меньше вторых. Значения и вместе со значениями их отношения () приведены в табл. 5. Значения парциальных избыточных молекулярных объемов рассчитывали из Эти величины, характеризующие объемные изменения, связанные с переходом одной молекулы растворенного вещества из чистого растворенного вещества в раствор при бесконечном разбавлении, имеют отрицательный рост по величине с увеличением оксиэтиленовых звеньев и уменьшение с повышением температуры.
3.3. Коэффициенты теплового расширения
Парциальные молярные объемы при бесконечном разбавлении для всех исследованных водных растворов, перечисленных в таблице 4, слабо зависят от температуры.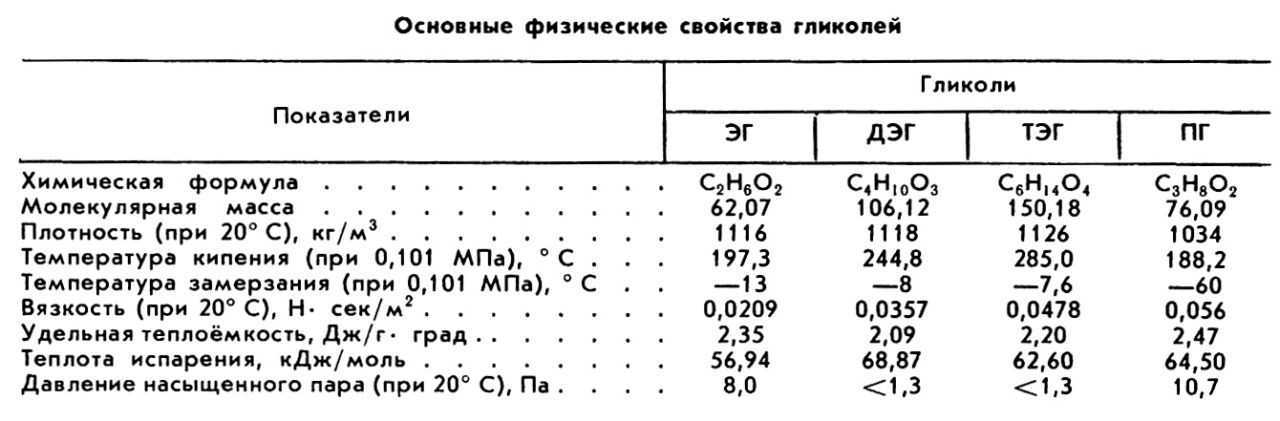 Из рисунка 3 видно, что графики зависимости () от линейны, поэтому его можно описать формулой где и – эмпирические константы, – абсолютная температура; K. Коэффициенты и , определенные методом наименьших квадратов, приведены в табл. 6.
Из рисунка 3 видно, что графики зависимости () от линейны, поэтому его можно описать формулой где и – эмпирические константы, – абсолютная температура; K. Коэффициенты и , определенные методом наименьших квадратов, приведены в табл. 6.
Поскольку парциальные мольные объемы всех исследованных растворенных веществ в воде не зависят от концентрации и равны их объемам при бесконечном частичная молярная расширяемость растворенного вещества () (см 3 ·моль −1 ·K −1 ) также не зависят от концентрации и равны своим значениям при бесконечном разбавлении ().
Частичное молярное расширение растворенного вещества при бесконечном разбавлении равно коэффициенту регрессии (10), а коэффициент теплового расширения растворенного вещества при бесконечном разбавлении () (K −1 ) определяется как [14] что равно отношению . Значения (), рассчитанные по (11), приведены в табл. 7. Значения () имеют тенденцию к небольшому уменьшению с повышением температуры.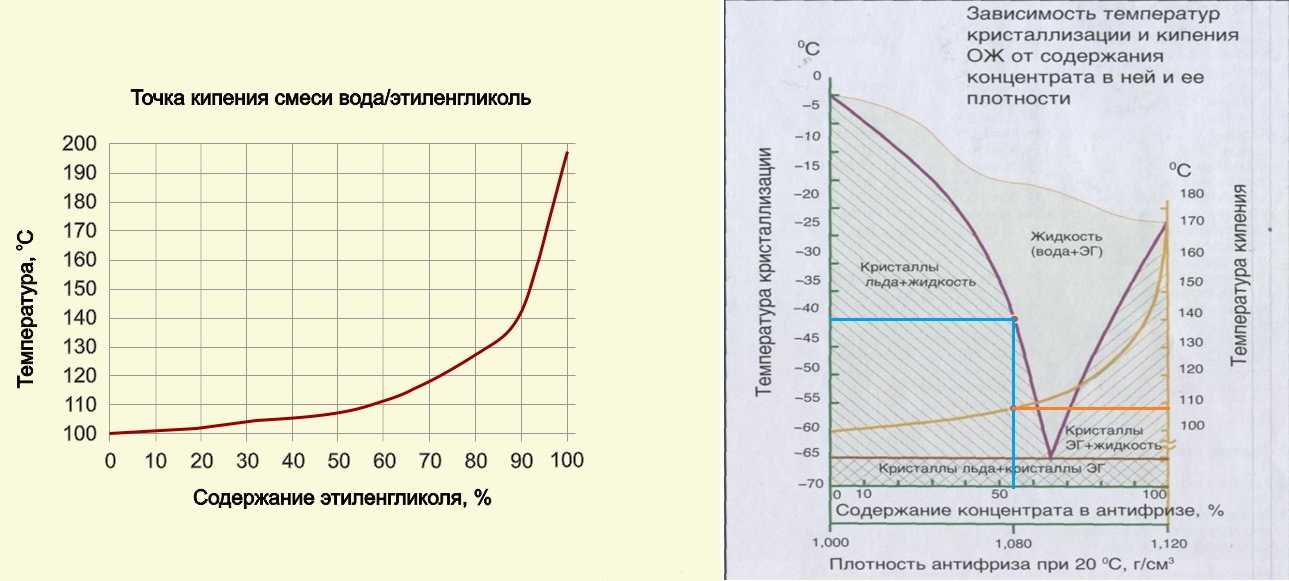 С другой стороны, коэффициент теплового расширения раствора (K −1 ) определяется как где – объем раствора, содержащего m молей растворенного вещества на килограмм растворителя. Таким образом, коэффициент теплового расширения исследуемых растворов рассчитывается из где – коэффициент теплового расширения чистой воды.
С другой стороны, коэффициент теплового расширения раствора (K −1 ) определяется как где – объем раствора, содержащего m молей растворенного вещества на килограмм растворителя. Таким образом, коэффициент теплового расширения исследуемых растворов рассчитывается из где – коэффициент теплового расширения чистой воды.
Значения для всех исследованных растворов приведены в таблице 8. Коэффициенты теплового расширения для всех растворенных веществ увеличиваются с повышением температуры и моляльности. Зависимость () от объемной доли растворенного вещества () показана на рисунке 4. Объемная доля использовалась вместо моляльности или мольной доли растворенного вещества, чтобы учесть влияние различий в размерах молекул растворенного вещества и растворителя. Объемную долю растворенного вещества рассчитывали по формуле Из рисунка 4 видно, что зависимость () от () носит линейный характер. Эта зависимость может быть выражена в виде [14]
Расчетные значения () приведены в табл. 9. Из рис. 4 и табл. 9 видно, что значения коэффициента теплового расширения исследуемых растворов выше, чем у чистого растворителя, за исключением случая этилена гликоля при более высоких температурах (313,15 и 318,15 K), когда коэффициент теплового расширения раствора ниже, чем у чистого растворителя. Низкие значения ТЭГ могут свидетельствовать о наличии переплетений цепи в спиральной структуре [17].
9. Из рис. 4 и табл. 9 видно, что значения коэффициента теплового расширения исследуемых растворов выше, чем у чистого растворителя, за исключением случая этилена гликоля при более высоких температурах (313,15 и 318,15 K), когда коэффициент теплового расширения раствора ниже, чем у чистого растворителя. Низкие значения ТЭГ могут свидетельствовать о наличии переплетений цепи в спиральной структуре [17].
4. Выводы
Данные плотности и молярные объемы в зависимости от температуры и моляльности измерены для водных растворов этиленгликоля, диэтиленгликоля и триэтиленгликоля. Эти данные были использованы для получения парциального молярного объема при бесконечном разбавлении (). Было обнаружено, что значения несколько увеличиваются с повышением температуры. Эти значения коррелируют с количеством оксиэтиленовых (СН 2 СН 2 О) групп в молекуле (). Предполагалось, что постоянный вклад концевой (ОН) группы и (СН 2 CH 2 О) к объемным свойствам этих смесей. Также были рассчитаны значения парциальных избыточных молекулярных объемов (). Эти значения отрицательны и увеличиваются по величине с увеличением количества оксиэтиленовых звеньев и понижением температуры.
Также были рассчитаны значения парциальных избыточных молекулярных объемов (). Эти значения отрицательны и увеличиваются по величине с увеличением количества оксиэтиленовых звеньев и понижением температуры.
Коэффициенты теплового расширения () для всех растворенных веществ увеличиваются с повышением температуры и моляльности. Установлено, что значения коэффициента теплового расширения исследуемых растворов выше, чем у чистого растворителя, за исключением случая этиленгликоля при более высоких температурах (313,15 и 318,15 К), где коэффициент теплового расширения раствора ниже что чистый растворитель.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Ссылки
А. Майтра и С. Багчи, «Изучение взаимодействий растворенное вещество-растворитель и растворитель-растворитель в чистых и смешанных бинарных растворителях», Journal of Molecular Liquids , vol. 137, нет. 1–3, стр.
 131–137, 2008 г.
131–137, 2008 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Ф. Керманпур, Х. Джахани и Х. Илоухани, «Избыточный молярный объем и производные термодинамические свойства бинарных смесей 2-метил-1-бутанола и 2-этил-1-бутанола + различные эфиры при диапазон температур 29от 3,15 до 313,15 К», Journal of Molecular Liquids , vol. 146, нет. 1–2, стр. 29–34, 2009 г.
Посмотреть по адресу:
Сайт издателя |
Егоров Г. И., Макаров Д. М., Колкер А. М. Жидкофазные PVTx свойства бинарных смесей (вода + этиленгликоль) в интервале от 278,15 до 323,15 К и от 0,1 до 100 МПа. I. Экспериментальные результаты, парциальные и избыточные термодинамические свойства», Fluid Phase Equilibria , vol. 344, стр. 125–138, 2013.
Просмотр по адресу:
Google Scholar
К.
 Чжан, Дж. Ян, С. Ю, Дж. Чжан и С. Вей, «Плотности и вязкости для бинарных смесей полиэтиленгликоля 400 + диметил сульфоксид и полиэтиленгликоль 600 + вода при различных температурах», Journal of Chemical and Engineering Data , vol. 56, нет. 7, стр. 3083–3088, 2011.
Чжан, Дж. Ян, С. Ю, Дж. Чжан и С. Вей, «Плотности и вязкости для бинарных смесей полиэтиленгликоля 400 + диметил сульфоксид и полиэтиленгликоль 600 + вода при различных температурах», Journal of Chemical and Engineering Data , vol. 56, нет. 7, стр. 3083–3088, 2011.Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Г. Лафлин, «Относительная гидрофильность среди гидрофильных групп поверхностно-активных веществ», в Advances in Liquid Crystals , G. H. Brown, Ed., стр. 41–98, Academic Press, New York, NY, USA, 1978. Д’Эррико, Р. Сарторио и Л. Костантино, «Динамические свойства водных растворов олигомеров этиленгликоля, измеренные методом импульсного градиентного спинового эха ЯМР при 25°C», Journal of the Chemical Society , vol. 93, нет. 22, стр. 3961–3966, 1997.
Посмотреть по адресу:
Google Scholar
Дж.
 К. Ланг и Р. Д. Морган, «Смеси неионогенных поверхностно-активных веществ. I. Фазовые равновесия в C 10 E 4 -H 2 O и сосуществование с обратной связью», The Journal of Chemical Physics , vol. 73, нет. 11, pp. 5849–5861, 1980.
К. Ланг и Р. Д. Морган, «Смеси неионогенных поверхностно-активных веществ. I. Фазовые равновесия в C 10 E 4 -H 2 O и сосуществование с обратной связью», The Journal of Chemical Physics , vol. 73, нет. 11, pp. 5849–5861, 1980.Просмотр по адресу:
Google Scholar
Р. Дж. Сенгва и С. Санхла, «Характеристика гетерогенного взаимодействия в бинарных смесях олигомера этиленгликоля с водой, этиловым спиртом и диоксаном с помощью диэлектрический анализ», Journal of Molecular Liquids , vol. 130, нет. 1–3, стр. 119–131, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. M. Kinart, M. Klimczak, and WJ Kinart, «Объемная и диэлектрическая характеристика и анализ внутренней структуры бинарных смесей 2-этоксиэтанола с этиленгликолем, диэтиленгликолем, триэтиленгликолем и тетраэтиленгликолем при T = (293.
 15, 298.15 и 303.15) K», Journal of Molecular Liquids , vol. 145, нет. 1, стр. 8–13, 2009 г..
15, 298.15 и 303.15) K», Journal of Molecular Liquids , vol. 145, нет. 1, стр. 8–13, 2009 г..Посмотреть по адресу:
Сайт издателя | Google Scholar
Седов И.А., Столов М.А., Соломонов Б.Н. Энтальпии и свободные энергии Гиббса сольватации в этиленгликоле при 298 К: влияние сольвофобного эффекта. 354, pp. 95–101, 2013.
Просмотр по адресу:
Google Scholar
Т. Сан и А. С. Теджа, «Плотность, вязкость и теплопроводность водных смесей этилена, диэтилена и триэтиленгликоля между 290 K и 450 K», Journal of Chemical and Engineering Data , vol. 48, нет. 1, стр. 198–202, 2003 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Э. А. Мюллер и П. Расмуссен, «Плотности и избыточные объемы в водных растворах полиэтиленгликоля», Journal of Chemical and Engineering Data , vol.
 36, нет. 2, стр. 214–217, 1991.
36, нет. 2, стр. 214–217, 1991.Просмотр по адресу:
Google Scholar
E. F. G. Barbosa, S. M. C. Sousa, M. S. C. S. Santos и I. M. S. . Межмолекулярные взаимодействия. Эффекты Н-связи», Физическая химия Химическая физика , вып. 3, нет. 4, стр. 556–561, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Клофутар, Ш. Paljk и S. Golc-Teger, «Частичные молярные объемы и парциальные молярные расширения холестерина в некоторых апротонных растворителях», Thermochimica Acta , vol. 196, нет. 2, pp. 401–413, 1992.
Просмотр по адресу:
Google Scholar
С. Вурцбургер, Р. Сарторио, Г. Гуарино и М. Ниси, «Объемные свойства водных растворов полиолов между 0,5 и 25°С» Journal of the Chemical Society, Faraday Transactions 1 , vol.
 84, нет. 7, стр. 2279–2287, 1988.
84, нет. 7, стр. 2279–2287, 1988.Посмотреть по адресу:
Сайт издателя | Google Scholar
В. Г. Макмиллан мл. и Дж. Э. Майер, «Статистическая термодинамика многокомпонентных систем», The Journal of Chemical Physics , vol. 13, нет. 7, pp. 276–305, 1945.
Просмотр по адресу:
Google Scholar
А. Вергара, Л. Падуано, Ф. Капуано и Р. Сарторио, «Интегралы Кирквуда-Баффа для смесей полимер-растворитель». . Преимущественная сольватация и волюмометрический анализ в водных растворах ПЭГ», Физическая химия Химическая физика , вып. 4, нет. 19, стр. 4716–4723, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Киринчич и К. Клофутар, «Объемное исследование водных растворов полиэтиленгликолей при 298,15 K», Fluid Phase Equilibria , vol.
 149, нет. 1–2, стр. 233–247, 1998.
149, нет. 1–2, стр. 233–247, 1998.Посмотреть по адресу:
Сайт издателя | Google Scholar
Аминабхави Т. М., Банерджи К. Плотность, вязкость, показатель преломления и скорость звука в бинарных смесях метилацетат + этиленгликоль или + поли(этиленгликоль) в интервале температур (298.15–308.15) K», Journal of Chemical and Engineering Data , vol. 43, нет. 5, pp. 852–855, 1998.
Просмотр по адресу:
Google Scholar
Джордж Дж. и Састри Н.В. Частичные избыточные молярные объемы, частичные избыточные изоэнтропические сжимаемости и относительные диэлектрические проницаемости воды + этан-1, Производное 2-диола и вода + 1,2-диметоксиэтан при различных температурах», Fluid Phase Equilibria , vol. 216, нет. 2, стр. 307–321, 2004.
Просмотр:
Сайт издателя | Google Scholar
Осваль С.
 Л., Патель Н. Б. Скорость звука, изоэнтропическая сжимаемость, вязкость и избыточный объем бинарных смесей. 1. Алканнитрилы с алкилацетатами», Journal of Chemical & Engineering Data , vol. 40, нет. 4, стр. 840–844, 1995.
Л., Патель Н. Б. Скорость звука, изоэнтропическая сжимаемость, вязкость и избыточный объем бинарных смесей. 1. Алканнитрилы с алкилацетатами», Journal of Chemical & Engineering Data , vol. 40, нет. 4, стр. 840–844, 1995.Просмотр по адресу:
Google Scholar
Дж. А. Риддик, У. Б. Бангер и Т. К. Сакано, Химические методы. Органические растворители. Физические свойства и методы очистки , том. 2, John Wiley & Sons, New York, NY, USA, 4th edition, 1986.
Copyright
Copyright © 2014 Omer El-Amin Ahmed Adam et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Почему гликоль используется в системах теплопередачи? – Go Glycol Pros
Почему гликоль используется в системах теплопередачи?
В свойствах воды и льда существует неравномерность. Оказывается, при температуре 39,16 градусов по Фаренгейту вода достигает наибольшей плотности, даже большей, чем плотность ее твердой формы, льда. Следовательно, это вызывает проблему, когда речь идет об использовании воды для переноса тепла или охлаждения вокруг наших зданий, чтобы обеспечить контроль температуры и комфорт для жителей здания.
Оказывается, при температуре 39,16 градусов по Фаренгейту вода достигает наибольшей плотности, даже большей, чем плотность ее твердой формы, льда. Следовательно, это вызывает проблему, когда речь идет об использовании воды для переноса тепла или охлаждения вокруг наших зданий, чтобы обеспечить контроль температуры и комфорт для жителей здания.
Например, как защитить трубопроводы и другое оборудование в системе водяного отопления от разрыва в случае выхода из строя теплогенераторов и температуры воды в системе, приближающейся к нулю?
Ответ: Мы снижаем температуру замерзания воды в нашей системе, добавляя определенное количество гликоля.
Типы гликоля
В мире гидравлики используются два типа гликоля: пропиленгликоль и этиленгликоль. Какая разница между двумя?
Необходимо учитывать два основных фактора; во-первых, этиленгликоль является более токсичным веществом, чем пропиленгликоль, и может нанести вред при попадании внутрь. Мы избегаем его использования в системах отопления, где возможно воздействие жидкости системы или существует вероятность того, что гликоль загрязнит питьевую воду.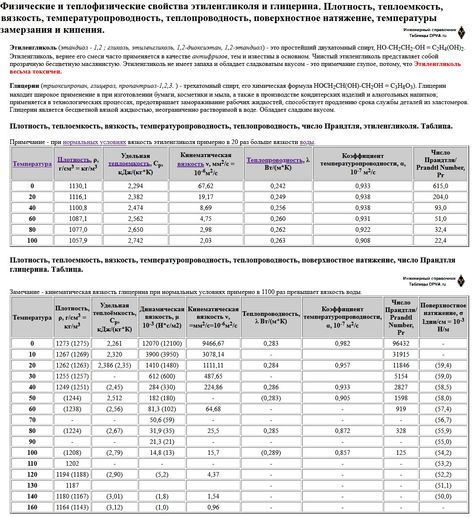 Только в строго регулируемых промышленных условиях мы видим, что этиленгликоль используется в современном мире.
Только в строго регулируемых промышленных условиях мы видим, что этиленгликоль используется в современном мире.
Пропиленгликоль, с другой стороны, был одобрен FDA как безопасный. Из-за низкой пероральной токсичности он обычно используется в упакованных пищевых продуктах, лекарствах и косметических продуктах.
Так почему бы не использовать пропиленгликоль каждый раз? Ответ: теплопередача.
Оказывается, преимущества более низкой температуры замерзания, которые мы получаем от гликоля, имеют свою цену, и эта цена заключается в плохой способности передавать тепло. Часто используемое в мире гидроники уравнение для расчета общей теплопередачи на основе расхода, с которым движется вода, и разности температур, которую мы планируем для наших змеевиков, часто выражается следующим образом:
BTUH = GPM * dT * 500
Что часто упускается из виду, так это тот факт, что это уравнение представляет только полную теплопередачу, когда наша жидкость представляет собой чистую воду. Когда мы вводим гликоль, мы должны учитывать значительную разницу в удельной теплоемкости смеси гликолей по сравнению с чистой водой.
Когда мы вводим гликоль, мы должны учитывать значительную разницу в удельной теплоемкости смеси гликолей по сравнению с чистой водой.
Например, пропиленгликоль в смеси с концентрацией 40% и водой дает удельную теплоемкость 0,895. Это снижение в конечном счете снижает общий объем теплопередачи, которого мы можем достичь при одинаковых скоростях потока и дельтах температуры по сравнению со 100% водой.
Однако растворы этиленгликоля не так сильно влияют на удельную теплоемкость, как растворы пропиленгликоля, и, следовательно, обеспечивают лучшую теплопередачу при том же процентном соотношении смеси (концентрация гликоля).
Ниже приведена скорректированная формула для общей теплопередачи с учетом того, что раствор состоит не из чистой воды, а вместо этого включает гликоль:
BTUH = GPM * dT * 500 * Удельная теплоемкость * Удельный вес
Замерзание и Взрыв
Это может показаться запутанным, но это две разные вещи, когда мы говорим о гидронике. Защита от замерзания относится к полному устранению фазового перехода в твердую форму при определенной температуре; в этом сценарии жидкость в системе всегда будет оставаться в жидкой форме вплоть до наихудшего температурного сценария, определенного группой разработчиков.
Защита от замерзания относится к полному устранению фазового перехода в твердую форму при определенной температуре; в этом сценарии жидкость в системе всегда будет оставаться в жидкой форме вплоть до наихудшего температурного сценария, определенного группой разработчиков.
Сравните это с защитой от разрыва, которая позволяет части жидкости в системе достичь фазового перехода и создать консистенцию слякоти в трубопроводе, но предотвращает полное замерзание, которое в конечном итоге может привести к разрыву труб.
Если система, содержащая гликоль, действительно дает утечку, краситель, добавляемый в раствор в процессе производства, помогает определить место утечки.
Какая концентрация вам нужна?
Концентрация зависит от типа используемого гликоля, минимальной ожидаемой температуры окружающей среды и от того, требуется ли вам защита от замерзания или защита от взрыва. Нажмите здесь, чтобы узнать больше о расчете требуемой концентрации гликоля, или свяжитесь с нами сегодня!
Go Glycol Pros является дистрибьютором теплоносителя DOW® более 20 лет. Мы продаем гликоль онлайн без каких-либо учетных записей или минимального заказа. Антифриз DOW высокой чистоты, доступный в емкостях на 275 галлонов, бочках на 55 галлонов или ведрах на 5 галлонов, предварительно смешивается с деионизированной водой (деионизированной водой) на нашем собственном предприятии и отправляется всего за один рабочий день. Наши ингибированные гликоли включают: пропиленгликоль DOWFROST HD, пропиленгликоль DOWFROST для пищевых продуктов и этиленгликоль DOWTHERM SR-1.
Мы продаем гликоль онлайн без каких-либо учетных записей или минимального заказа. Антифриз DOW высокой чистоты, доступный в емкостях на 275 галлонов, бочках на 55 галлонов или ведрах на 5 галлонов, предварительно смешивается с деионизированной водой (деионизированной водой) на нашем собственном предприятии и отправляется всего за один рабочий день. Наши ингибированные гликоли включают: пропиленгликоль DOWFROST HD, пропиленгликоль DOWFROST для пищевых продуктов и этиленгликоль DOWTHERM SR-1.
Ознакомьтесь с другими полезными советами и рекомендациями на сайте goglycolpros.com. Наши опытные эксперты по гликолю готовы помочь вам с вашим последним проектом гидронного отопления, вентиляции и кондиционирования воздуха.
View Dow Этиленгликоль, пропиленгликол и пищевой степени пропиленгликол
Зарегистрируйтесь, чтобы получить советы и советы по теплообмену от Go Glycol Pros
Отказ: GLYCOL Pross and It Affilies не может быть, не может быть, не поддержание не может быть не может быть не может быть, не поддержание не может быть, не может быть аффилиальные не могут быть аффильты.

 131–137, 2008 г.
131–137, 2008 г. Чжан, Дж. Ян, С. Ю, Дж. Чжан и С. Вей, «Плотности и вязкости для бинарных смесей полиэтиленгликоля 400 + диметил сульфоксид и полиэтиленгликоль 600 + вода при различных температурах», Journal of Chemical and Engineering Data , vol. 56, нет. 7, стр. 3083–3088, 2011.
Чжан, Дж. Ян, С. Ю, Дж. Чжан и С. Вей, «Плотности и вязкости для бинарных смесей полиэтиленгликоля 400 + диметил сульфоксид и полиэтиленгликоль 600 + вода при различных температурах», Journal of Chemical and Engineering Data , vol. 56, нет. 7, стр. 3083–3088, 2011.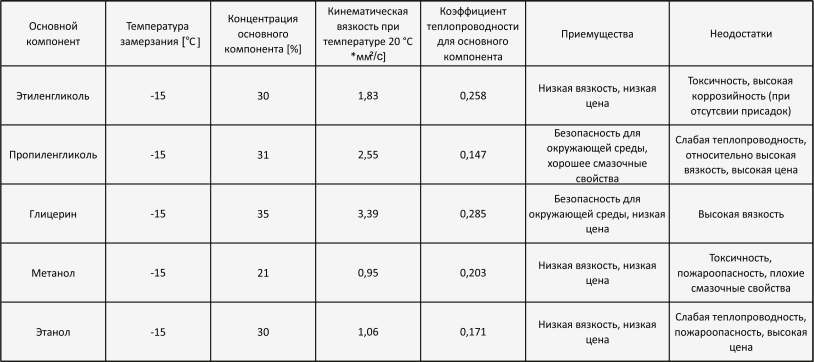 К. Ланг и Р. Д. Морган, «Смеси неионогенных поверхностно-активных веществ. I. Фазовые равновесия в C 10 E 4 -H 2 O и сосуществование с обратной связью», The Journal of Chemical Physics , vol. 73, нет. 11, pp. 5849–5861, 1980.
К. Ланг и Р. Д. Морган, «Смеси неионогенных поверхностно-активных веществ. I. Фазовые равновесия в C 10 E 4 -H 2 O и сосуществование с обратной связью», The Journal of Chemical Physics , vol. 73, нет. 11, pp. 5849–5861, 1980. 15, 298.15 и 303.15) K», Journal of Molecular Liquids , vol. 145, нет. 1, стр. 8–13, 2009 г..
15, 298.15 и 303.15) K», Journal of Molecular Liquids , vol. 145, нет. 1, стр. 8–13, 2009 г.. 36, нет. 2, стр. 214–217, 1991.
36, нет. 2, стр. 214–217, 1991.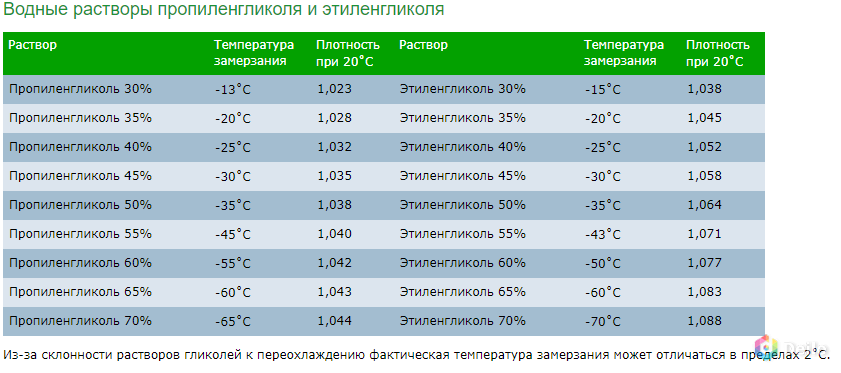 84, нет. 7, стр. 2279–2287, 1988.
84, нет. 7, стр. 2279–2287, 1988. 149, нет. 1–2, стр. 233–247, 1998.
149, нет. 1–2, стр. 233–247, 1998. Л., Патель Н. Б. Скорость звука, изоэнтропическая сжимаемость, вязкость и избыточный объем бинарных смесей. 1. Алканнитрилы с алкилацетатами», Journal of Chemical & Engineering Data , vol. 40, нет. 4, стр. 840–844, 1995.
Л., Патель Н. Б. Скорость звука, изоэнтропическая сжимаемость, вязкость и избыточный объем бинарных смесей. 1. Алканнитрилы с алкилацетатами», Journal of Chemical & Engineering Data , vol. 40, нет. 4, стр. 840–844, 1995.