С чем взаимодействует этиленгликоль: Этиленгликоль, взаимодействие — Справочник химика 21
Этиленгликоль, взаимодействие — Справочник химика 21
Полиэтилентерефталат получается поликонденсацией этиленгликоля и терефталевой кислоты. Синтез полиэтилентерефталата может быть осуществлен различными методами прямым взаимодействием терефталевой кислоты и гликоля, пере этерификацией низших эфиров терефталевой кислоты гликолем, реакцией дихлорангидрида кислоты и этиленгликоля. [c.74]В отличие от одноатомных спиртов этиленгликоль легко взаимодействует с гидроксидом меди (II), образуя ярко-синий гликолят меди [c.314]
Применение низших карбонильных производных. Формальдегид, или муравьиный альдегид, — газ с температурой кипения — 21 °С (может существовать в форме твердого параформальдегида (СНаОп), мировое производство которого составляет несколько сотен тысяч тонн ежегодно. Более 50% его используют при получении пластмасс и поликонденсационных лаков (смолы формальдегида с фенолом, мочевиной, меламином и т.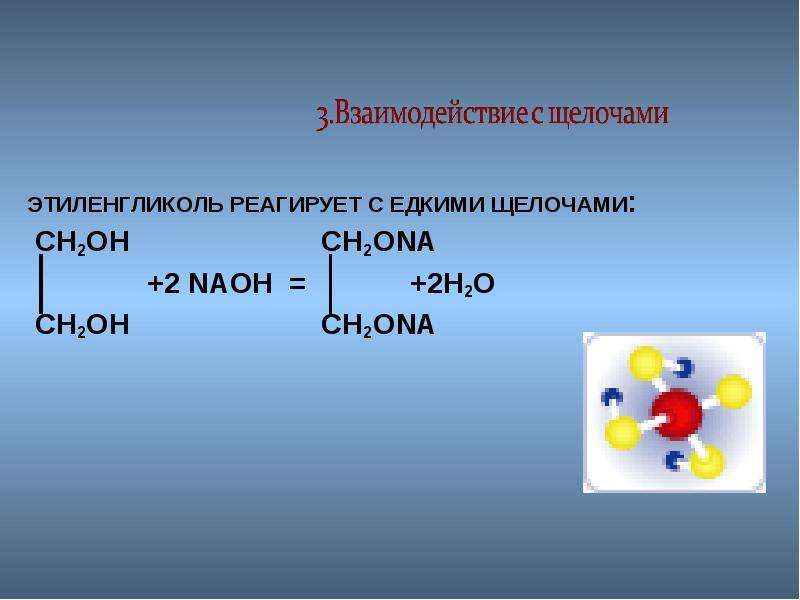
Гликоли, как известно, способны с кислотами давать несколько типов эфиров—неполные, полные и смешанные эфиры (неполные простые эфиры называются целлозольвы). Реакции образования этих веществ протекают в присутствии кислых катализаторов при нагревании. Технически важны моно- и диацетат этиленгликоля, которые применяют для растворения ацетилцеллюлозы при изготовлении специальных лаков. Целлозольвы образуются и при взаимодействии простых моноэфиров гликоля с кислотами [c.470]
Реакции окиси этилена с соединениями, содержащими гидроксильные группы. При взаимодействии окиси этилена со спиртами образуются моно-алкиловые эфиры этиленгликоля, называемые целозольфами.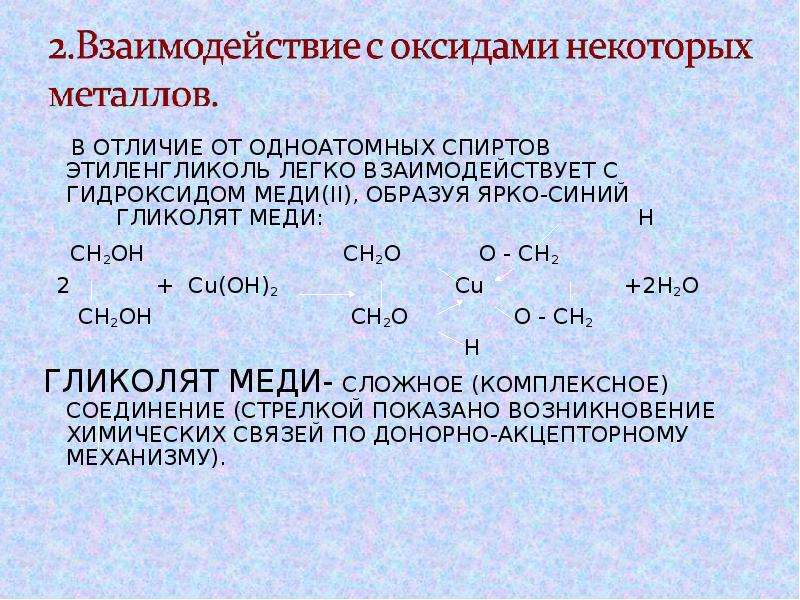 Реакция протекает по уравнению [c.192]
Реакция протекает по уравнению [c.192]
Образование сложных эфиров. С кислотами гликоли, подобно одноатомным спиртам (стр. 108), образуют сложные эфиры с той лишь разницей, что этерификации может подвергаться либо одна спиртовая группа с образованием моноэфира гликоля, либо обе спиртовые группы — с образованием диэфира. Взаимодействие этиленгликоля с двухосновными кислотами приводит к образованию высокомолекулярных смол, применяемых в производстве синтетического волокна (стр. 381,481) и пластмасс. [c.122]
При поликонденсации соединений с функциональностью более двух большая молекулярная масса может быть достигнута при высоком содержании функциональных групп, что соответствует значительной равновесной концентрации простейшего вещества, поддержание которой не вызывает затруднений. Поэтому полимер с достаточно высокой молекулярной массой легче получить при поликонденсации фталевой кислоты е глицерином или пентаэритритом, чем при взаимодействии фталевой кислоты с этиленгликолем.
В данном разделе мы рассмотрим вопрос о том, каким образом может образоваться диоксин при синтезе 2,4,5-Т. Именно этот процесс использовался в Севезо в 1976 г. и на oalite Works в 1968 г. Основной реакцией в обоих случаях (см. рис. 15.8) было взаимодействие 1,2,4,5-тетрахлорбензола с гидроксидом натрия в среде метанола или этиленгликоля, служащее для получения трихлорфенолята натрия, ацилирование которого давало затем конечный продукт производства — 2,4,5-трихлорфенол. [c.405]
ТХФ получали путем взаимодействия 1,2,4,5-тетрахлорбензола с гидроксидом натрия в присутствии этиленгликоля и ксилола (см. рис. 15.8). Несмотря на то что этиленгликоль считается растворителем, в процессах органического синтеза он, по-видимому, играет роль химического агента, образующего промежуточные вещества (алкоксиды), в составе которых натрий попадает в сферу реакции. Ксилол, очевидно, добавляют для того, чтобы иметь возможность азеотропно отогнать воду из конечной смеси. Вследствие этого равновесие в уравнении реакции, представленном на рис. 15.8, сдвинется вправо. Это дает некоторое подтверждение тому, что в полученной смеси непрореагировавший натрий скорее будет присутствовать в форме органического соединения, нежели в форме водного раствора гидроксида. [c.411]
Вследствие этого равновесие в уравнении реакции, представленном на рис. 15.8, сдвинется вправо. Это дает некоторое подтверждение тому, что в полученной смеси непрореагировавший натрий скорее будет присутствовать в форме органического соединения, нежели в форме водного раствора гидроксида. [c.411]
Ввиду того, что хроматы взаимодействуют с органическими веществами, их нельзя вводить в состав антифризов. Имеется множество ингибирующих составов, выпускаемых разными фирмами. Чтобы облегчить обращение с ними, они обычно поступают в продажу растворенными в метаноле или этиленгликоле. Это, однако, ограничивает круг используемых ингибиторов. В США распространенным компонентом ингибирующих комплексов является бура (N326407-ЮНаО). Совместно с бурой иногда применяют сульфированные масла, создающие масляное защитное покрытие, и меркаптобензотиазол, который замедляет коррозию меди. Одновременно меркаптобензотиазол предотвращает агрессивное действие образующихся ионов Си +, которые ускоряют коррозию других металлов системы.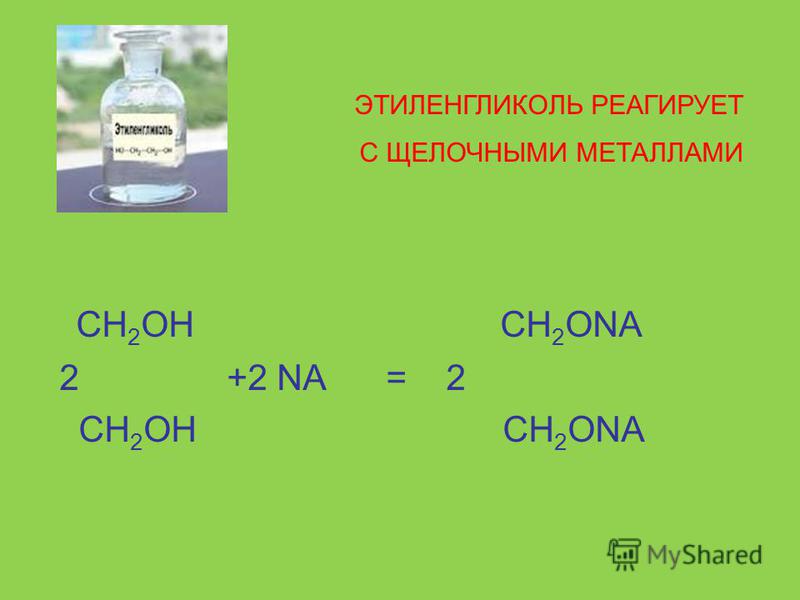
Из окиси этилена, при взаимодействии ее с этиловым спиртом в присутствии серной кислоты, намечено получать этиловый эфир этиленгликоля, так называемый этилцеллозольв, который, как указывалось выше, применяется для растворения нитроцеллюлозы и ацетилцеллюлозы. [c.319]
Полигликоли —ценные растворители, применяются они и в производстве синтетических моющих средств (стр. 167). Могут быть получены при взаимодействии этиленгликоля с окисью этилена (стр. 131). [c.123]
При замене глицерина безводным этилепгликолем процесс определения может быть значительно ускорен. Этиленгликоль взаимодействует со свободной СаО, образуя гликолят кальция [c.71]
Сжиженная С4-фракция смешивается с водной шихтой, содержащей этилцеллозольв и эмульгатор, в смесителе 1, н полученная эмульсия пропускается через батарею гидрататоров 2 с объемной скоростью 1,5—2 ч.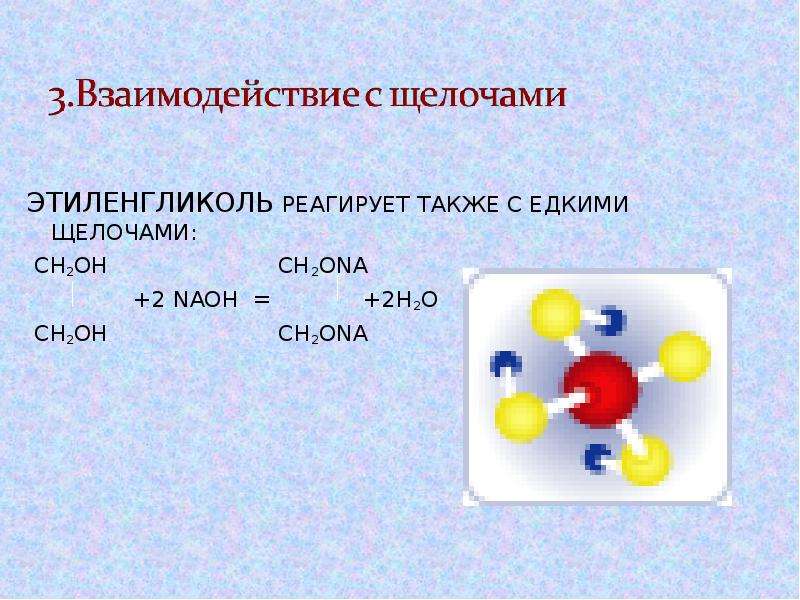 В этих условиях степень превращения изобутилена достигает 92%, выход трет-бутилового спирта на превращенный олефин — 98%. Практически единственным побочным продуктом на этой стадии является этил-тре/п-бутиловый эфир этиленгликоля, образующийся при взаимодействии изобутилена с этилцеллозольвом. На стадии дегидратации этот эфир полностью разлагается на исходные вещества.
В этих условиях степень превращения изобутилена достигает 92%, выход трет-бутилового спирта на превращенный олефин — 98%. Практически единственным побочным продуктом на этой стадии является этил-тре/п-бутиловый эфир этиленгликоля, образующийся при взаимодействии изобутилена с этилцеллозольвом. На стадии дегидратации этот эфир полностью разлагается на исходные вещества.
При взаимодействии окиси этилена с этиленгликолем получаются полигликоли (стр. 123) [c.131]
Полиэфиры, образующиеся при взаимодействии пропиленгликоля и себациновой кислоты, напоминают по своим свойствам каучук и могут быть вулканизированы при помощи перекиси бензоила. Соответствующие эфиры этиленгликоля — хрупкие смолы, размягчающиеся выше 74°. Присутствие лишней метильной группы в пропиленгликоле сильно влияет на физические свойства полиэфира себациновой кислоты, например на температуру размягчения, которая лежит ниже комнатной [34]. Продукты, полученные из полиэфиров пропиленгликоля, применяют в США в качестве каучуков специального назначения.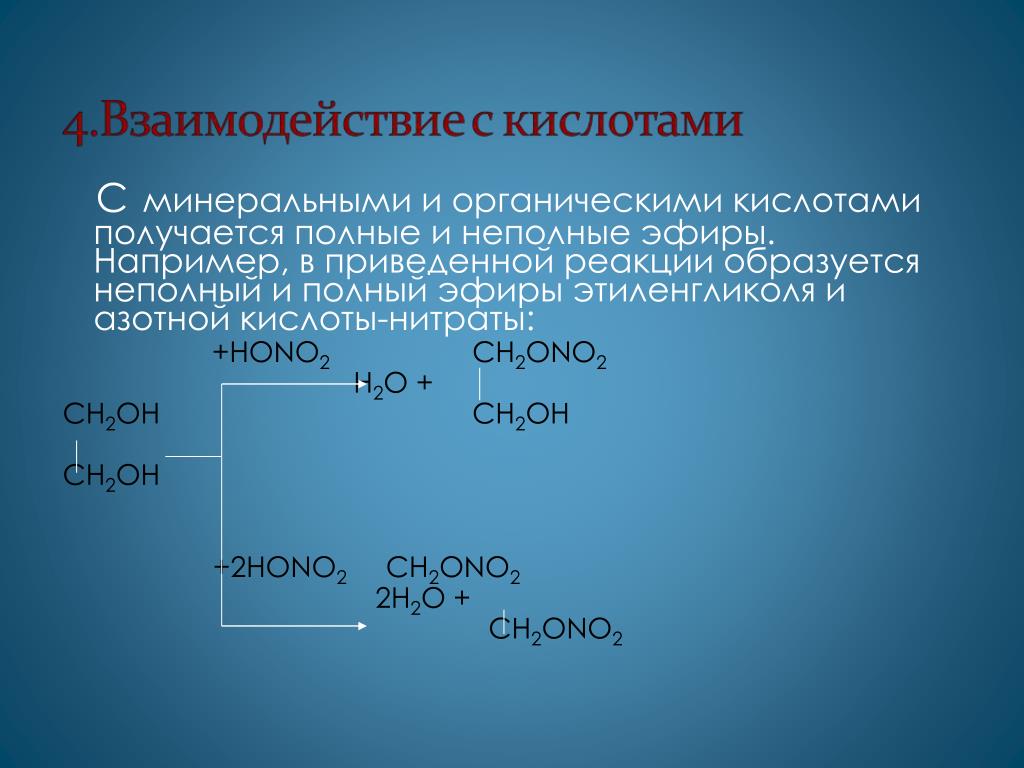
Процесс получения диэтиленгликоля включает следующие стадии приготовление шихты — водного раствора окиси этилена и этиленгликоля взаимодействие окиси этилена с этиленгликолем выпаривание водного раствора гликолей и ректификация концентрированного раствора гликолей. Технологическая схема процесса аналогична схеме процесса получения этиленгликоля (см. рис. 28, стр. 85), на одном и том же оборудовании могут производиться оба продукта [35, р. 41]. [c.134]
Полученный малеат этиленгликоля взаимодействует со сшивающим агентом — стиролом, — образуя полимер типа [c.294]
Коэффициент диффузии некоторого вещества в пиридине (т) = 0,95 спз) при 20° С равен 1-10 см /сек. Оценить значения коэффициентов диффузии этого вещества в ацетоне (т1=0,33 спз), этиленгликоле (т —16,9 спз), глицерине (т1=1500 спз).
Реакцией поликонденсации называют процесс взаимодействия большого числа молекул двух или нескольких разных мономеров с выделением соответствующего количества побочных низкомолекулярных продуктов реакции, например воды, спирта и др. Наличие этих продуктов обусловливает обратимость процесса. Элементарный состав полученного при этом высокомолекулярного соединения отличается от состава исходных мономеров, причем в ходе реакции молекулярная масса вещества постоянно возрастает. В процессе обычно участвуют функциональные группы СООН, ОН, ЫНг и др. Так, из этиленгликоля и терефталевой кислоты получают смолу лавсан [c.197]
Гафарова Ю.Т., Вострикова О.С., Злотский С.С., Докичев В.А. Получение моноэфиров этиленгликоля взаимодействием циклических этиленкеталей с алкилгалоидаланами // XII Всероссийская конференция по химическим реактивам, реагентам и процессам малотоннажной химии.
 Тезисы докладов. -Уфа-Москва, -1999. -С. 32. [c.23]
Тезисы докладов. -Уфа-Москва, -1999. -С. 32. [c.23]Терефталевая кислота (, 4-бензендикарбоновая, или п-фтале-вая) легко образует диметиловый эфир, который при взаимодействии с этиленгликолем дает полимерный продукт — полиэтилентере-фталат, используемый при производстве искусственного волокна — лавсана [c.324]
Окись этилена, а также этиленгликоль, взаимодействуя с сероводородом в контакте с ЛЬОз при 225°, дают насыщенные шестичленные гетероциклы с двумя гетероатомами в [c.82]
Этот вопрос настолько широк, что его можно включить в данную главу только схематически. Одно из направлений взаимодействия СО и водорода, которое привлекло наибольшее внимание,— образование этиленгликоля и других двух- и трехатомных спиртов. Реакция идет при чрезвычайно высоких давлениях на родийорганических комплексных катализаторах. Похоже, что высокие давления являются основным иреиятствием на пути практического освоения процесса. Для снижения требуемых давлений до приемлемого уровня, наиример 1000—5000 фунт/дюйм , была проделана большая работа.
Перейдем к следующему примеру. Заменим монофункциональную уксусную кислоту бифункщюнальной адипиновой кислотой и возьмем по две молекулы этиленгликоля и адипиновой кислоты. К каким последствиям приведет эта замена Как и следовало бы ожидать, одна молекула этиленгликоля, взаимодействуя с одной молекулой адипиновой кислоты, дает сложный моноэфир [c.47]
Этиленгликоль, обладая двумя функциональными (гидроксильными) группами, при взаимодействии с двухосновными кислотами образует термопластичные линейные полимеры. Поликонденсация двухоснов ных кислот с глицерином (трифункцио-нальное соединение) приводит к образованию термореактивных полимеров. [c.215]
Окись этилена — предщественник этиленгликолевого антифриза, полиэфирных волокон и этаноламинов, используемых, например, для удаления сероводорода из сжиженных газов в процессах рафинирования. Этиленгликоль получается при гидратации окиси этилена и моно-, ди- и триэтаноламинов при взаимодействии их с аммиаком [c.253]
Этиленгликоль получается при гидратации окиси этилена и моно-, ди- и триэтаноламинов при взаимодействии их с аммиаком [c.253]
ДИЭТИЛЕНГЛИКОЛЬ (дигликоль) 0(СН.2СН20Н)г — маслянистая бесцветная жидкость, т. кип. 245° С смешивается с водой, спиртом, ацетоном. Д. получают при взаимодействии этиленгликоля с оксидом этилена. Д. применяют как растворитель масел, нитроцеллюлозы, смол, в качестве пластификатора, в газовой промышленности в качестве осушителя газов и др. Д. входит в состав антифризов. [c.91]
Напишите реакцию взаимодействия диметилтере-фталата с этиленгликолем. Какое практическое значение имеет эта реакция [c.154]
Надежность полученных результатов возрастает, если имеет место образование нестойких комплексов между одной из сравниваемых неподвижных фаз и соединениями того или иного гомологического ряда. Так, непредельные углеводороды в узкой температурной области ( 20—65 °С) образуют п-комплексы с нитратом серебра, а при температурах до 100—130 °С — с нитратом таллия, растворенными в глицерине, ди-, триэтиленгликоле или поли-этиленгликоле-400.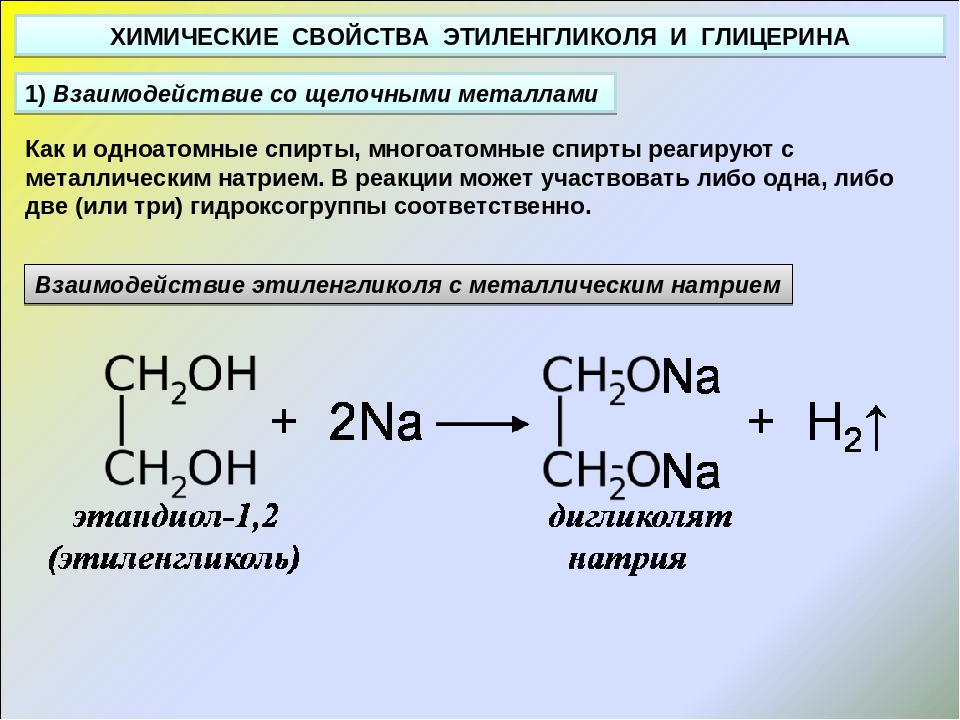 Первичные и вторичные амины в области температур 85—140 °С вступают в донорно-акцепторные взаимодействия с NaOH, а алкилпиридины способны образовывать ком- [c.182]
Первичные и вторичные амины в области температур 85—140 °С вступают в донорно-акцепторные взаимодействия с NaOH, а алкилпиридины способны образовывать ком- [c.182]
К. специфическому взаимодействию относится способность некоторых веществ образовывать комплексные относительно нестойкие соединения. Например, нитрат серебра, растворенный в таких неподвижных фазах, как этиленгликоль, глицерин, триэтиленгли-коль или бензилцианид, образуете олефинами комплекс, благодаря чему парафины легко отделяются от олефинов, задерживающихся на сорбенте. Смесь олефинов разделяется далее на индивидуальные вещества вследствие различия в стабильности образующихся комплексов, которая быстро падает при повышении температуры. [c.173]
Полученное соединение — этилснгликоль. Количество водорода, выделившегося при взаимодействии этиленгликоля с избытком натрия, составляет 1,6 (35,84 22,4) моля, что эквимолекулярно количеству этиленгликоля (уравнение 3). По условию задачи выход на каждой стадии синтеза — 80%, следовательно, количество этилена, которое потребовалось для получения этиленгликоля (уравнение 2) равно 1. 6-100 [c.202]
6-100 [c.202]
Задание 14
Задание 14.1
Из предложенного перечня выберите два вещества, с которыми реагирует формальдегид.
1) Cu
2) N2
3) H2
4) Ag2O (NH3 р-р)
5) CH3OCH3
Запишите в поле ответа номера выбранных веществ.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
Формальдегид взаимодействует с водородом с образованием метилового спирта (реакция гидрирования):
Формальдегид также взаимодействует с аммиачным раствором оксида серебра (I) (реакция серебряного зеркала):
Ответ: 34
Задание 14.2
Из предложенного перечня выберите два вещества, с которыми реагирует этиленгликоль.
1) 2-метилбутен-1
2) азот
3) бромоводород
4) пентин-2
5) уксусная кислота
Запишите в поле ответа номера выбранных веществ.
Решение
Этиленгликоль взаимодействует с бромоводородом с последовательным замещением гидроксильных групп на атомы брома с конечным образованием 1,2-дибромэтана:
Этиленгликоль также реагирует с уксусной кислотой с образованием сложного эфира:
Ответ: 35
Задание 14.3
Из предложенного перечня выберите два вещества, с которыми реагирует глицерин.
1) гидроксид меди (II)
2) кумол
3) бутадиен-1,3
4) натрий
5) медь
Запишите в поле ответа номера выбранных веществ.
Решение
Глицерин взаимодействует с гидроксидом меди (II) с образованием ярко-синего раствора глицерата меди (II):
Глицерин также реагирует с натрием с образованием моно-, ди- и тризамещённых продуктов:
Ответ: 14
Задание 14.4
Из предложенного перечня выберите два вещества, с которыми реагирует ацетальдегид.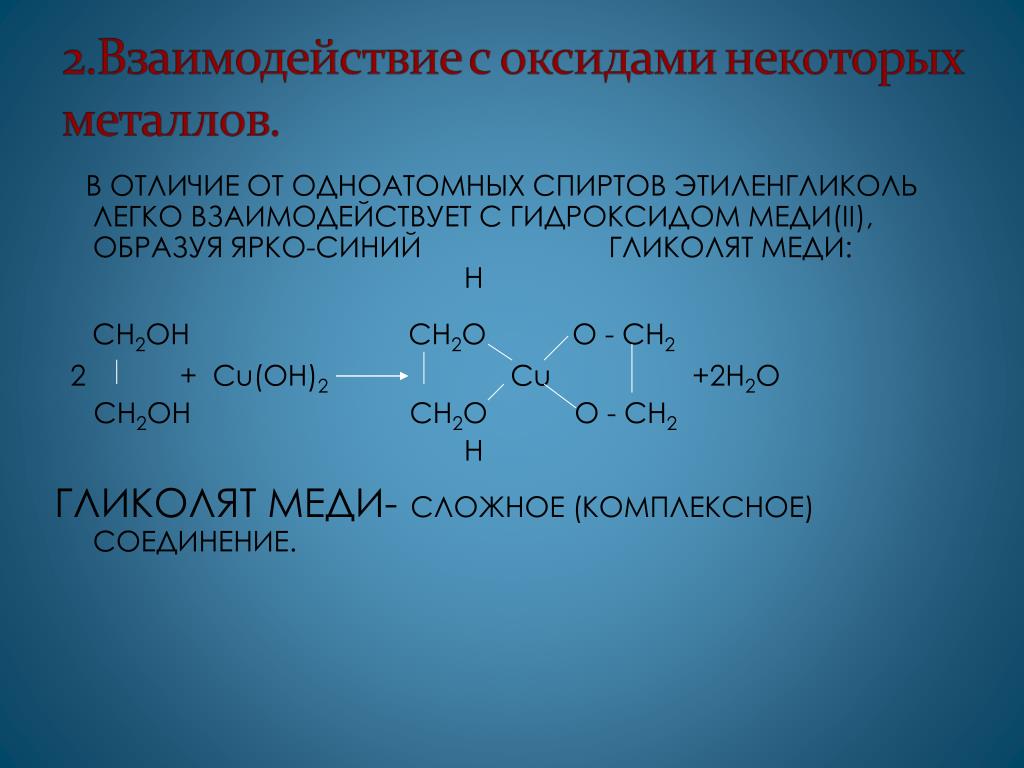
1) этан
2) этанол
3) медь
4) гидроксид меди (II)
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Решение
Ацетальдегид взаимодействует с этанолом с образованием полуацеталя:
Ацетальдегид также реагирует с гидроксидом меди (II) с образованием кирпично-красного осадка оксида меди (I):
Ответ: 24
Задание 14.5
Из предложенного перечня выберите два вещества, с которыми реагирует пропанол-1.
1) калий
2) этан
3) пентен-2
4) оксид алюминия
5) хлороводород
Запишите в поле ответа номера выбранных веществ.
Решение
Пропанол-1 взаимодействует с калием с образованием алкоголята:
Пропанол-1 также реагирует с хлороводородом с образованием хлорпропана:
Ответ: 15
Задание 14.6
Из предложенного перечня выберите два вещества, с которыми реагирует фенол.
1) этан
2) гидроксид натрия
3) изобутилен
4) азотная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Решение
Фенол взаимодействует с гидроксидом натрия с образованием фенолята натрия:
Фенол также реагирует с азотной кислотой с образованием 2,4,6-тринитрофенола (пикриновой кислоты):
Ответ: 24
Задание 14.7
Из предложенного перечня выберите два вещества, с которыми реагирует метанол.
1) карбонат натрия (р-р)
2) пропан
3) хлороводород
4) хлорид калия (р-р)
5) оксид меди (II)
Запишите в поле ответа номера выбранных веществ.
Решение
Метанол взаимодействует с хлороводородом с образованием хлорметана:
CH3-OH + HCl = CH3Cl + H2O
Метанол также реагирует с оксидом меди (II) с образованием формальдегида (метаналя):
CH3-OH + CuO = HC(O)H + Cu + H2O
Ответ: 35
Задание 14. 8
8
Из предложенного перечня выберите два вещества, с которыми реагирует муравьиная кислота.
1) гидроксид натрия
2) карбонат кальция
3) сульфат меди (II)
4) хлорид кальция
5) оксид углерода (II)
Запишите в поле ответа номера выбранных веществ.
Решение
Муравьиная кислота взаимодействует с гидроксидом натрия с образованием формиата натрия (реакция нейтрализации):
HC(O)OH + NaOH = HC(O)ONa + H2O
Муравьиная кислота также реагирует с карбонатом кальция с образованием формиата кальция:
2HC(O)OH + CaCO3 = (HC(O)O)2Ca + CO2↑ + H2O
Ответ: 12
Задание 14.9
Из предложенного перечня выберите два вещества, которые образуются при гидролизе метилацетата.
1) этанол
2) метанол
3) метан
4) уксусная кислота
5) муравьиная кислота
Запишите в поле ответа номера выбранных веществ.
Решение
Метилацетат (метиловый эфир уксусной кислоты) является сложным эфиром,
при гидролизе которого образуются исходные кислота (уксусная кислота) и спирт (метанол):
CH3-C(O)O-CH3 + H2O = CH3-C(O)OH + CH3OH
Ответ: 24
Задание 14.10
Из предложенного перечня выберите два вещества, с которыми не реагирует фенол.
1) азотная кислота
2) гидроксид калия (р-р)
3) этан
4) соляная кислота
5) бромная вода
Запишите в поле ответа номера выбранных веществ.
Решение
Фенол нитруется азотной кислотой, нейтрализуется раствором гидроксида калия, взаимодействует с бромной водой. Фенол не реагирует с этаном и соляной кислотой.
Ответ: 34
Задание 14.11
Из предложенного перечня выберите два вещества, которые образуются при гидролизе метилпропионата.
1) метанол
2) муравьиная кислота
3) пропан
4) пропанол-1
5) пропановая кислота
Запишите в поле ответа номера выбранных веществ.
Решение
Метилпропионат (метиловый эфир пропановой кислоты) является сложным эфиром,
при гидролизе которого образуются исходные кислота (пропановая кислота) и спирт (метанол):
CH3-CH2-C(O)O-CH3 + H2O = CH3-CH2-C(O)OH + CH3OH
Ответ: 15
Этиленгликоль. Применение, свойства, характеристики. Статьи компании «ООО «ХимЭлемент»»
Что такое этиленгликоль?
Этиленгликоль – это бесцветная вязкая жидкая субстанция, лишённая всяких ароматических признаков. Имеет некоторый сладкий вкус, выраженный не слишком отчётливо. Вещество токсично, относится к группе гликолей (двухатомные спирты). Получен данный реактив лабораторными методами в середине девятнадцатого столетия. Длительное время оставался лабораторным веществом, не имеющим никакого применения в хозяйственных целях. Однако в к началу двадцатого века выяснилось, что данный химикат может с успехом заменить глицерин необходимый при производстве взрывчатых веществ и боеприпасов.
Получен данный реактив лабораторными методами в середине девятнадцатого столетия. Длительное время оставался лабораторным веществом, не имеющим никакого применения в хозяйственных целях. Однако в к началу двадцатого века выяснилось, что данный химикат может с успехом заменить глицерин необходимый при производстве взрывчатых веществ и боеприпасов.
Этиленгликоль (формула вещества C2H6O2) – первый в ряду гликолей, органических веществ, имеющих в составе по 2 гидроксильных группы (О – Н) и сходных по внешнему виду, химическому составу и свойствам.
Свойства этиленгликоля
Смешивается с водой, спиртами. Вещество сильно гигроскопично, взрыво- и пожароопасно, что, как уже было сказано, повлияло на его практическое использование в производственных целях.
Вместе с тем, данный химикат имеет низкую температуру замерзания (-12,9°С) и высокую температуру кипения (+197°С). Вязкость этиленгликоля обусловлена плотностью вещества 1,113 г/см³, которая более чем на десять процентов выше, чем плотность воды.
Химические свойства этиленгликоля сходны со свойствами одноатомных спиртов. Вещество способно вступать в реакции с представителями группы щелочных металлов, образовывая при этом гликоляты (полные и неполные). Этиленгликоль взаимодействует с гидроксидами металлов, с органическими и неорганическими кислотами и другими веществами.
Применение этиленгликоля
Несмотря на то, что первоначальной отраслью, в которой нашёл своё применение этот химикат, было производство взрывчатых веществ, в наши дни для этих целей используются более дешёвые и более мощные аналоги. Но этиленгликоль по-прежнему широко эксплуатируется в промышленном производстве, только теперь уже в других отраслях.
Чаще это оказываются сферы, производящие различные жидкости технического назначения. Низкая температура кристаллизации и невысокая стоимость данного продукта послужили тому, что примерно 60% производимого современной химической индустрией этиленгликоля поступает в изготовление антифризов и прочих веществ.
Кроме того, этот химикат используется в качестве сырья для синтеза широкой номенклатуры полимерных материалов. Таких, как полиуретаны, полиэтилентерефталат и прочее. Из них производят пластиковую тару (бутылки и прочие изделия), волоконную, плёночную продукцию и многое другое.
Всё более широкую распространённость получает этот материал в качестве теплоносителя. Этиленгликоль мало пригоден для этих целей в чистом виде, однако популярны в этой отрасли его водные растворы с различной концентрацией. У этих разновидностей теплоносителей температура замерзания ниже нуля и температура закипания заметно выше ста градусов по Цельсию. Однако есть ещё кое-что, что выгодно отличает эти смеси от воды. Водные растворы этиленгликоля, даже при их охлаждении до температуры застывания, не превращаются в ледяные глыбы, способные порвать стенки трубопроводов и прочие элементы отопительных систем. Они при замерзании превращаются в желеподобную субстанцию, которая не наносит никакого вреда ни трубам, ни котлам. А при повышении температуры, снова возвращается в жидкое агрегатное состояние и может далее эксплуатироваться по назначению.
А при повышении температуры, снова возвращается в жидкое агрегатное состояние и может далее эксплуатироваться по назначению.
А также с применением этиленгликоля производятся жидкости для гидравлической техники. В чистом виде этот продукт в данной отрасли почти не применяется, но часто используется в качестве компонента этих технических жидкостей.
Помимо всего названного в химическом промышленном производстве пригодились растворяющие свойства этого вещества. Его применяют, как растворитель, как пластифицирующий агент при получении различных полимерных материалов, резинотехнических изделий и прочих видов продукции.
Токсичность этиленгликоля
Данный реактив принадлежит к группе химикатов среднего уровня токсичности. Что означает, что его нельзя употреблять внутрь, смертельная доза этого вещества в зависимости от условий может составлять от 100 до 150 г. Однако отравление этиленгликолем может наступить не только при случайном проглатывании указанных доз этого продукта. Опасны и испарения этого соединения, которые кроме того, что способны образовывать взрывоопасные паровоздушные смеси с атмосферным воздухом, могут крайне негативно влиять на состояние здоровья при длительном вдыхании этих паров.
Опасны и испарения этого соединения, которые кроме того, что способны образовывать взрывоопасные паровоздушные смеси с атмосферным воздухом, могут крайне негативно влиять на состояние здоровья при длительном вдыхании этих паров.
Химикат не является легкоподвижным и подверженным обильному испарению, поэтому накапливать опасное количество паровоздушных смесей быстро не способен. Однако класс опасности этиленгликоля предписывает обязательное соблюдение всего свода правил техники безопасности при работе с данной группой веществ. Также к числу обязательных условий его безопасной эксплуатации стоит отнести обязательное оснащение всех рабочих помещений приточно-вытяжными вентиляционными системами достаточной эффективности. И использование рабочим персоналом индивидуальных средств защиты органов дыхания.
Получение этиленгликоля
На данный момент существует несколько методов синтеза этого соединения. Наиболее распространённый в химическом производстве метод заключается в каталитической гидратации оксида этилена.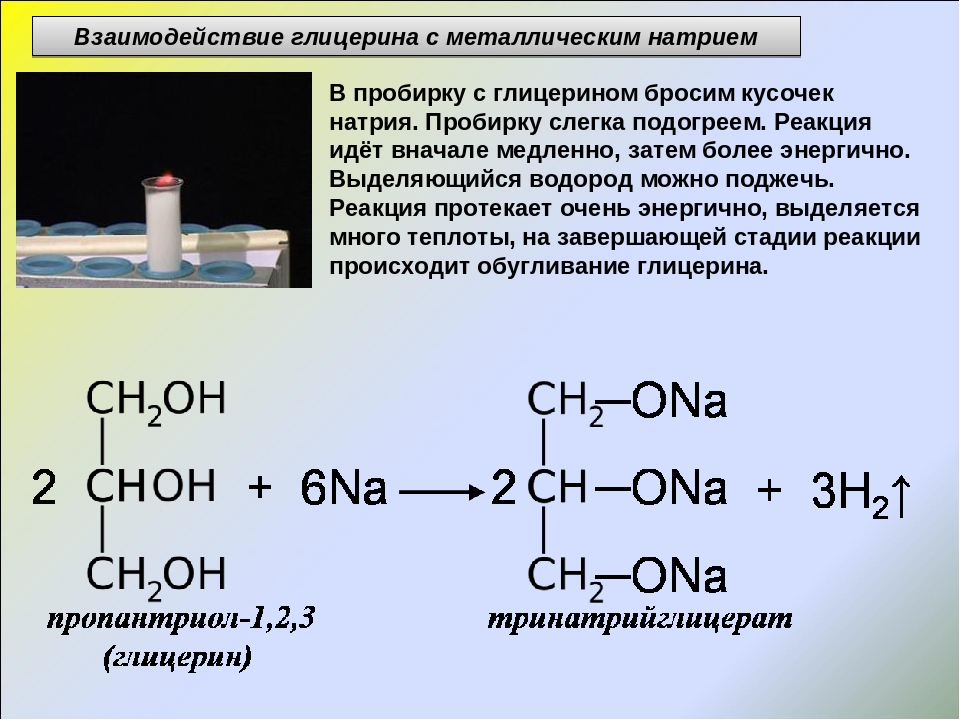 Условия данного химического взаимодействия предусматривают давление на уровне десяти атмосфер, и повышение температуры до 200 °C. Полученный в процессе описанной реакции продукт содержит порядка 90% этиленгликоля и некоторое количество примесей, состоящих их других гликолей более высокого порядка и определённого количества высших полимеров.
Условия данного химического взаимодействия предусматривают давление на уровне десяти атмосфер, и повышение температуры до 200 °C. Полученный в процессе описанной реакции продукт содержит порядка 90% этиленгликоля и некоторое количество примесей, состоящих их других гликолей более высокого порядка и определённого количества высших полимеров.
Существует ещё один более старый метод, который сейчас, большей частью, снят с вооружения в химической индустрии. Он заключается в гидролизе группы веществ сложных эфиров. В этом случае также получался конечный продукт не в чистом виде, а с некоторым количеством примесей. В качестве примесей в этом случае оказывалась группа кислот, удаляющихся при дальнейшей обработке.
Интернет-магазин ХимЭлемент реализует широчайший ассортимент химической продукции. Этиленгликоль купить оптом вы можете в нашем магазине на наиболее выгодных в Украине условиях.
Химические свойства многоатомных спиртов | Химия онлайн
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
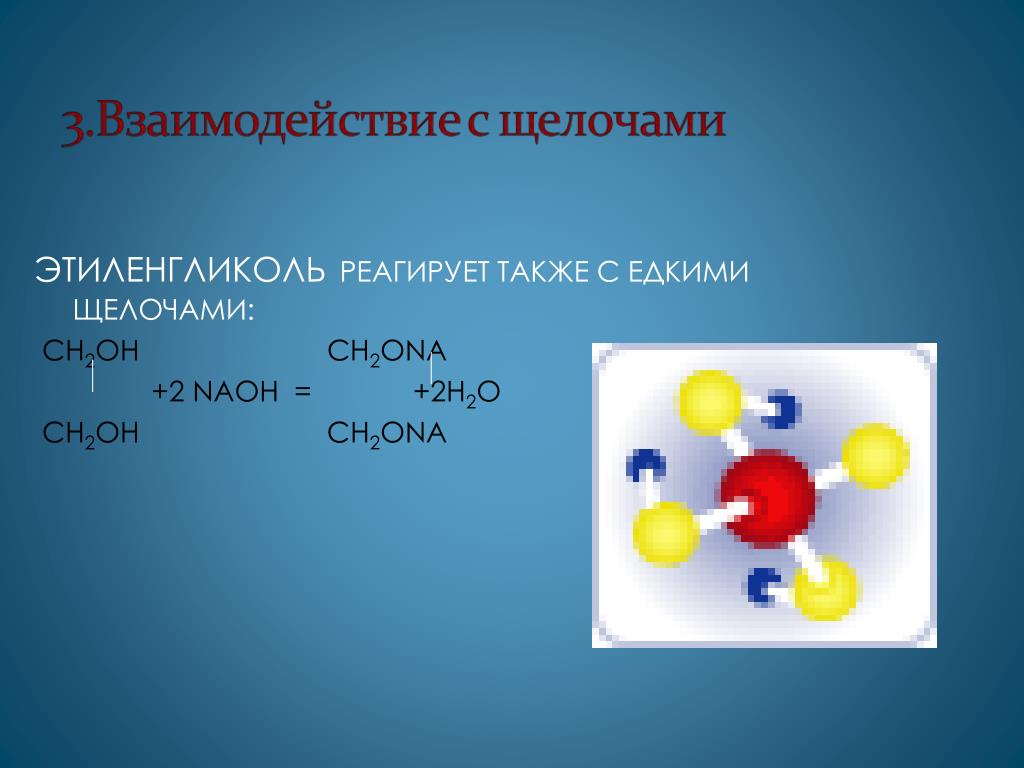
Кислотные свойства1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
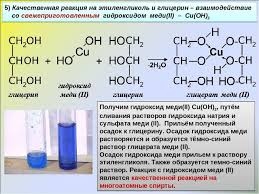
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
Глицерат меди
Упрощенная схема
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
Многоатомные спирты
Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение
13.01.2014г. 33 урок 10 класс
Урок на тему: Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение.
Цели урока: выяснить, какие спирты относятся к многоатомным, изучить
физические и химические свойства, применение, развивая
познавательную активность и самостоятельность учащихся в
учебной работе.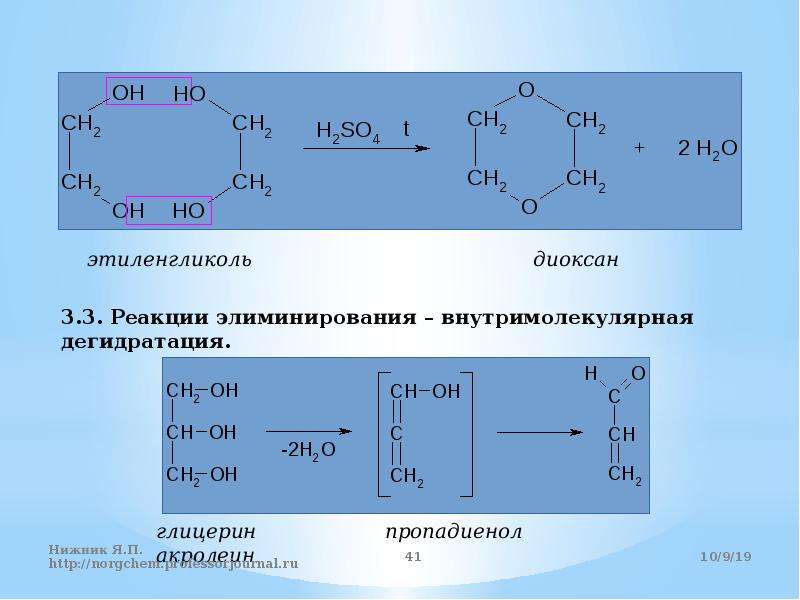
Оборудов: глицерин, свежеприготовленный гидроксид меди, азотная
кислота, активный Ме- Nа, спиртовка.
План изучения темы:
1. Опрос в виде тестирования.
2. Изучение новой темы:
а) Получение многоатомных спиртов.
б) Физические свойства.
в) Химические свойства (опыты).
г) Применение (сообщение).
3. Закрепление (оценки учащихся).
4. Задание на дом § 2 гл.VII, П. 17
На доске написаны формулы разных веществ, учащиеся должны выбрать формулы известных им веществ, дать им названия (дать понятие, что такое спирт).Указать (учитель) какие формулы относятся к многоатомным спиртам и дать понятие.
СН3 — СН 2 — СН3 ; СН2 = СН — СН 3 СН2 — СН — СН3
С 4 Н 6 СН3 — СНОН — СН 3 ОН ОН
пропанал — 2 пропанал -1,2
СН2 ОН – СНОН – СН 2 ОН (пропиленгликоль)
глицерин ( 1,2,3 пропантриал)
1. К многоатомным спиртам относятся органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом.
К многоатомным спиртам относятся органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом.
2. Физические свойства (сходства и отличия).
Этиленгликоль и глицерин – бесцветные сиропообразные жидкости, сладкие на вкус. Очень хорошо растворяются в воде и в этаноле (одноатом. спирт).
Этиленгликоль кипит при температуре – 197,6 С — очень ядовитое вещество!
Глицерин – трудно кристаллизуется , плавления 17 С, очень гигроскопичен, кипит при t 2900С (Таблица).
3. Химические свойства многоатомных спиртов сходны с химическими свойствами одноатомных спиртов.
1. реагируют с активным Ме.
СН2 — ОН СН 2 — О — N а
\ + 2 N а \ + Н2
СН2 — ОН СН2 — О — Nа
этилат натрия
2. В отличии от одноатомных реагируют со щелочами.
В отличии от одноатомных реагируют со щелочами.
СН2 — СН2 СН2 — СН2
\ \ + 2NaOН = \ \ + 2Н 2О
ОН — ОН О N а О N а
3. С галогенводородами:
СН2 — СН2 СН2 — СН2
\ \ +2НСl \ \ + 2Н2О
ОН — ОН Сl Сl
1,2 дихлорэтанол
4. Демонстрируем опыты.
Качественной реакцией на многоатомные спирты является ярко-синее
окрашивание при действии свежеосажденного гидроксида меди (II).
СН2 — ОН СН2 — ОН НО -СН2
Н
2 СН — ОН + Си (ОН) 2 NаОН СН — О О — СН + 2Н2 О
Си
СН2 — ОН СН2 — О О СН2
Н
глицерат меди
(Черточками обозначены донорно — акцепторные связи).
5. Демонстрируем опыты.
При взаимодействии с Н О образуется сложный эфир (нитроглицерин).
СН2 — ОН СН2 — О — NО2
\ Н 2SO4 \
СН — ОН + 3Н N О3 = СН — О — NО2 + 3Н2 О
\ \
СН2 — ОН СН2 — О — NО2
нитроглицерин
4. Получение
а) получение этиленгликоля при окислении этилена перманганатом калия. КМпО4
СН 2 = СН2 + Н2 О СН 2 — СН2
этилен
ОН ОН
б) получение гидролизом галогенпроизводных
СН 2 — СН2 СН 2 — СН 2 нейтрализуют
+ 2 Н2 О + 2НСl щелочью
С l — Сl ОН ОН
в) глицерин на производстве получают из пропилена, который образуется
при крекинге и пиролизе нефти.
Крекинг – расщепление углеводов нефти, сопровождающиеся
изменением углеродов ( термический и каталитический).
Пиролиз – разложение углеводов на более легкие и ароматизация их;
а также гидролизом жиров.
О О
СН2 — О — С НО — Н СН 2 — ОН R1 — С
R1 ОН
О ферменты О
СН — О — С + НО — Н СН — ОН + R 2 — С
R2 ОН
О О
СН2 — О — С НО — Н СН2 — ОН R3 — С
жир R3 глицерин ОН
карбоновые
кислоты
5. Применение (сообщение).
Этиленгликоль — для приготовления антифризов (незамерзающая
жидкость, используемая в радиаторах автомобилей в
зимний период.
— для синтеза лавсана, для производства взрывчатых
веществ, пластмасс.
Глицерин — для нитроглицерина и динамита.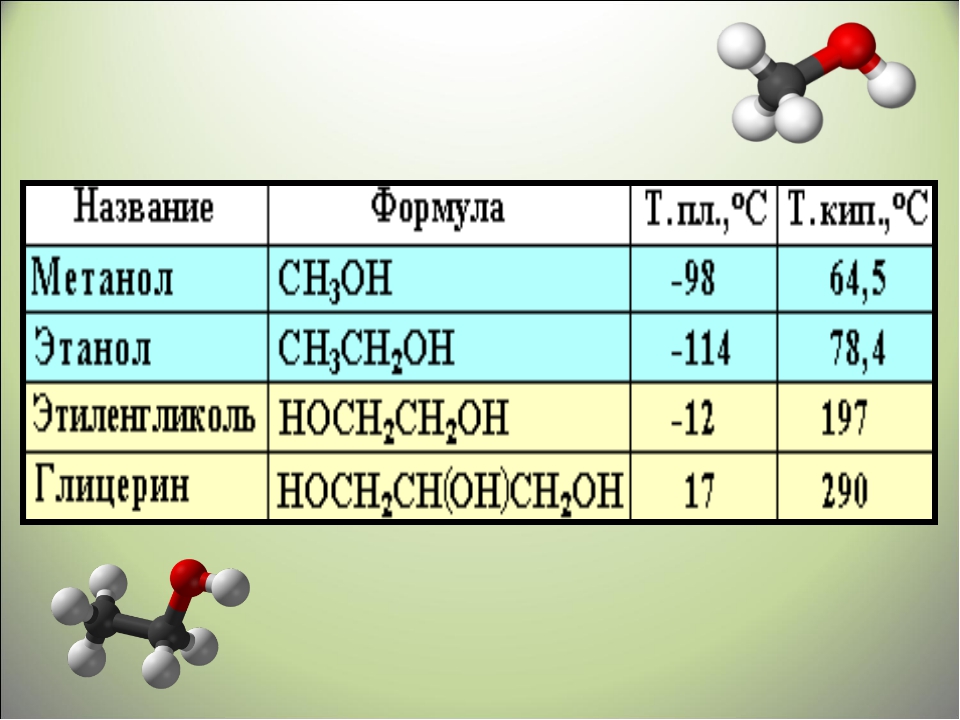
— в парфюмерии и медицине (для мазей),для предохранения
кожи от высыхания.
— в текстильной промышленности.
— для придания тканям мягкости и эластичности, 1% раствор
нитроглицерина в спирте, как средство расширяющее
кровеносные сосуды.
— добавка глицерина к этиленгликолю удлиняет срок службы
водяных насосов автомашин.
Домашнее задание § 2 глVII Заполнить таблицу (схему).
Классификация спиртов
Спирты
Одноатомные Одноатомные Многоатомные
предельные непредельные
СН2 — СН = СН2 СН2 — ОН СН2 — СН — СН3
С 2 Н 5 ОН ОН СН — ОН ОН ОН
этанол 1 пропен 3ол пропандиол 1,2
СН2 — ОН
глицерин
пропантриол 1,2,3
Литература
Г.
 Е. Рудзитис. Химия – 10. М., 1998 г.
Е. Рудзитис. Химия – 10. М., 1998 г.А.А. Макареня. Повторим химию. М., 1989 г.
И.Г. Хомченко. Сборник задач по химии. М., 1989 г.
Ю.И. Смирнов. Мир химии. Санкт- Петербург. 1995 г.
В.В. Усяк. Повторим химию. Чебоксары. 1999г.
Н.М. Кузьменок. Экология на уроках химии. Минск 1996 г.
Тест
1. Алкоголи имеют общую формулу:
а) R — СООН; б) R — ОН; в) R — СОН.
2. Атомность спиртов определяется:
а) числом атомов кислорода; б) числом гидроксидных групп.
3. Спирты получаются:
а) восстановление алканов; б) окислением алканов.
4. Из предложенного набора свойств этанола выберите главные:
а) горючь; б) жидкость; в) смешивается с водой в любых отношениях;
г) способен дигидратироваться; д) получается брожением глюкозы;
е) получается гидратацией этилена; ж) кислородосодержащее соединение;
з) бесцветное вещество; и) взаимодействует с Nа.
5. Этанол является исходным сырьем для получения:
а) ацетилена; б) этилена.
6. Дегидратация – это:
а) отщепление водорода; б) отщепление воды.
7. Сколько изомеров может быть у вещества С4 Н 10 О?
а) 4; б) 6; в) 2.
8. Какова массовая доля этилового спирта в растворе, получением 1 моля
этанола в воде массой 184 гр.
а) 10 %; б) 20%; в) 30 %; г) 40 5; в) 10 %.
( приведите свои расчеты).
9. Спирты могут: а) окислятся; б) восстанавливаться.
10. Из этилового спирта получают:
а) каучук; б) полиэтилен.
Ответы: 1б; 2б; 3б; 4а; в; д; ж; и; 5 б; 6б; 7а;
8 г). Мп ( С Н ОН) = 12 2 + 1 6 + 16 =46
184 : 46 = 4=40 % 9 а; 10 а.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.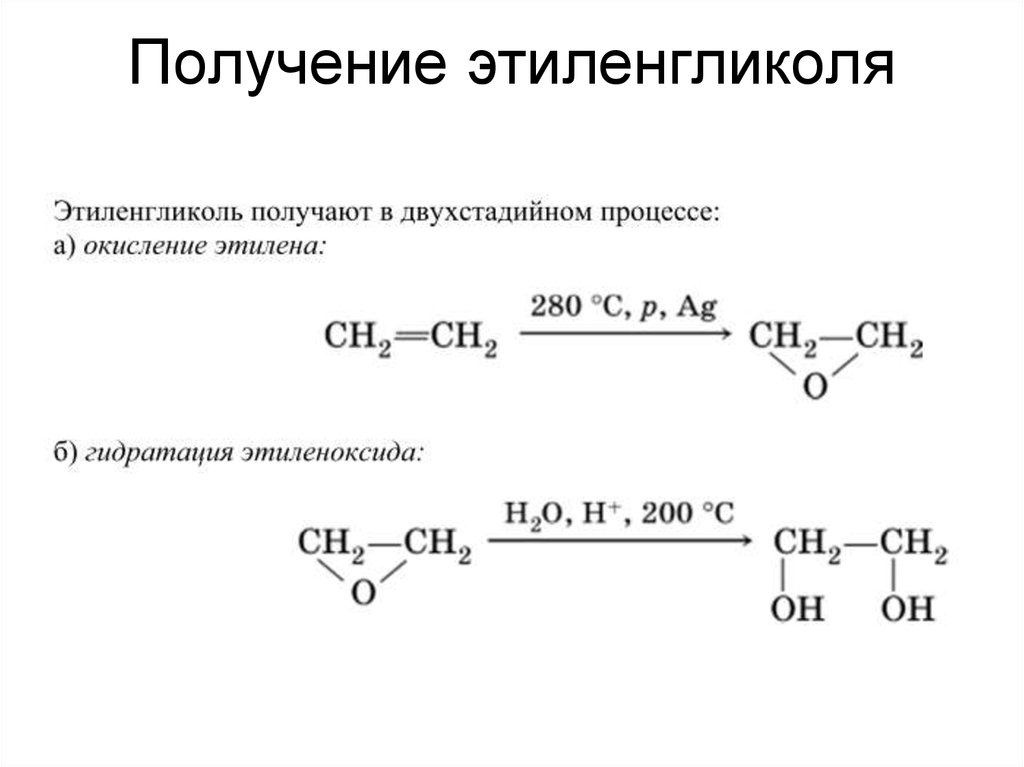
Влияние этиленгликоля на структуру и стабильность Мономер отличается от мономера его полимеров
Abstract
Исследование изменений термических
устойчивости и структуры
белков в присутствии различных сорастворенных веществ (лигандов) является
неотъемлемая часть фундаментальных исследований, открытия и развития
наркотики. Этиленгликоль (ЭГ) токсичен и вызывает тератогенные эффекты.
вызывая, прежде всего, скелетные и внешние пороки развития и другие заболевания.Влияние ЭГ на структуру и термическую стабильность миоглобина.
(Mb) исследовали различными спектроскопическими методами при pH 7,0.
и две разные температуры. Как показал круговой дихроизм,
Измерения флуоресценции Trp, нано-DSF и поглощения (УФ и видимый),
EG (i) не оказывает значительного влияния на вторичные и третичные структуры.
Mb при 25 ° C, и (ii) это снижает термическую стабильность
белок, который увеличивается с увеличением концентрации ЭГ.
По данным флуоресценции ANS (8-анилино-1-нафталинсульфоновая кислота)
По измерениям, денатурированный при нагревании белок обнаружил гидрофобные
патчи, которые привязываются к ANS. Обнаружена изотермическая калориметрия титрования
что взаимодействие между EG и Mb зависит от температуры; в
предпочтительное взаимодействие EG обусловлено энтропией при низкой температуре,
298 K (25 ° C), и это обусловлено энтальпией при более высокой температуре,
343 К (70 ° С). Исследование молекулярного докинга показало, что ЭГ взаимодействует
с боковыми цепями аминокислотных остатков Mb через ван-дер-ваальсовую
взаимодействия и водородные связи.
Обнаружена изотермическая калориметрия титрования
что взаимодействие между EG и Mb зависит от температуры; в
предпочтительное взаимодействие EG обусловлено энтропией при низкой температуре,
298 K (25 ° C), и это обусловлено энтальпией при более высокой температуре,
343 К (70 ° С). Исследование молекулярного докинга показало, что ЭГ взаимодействует
с боковыми цепями аминокислотных остатков Mb через ван-дер-ваальсовую
взаимодействия и водородные связи.
1. Введение
Значительные усилия были
были посвящены исследованию потенциала
эффекты макромолекулярного краудинга на сворачивание белка и краудер-белок
взаимодействия.Структурные и термодинамические исследования белков в
стесненные и ограниченные условия in vitro (1-8) были использованы для описания in vivo белка поведение, на которое влияет преобладание различных типов взаимодействий
происходящие в клетках. 8−13 В 2008 г. Zhou et al. 8 представил продуманный
аргумент в их обзоре, в котором полиэтиленгликоль (ПЭГ) должен
следует избегать как фактор скопления людей именно из-за его потенциала
для благоприятного взаимодействия с белками, которые предназначены
быть переполненным. В результате PEG сейчас быстро становится чем-то вроде
изгнанник в сообществе макромолекулярного скопления. Конечно, если
намерение состоит в том, чтобы специально разделить вклады из исключенного тома
эффекты, то такое отстранение от PEG имеет смысл. Интересно,
появилась новая информация о природе взаимодействий ПЭГ-белок.
недавно наблюдалась группой Кроули, которая проводила ЯМР-исследования
изучить взаимодействие между ПЭГ и небольшим модельным белком.
цитохром c. (14) Многие лечебные
белки были связаны с полиэтиленгликолем, чтобы продлить их
циркулирующие продолжительность жизни и увеличивают свою активность in vivo . 15-17 ПЭГ были успешно использованы для повышения активности ферментов
из них 1-аспарагиназа 18 и
аденозиндезаминаза 19 являются прекрасными примерами.
3-5 нитей ПЭГ с молекулярной массой> 30 кДа были
наблюдаемый
более эффективен, чем 7–15 нитей низкомолекулярного ПЭГ
(5 кДа) для сохранения биологической активности, увеличения плазменной
стойкость и снижение антигенности коровьего и рекомбинантного
супероксиддисмутаза человека (СОД).
В результате PEG сейчас быстро становится чем-то вроде
изгнанник в сообществе макромолекулярного скопления. Конечно, если
намерение состоит в том, чтобы специально разделить вклады из исключенного тома
эффекты, то такое отстранение от PEG имеет смысл. Интересно,
появилась новая информация о природе взаимодействий ПЭГ-белок.
недавно наблюдалась группой Кроули, которая проводила ЯМР-исследования
изучить взаимодействие между ПЭГ и небольшим модельным белком.
цитохром c. (14) Многие лечебные
белки были связаны с полиэтиленгликолем, чтобы продлить их
циркулирующие продолжительность жизни и увеличивают свою активность in vivo . 15-17 ПЭГ были успешно использованы для повышения активности ферментов
из них 1-аспарагиназа 18 и
аденозиндезаминаза 19 являются прекрасными примерами.
3-5 нитей ПЭГ с молекулярной массой> 30 кДа были
наблюдаемый
более эффективен, чем 7–15 нитей низкомолекулярного ПЭГ
(5 кДа) для сохранения биологической активности, увеличения плазменной
стойкость и снижение антигенности коровьего и рекомбинантного
супероксиддисмутаза человека (СОД). 20 PEG-опосредованный
стабилизация белка предполагает, что конформационное изменение
произошла в белке после взаимодействия с ПЭГ и продемонстрировала
высочайшая стабильность белка при оптимальном молярном соотношении БСА: ПЭГ. 21 EG может оказаться реагентом, который относительно
инертен для большинства белков. 22 Имеет
было замечено, что нативная конформация γ-глобулина и
β-лактоглобулин, по-видимому, остается стабильным в присутствии
очень высокая концентрация ЭГ. 22 Напротив,
Есть несколько исследований, в которых было обнаружено, что ПЭГ дестабилизирует
структуры белков. Наблюдалось, что ЭГ снижает плавление
в рибонуклеазе примерно на 7,5 ° C. 23 Интересно, что полиолы стабилизируют
химотрипсиноген, тогда как EG снижает свою температуру плавления ( T m ) с увеличением концентрации. 24,25
20 PEG-опосредованный
стабилизация белка предполагает, что конформационное изменение
произошла в белке после взаимодействия с ПЭГ и продемонстрировала
высочайшая стабильность белка при оптимальном молярном соотношении БСА: ПЭГ. 21 EG может оказаться реагентом, который относительно
инертен для большинства белков. 22 Имеет
было замечено, что нативная конформация γ-глобулина и
β-лактоглобулин, по-видимому, остается стабильным в присутствии
очень высокая концентрация ЭГ. 22 Напротив,
Есть несколько исследований, в которых было обнаружено, что ПЭГ дестабилизирует
структуры белков. Наблюдалось, что ЭГ снижает плавление
в рибонуклеазе примерно на 7,5 ° C. 23 Интересно, что полиолы стабилизируют
химотрипсиноген, тогда как EG снижает свою температуру плавления ( T m ) с увеличением концентрации. 24,25
Известны агенты краудинга фиколл 70 и декстран 40 и 70.
белок
стабилизаторы, а стабилизация белков обусловлена их преимущественным
исключение из белкового домена. 26−28 Напротив, эти
агенты краудфандинга, использованные Malik et al. 3 вносят существенную дестабилизацию нативного состояния МБ. Этот
наблюдение показывает, что эффект макромолекулярных краудеров может
быть достаточно специфичным для белка. ПЭГ 8 кДа искажает структуру Mb; тем не мение,
EG, мономер PEG, не оказывает видимого влияния на структуру Mb. 2 Недавно в нашей лаборатории наблюдали
что ПЭГ дестабилизируют Mb и cyt c и дают промежуточные
состояния. 5,29,30
26−28 Напротив, эти
агенты краудфандинга, использованные Malik et al. 3 вносят существенную дестабилизацию нативного состояния МБ. Этот
наблюдение показывает, что эффект макромолекулярных краудеров может
быть достаточно специфичным для белка. ПЭГ 8 кДа искажает структуру Mb; тем не мение,
EG, мономер PEG, не оказывает видимого влияния на структуру Mb. 2 Недавно в нашей лаборатории наблюдали
что ПЭГ дестабилизируют Mb и cyt c и дают промежуточные
состояния. 5,29,30
В этом
работы, структурное и термическое исследование разворачивания было
выполняется на МБ в присутствии разных концентраций ЭГ
с использованием различных спектроскопических методов и нанодифракционного сканирования
флуориметрия (нано-DSF). При нагревании Мб в присутствии ЭГ Trp-гем
разделение увеличивается при более высокой температуре, как показывает мониторинг
термическая денатурация с помощью нано-DSF.Кроме того, чтобы оценить привязку
параметры взаимодействия МБ с ЭГ, изотермическое титрование
калориметрические (ITC) исследования проводились при 295 K (25 ° C) и
343 K (70 ° C), что показало, что ЭГ преимущественно взаимодействует с
сильно с денатурированным Мб при высокой температуре. Молекулярный док
были проведены исследования с целью узнать сайты на Мб, в которых задействованы
в привязке с EG.
Молекулярный док
были проведены исследования с целью узнать сайты на Мб, в которых задействованы
в привязке с EG.
2. Результаты
2.1. Абсорбция Исследования
Влияние разные концентрации (0, 50, 100, 150, 200, 250, 300 и 350 мг / мл –1 ) ЭГ на полосе поглощения Соре Mb показан в А.На вставке к этому рисунку показан график коэффициента поглощения. при 409 нм (ε 409 ) [EG], концентрация EG (мг мл –1 ), что показывает, что ЭГ не влияет на ε 409 . Красные, зеленые и черные кружки показывают перенесенные точки данных. в трех экземплярах. Влияние ЭГ (0, 300 и 350 мг / мл –1 ) на поглощение Mb в ближней УФ-области (310–240 нм) было оценено как также определяется, что показано на вставке B. На этом рисунке видно, что EG делает не нарушать среду ароматическими остатками.
(А) Спектры поглощения
МБ в присутствии разных концентраций
ЭГ (0–350 мг / мл –1 ) при pH 7,0 и 25 ° C.
На вставке показан график зависимости ε 409 от [EG], где каждая точка
представляет собой среднее значение, полученное по результатам трех измерений. (В)
Спектры поглощения Mb в ближнем УФ и Соре в присутствии различных
концентрации (0, 300 и 350 мг / мл –1 ) ЭГ при
pH 7,0 и 25 ° C.
(В)
Спектры поглощения Mb в ближнем УФ и Соре в присутствии различных
концентрации (0, 300 и 350 мг / мл –1 ) ЭГ при
pH 7,0 и 25 ° C.
2.2. Круговой Исследования дихроизма (CD)
2.2.1. Дальний УФ CD
Спектры КД Mb (без EG) напоминают типичную α-спираль с отрицательным полосы при 208 и 222 нм (см. A).A не показывает значительного изменения в спектре КД Mb в наличие всех концентраций ЭГ. Врезка этого рисунка показывает график средней эллиптичности остатка, [θ] 222 по сравнению с [EG] в миллиграммах на литр (мг · мл -1 ), что означает отсутствие значительных изменений в [θ] 222 и [θ] 208 в структуре. Врезка этого рисунка также показаны красные, зеленые и черные круги, которые являются точками данных измерения в трех экземплярах. [θ] 222 значения родного белка в присутствии ЭГ (300 и 350 мг / мл –1 ) приведены в таблице 1.
(A) Спектры КД в дальней УФ-области спектра Mb в присутствии различных концентраций
ЭГ (0–350 мг / мл –1 ) при pH 7,0 и 25 ° C. На вставке показан график зависимости [θ] 222 от [EG], где каждый
точка — это среднее значение, полученное по результатам трех измерений. (B) Ближний УФ
КД МБ в присутствии разных концентраций ЭГ (0, 300,
и 350 мг / мл –1 ) при pH 7,0 и 25 ° C.
На вставке показан график зависимости [θ] 222 от [EG], где каждый
точка — это среднее значение, полученное по результатам трех измерений. (B) Ближний УФ
КД МБ в присутствии разных концентраций ЭГ (0, 300,
и 350 мг / мл –1 ) при pH 7,0 и 25 ° C.
Таблица 1
Спектральные свойства миоглобина в Отсутствие и присутствие EG (300 и 350 мг / мл –1 ) при pH 7.0 a
| ANS I max (λ max , нм) | ||||||||
|---|---|---|---|---|---|---|---|---|
| ε 280 (M –1 см –1 ) | F 335 | [θ] 272 ( град. см 2 дмоль –1 ) см 2 дмоль –1 ) | [θ] 222 град. см 2 дмоль –1 | при 25 ° C | при 70 ° C | |||
| буфер | 171,645 (± 285) | 37,559 (± 57) | 2.64 (± 0,17) | 182 (± 6) | –26,190 (± 218) | 4,48 (512) | 6,8 (499) | |
| 300 мг мл –1 EG | 171 462 (± 299) ) | 37 425 (± 150) | 2,51 (± 0,11) | 181 (± 3) | –27 104 (± 150) | 9,93 (518) | 23,73 (499) | |
| 350 мг мл –1 EG | 167,346 (± 172) | 37 641 (± 191) | 2,49 (± 0,13) | 2,49 (± 0,13) 90 | 183 (± 3) | –27 023 (± 118) | 10. 59 (520) 59 (520) | 34,9 (501) |
2.2.2. Ближний УФ CD
Для сравнения наблюдения Из измерений поглощения в ближнем УФ-диапазоне (B) КД в ближнем УФ-диапазоне использовался для исследования влияние ЭГ в более высоких концентрациях (300 и 350 мг / мл –1 ) на Trp и Tyr окружение Mb. B показывает КД Мб в ближнем УФ-диапазоне в отсутствие и наличие EG (300 и 350 мг / мл –1 ). B показывает, что спектр Mb не изменялся в присутствии EG даже при более высоких концентрации.[θ] 272 значения Mb при наличии ЭГ (0, 300 и 350 мг / мл –1 ) приведены в таблице 1.
2.3. Исследования собственной флуоресценции
показывает график зависимости
интенсивность флуоресценции в зависимости от длины волны. Этот рисунок показывает, что там
нет изменения флуоресценции Trp при увеличении [EG] от 0 до 350
мг мл –1 , т.е. расстояние гема и Trp в МБ равно
невозмутимый в присутствии ЭГ при всех концентрациях. Врезка
на этом рисунке показан график интенсивности флуоресценции при 335 нм ( F 335 ) в зависимости от [EG], где видно, что флуоресценция
интенсивность МБ остается неизменной при увеличении концентрации
НАПРИМЕР.Красные, зеленые и черные кружки на вставке этого рисунка
точки данных трехкратных измерений. F 335 значения Mb при различных концентрациях ЭГ (0,
300 и 350 мг / мл –1 ) приведены в таблице 1.
Врезка
на этом рисунке показан график интенсивности флуоресценции при 335 нм ( F 335 ) в зависимости от [EG], где видно, что флуоресценция
интенсивность МБ остается неизменной при увеличении концентрации
НАПРИМЕР.Красные, зеленые и черные кружки на вставке этого рисунка
точки данных трехкратных измерений. F 335 значения Mb при различных концентрациях ЭГ (0,
300 и 350 мг / мл –1 ) приведены в таблице 1.
Спектры флуоресценции МБ в присутствии разных концентраций ЭГ (0–350 мг / мл –1 ) при pH 7,0 и 25 ° C.
2.4. Исследования термической денатурации
От
структурные исследования, представленные выше, наблюдается, что EG имеет
не влияет на вторичные и третичные структуры Mb (см. -).Чтобы увидеть влияние ЭГ на стабильность
белка, тепловая денатурация Mb в присутствии различных
концентрации EG проводились с использованием двух различных свойств,
Δε 409 (зонд для отслеживания изменения глобин-гемового
взаимодействия) и [θ] 222 (датчик для отслеживания изменений
во вторичной структуре).
2.4.1. Термическая денатурация Исследования с использованием УФ – видимой области Спектроскопия
Термическая денатурация Mb в присутствии различные концентрации EG контролировали с помощью измерений Δε 409 при pH 7.0 (фосфатный буфер). Эти измерения показаны на рисунке A. На этом рисунке видно, что температурная зависимость y N (Δε 409 ) не зависит от на [EG]. Напротив, температурная зависимость y D зависит от концентрации краудера, которая равна более значимо при более высоких концентрациях (A). Кривая термической денатурации (Δε 409 против T ) Mb в присутствии каждой концентрации EG был проанализирован в соответствии с уравнением 3 для получения значений T м и Δ H м , которые приведены в таблице 2.Следует отметить что тепловая денатурация Mb в отсутствие и в присутствии ЭГ была обратима> 90%.
Кривые тепловой денатурации Mb в
наличие разных
концентрации EG (0–350 мг / мл –1 ), измеренные
по (A) ε 409 и (B) [θ] 222 при pH
7. 0.
0.
Таблица 2
Термодинамические параметры Измерено от тепловой денатурации Mb в присутствии EG при pH 7,0, Использование Soret-Absorbance, спектроскопии КД в дальнем УФ и Nano-DSF a
| Δε 409 | [θ] 222 | F F 330 | |||
|---|---|---|---|---|---|
| [EG] (мг мл –1 ) | T м (° C) | Δ H m (ккал моль –1 ) | T м (° C) | Δ H м (ккал моль –1 ) | T м (° C) |
| 0 | 81 . 5 (± 0,4) 5 (± 0,4) | 120,19 (± 0,92) | 81,60 (± 0,60) | 110,92 (± 0,90) | 79,9 (± 0,96) |
| 50 | 78,6 (± 0,56) | 120,86 (± 0,93) | 79,54 (± 0,44) | 110,63 (± 0,71) | 77,08 (± 0,85) |
| 100 | 76,3 (± 0,60) | 115,49 (± 0,74) | 78,31 (± 0,23) | 108,35 (± 0,81) | 75,46 ( ) |
| 150 | 74,3 (± 0. 71) 71) | 114,25 (± 0,81) | 75,34 (± 0,43) | 98,21 (± 0,60) | 73,63 (± 0,91) |
| 200 | 71,53 (± 0,93) | 113,40 (± 0,65) | 74,23 (± 0,20) | 96,45 (± 0,66) | 70,10 (± 0,90) |
| 250 | 68,57 (± 0,53) | 112,42 (± 0,77) | 69,58 (± 0,51) | 93,40 (± 0,59) | 68,50 (± 0,50) |
65,26 (± 0. 58) 58) | 106,27 (± 0,82) | 68,48 (± 0,39) | 92,45 (± 0,80) | 65,76 (± 0,45) | |
| 350 | 62,48 (± 0,45) | 101,06 (± 0,57) | 63,69 (± 0,23) | 84,13 (± 0,27) | ± 0,57 63,42 ( )|
2.4.2. Исследования термической денатурации с использованием КД-спектроскопии
Термическая денатурация Mb в присутствии различных концентраций
(0, 50, 100, 150, 200, 250, 300 и 350) EG сопровождались измерением
изменения [θ] 222 (см. B) при pH 7.0. На B видно, что температурные зависимости y N и y D не зависят от наличия EG. Кривая термической денатурации
([θ] 222 vs T ) Мб при наличии
данной концентрации ЭГ анализировали в соответствии с уравнением 3 для получения значений T m и Δ H m , что
приведены в таблице 2. Следует отметить, что тепловая денатурация Mb в
отсутствие и присутствие ЭГ было обратимым> 90%.
Кривая термической денатурации
([θ] 222 vs T ) Мб при наличии
данной концентрации ЭГ анализировали в соответствии с уравнением 3 для получения значений T m и Δ H m , что
приведены в таблице 2. Следует отметить, что тепловая денатурация Mb в
отсутствие и присутствие ЭГ было обратимым> 90%.
2.5. Исследования связывания ANS
Флуоресценция связывания ANS
был использован в качестве одного из методов для характеристики
интермедиаты сворачивания белков (расплавленные и предварительно расплавленные глобулы). В целом,
в нативном состоянии глобулярный белок имеет плотно упакованный,
недоступное для растворителя гидрофобное ядро, препятствующее связыванию ANS
к нему. 31,32 Денатурированное состояние, лишенное
все элементы родной вторичной и третичной структур, а также
не связывает ANS из-за высокой гибкости полипептидной цепи.показывает спектры излучения
Mb в отсутствие ЭГ при 25 и 70 ° C, а также значения λ max и интенсивности при λ max ANS приведены
в таблице 1. Сравнение
спектра при 25 ° C со спектром при 70 ° C свидетельствует о том, что
интенсивность излучения увеличивается с синим сдвигом, когда белок
нагревают до 70 ° C (см. также Таблицу 1). также показаны спектры излучения ANS в присутствии
белок, содержащий 300 и 350 мг / мл –1 EG при 25
и 70 ° С. Эти спектры использовались для определения значений λ max и интенсивности на этой длине волны для каждого экспериментального
условия, которые приведены в таблице 1.Кроме того, эти спектры показывают, что флуоресценция
интенсивность ВНС увеличивается с синим сдвигом при нагревании раствора
от 25 до 70 ° С.
Сравнение
спектра при 25 ° C со спектром при 70 ° C свидетельствует о том, что
интенсивность излучения увеличивается с синим сдвигом, когда белок
нагревают до 70 ° C (см. также Таблицу 1). также показаны спектры излучения ANS в присутствии
белок, содержащий 300 и 350 мг / мл –1 EG при 25
и 70 ° С. Эти спектры использовались для определения значений λ max и интенсивности на этой длине волны для каждого экспериментального
условия, которые приведены в таблице 1.Кроме того, эти спектры показывают, что флуоресценция
интенсивность ВНС увеличивается с синим сдвигом при нагревании раствора
от 25 до 70 ° С.
Спектры флуоресценции Мб ANS в присутствии различных концентрации EG (0, 300 и 350 мг / мл –1 при 25 ° C и 70 ° C и pH 7,0.
2.6. Тепловой Развитие исследований с использованием нанодифракции Сканирующая флуориметрия (Nano-DSF)
A показывает изменение флуоресценции триптофана.
соотношение ( F 350 / F 330 ) МБ в присутствии различных концентраций ЭГ (0–350
мг мл –1 ) как функция температуры. В частности,
необработанные данные флуоресценции ( F 350 / F 330 ) показывают разумный переход от
сложенное состояние в денатурированное состояние при отсутствии и наличии
EG (A), который
может использоваться непосредственно для анализа T m от первой производной от F 350 / F 330 относительно T по сравнению с
температура. 33,34 Пик в точке максимального
наклон дает T m белка (см. B).Значения T m Mb при различных концентрациях ЭГ равны
приведено в таблице 2.
В частности,
необработанные данные флуоресценции ( F 350 / F 330 ) показывают разумный переход от
сложенное состояние в денатурированное состояние при отсутствии и наличии
EG (A), который
может использоваться непосредственно для анализа T m от первой производной от F 350 / F 330 относительно T по сравнению с
температура. 33,34 Пик в точке максимального
наклон дает T m белка (см. B).Значения T m Mb при различных концентрациях ЭГ равны
приведено в таблице 2.
(A) Изменение
в F 350 / F 330 затухания флуоресценции триптофана при термическом воздействии
разворачивание МБ в присутствии разных концентраций ЭГ
(0–350 мг / мл –1 ). (B) График первой производной
(d ( F 350 / F 330 ) / d T ) vs T ) для определения T м Mb при наличии различных концентраций
ЭГ (0–350 мг / мл –1 ).
2.7. Исследования связывания
2.7.1. Изотермический Исследования калориметрии титрования
показывает калориметрические
титрования связывания EG с Mb при pH 7,0 и двух разных
температуры (298 и 343 К). А показывает титрование ЭГ в ячейке, содержащей
Мб при 298 К (25 ° C). На верхней панели этого рисунка каждый
пик на изотерме связывания представляет собой однократную инъекцию раствора ЭГ.
Интегрирование площади под каждым пиком впрыска в тепле
профиль дает дифференциальную кривую, показанную на нижней панели
термограмма, на которой видно, что этот тепловой профиль не показывает
любой специфический образец связывания.Однако при титровании
при более высокой температуре (343 К), где гидрофобные участки белка
подвергаются воздействию полярного растворителя, EG может напрямую взаимодействовать с
белок; на ранней стадии EG связывается с белком, и он быстро
насыщает сайты связывания (см. B). В таблице 3 приведены термодинамические параметры связующего
ЭГ с Mb при 298 и 343 K.
Типичные термограммы ITC для Mb (20 мкМ) с EG (600 мкМ). (A) Калориметрический ответ как последовательная инъекция добавленного EG. к реакционной ячейке (верхняя панель) и полученная изотерма связывания (нижняя панель) при pH 7.0 и 298 K. (B) Калориметрический отклик как последовательная инъекция EG, добавленного в реакционную ячейку (верхняя панель) и результирующая изотерма связывания (нижняя панель) при pH 7,0 и 343 К.
Таблица 3
Параметры связывания EG с оценкой Mb из измерений ITC при 298 K (25 ° C) и 343 K (70 ° C) a
| термодинамические параметры (единицы) | K a (M –1 ) | Δ H 0 (кал. Моль –1 ) | Δ S 0 (кал. Моль –1 град –1 ) Моль –1 град –1 ) | Δ G 0 (кал. Моль –1 ) | K d (M) |
|---|---|---|---|---|---|
| При 298 K | |||||
| шаг 1 | 177 × 10 3 (± 6.3 × 10 3 ) | –299,1 (± 6,60) | 23,0 | –7,153 × 10 3 (± 0,007 × 10 3 ) | 0,056 × 10 –4 |
| шаг 2 | 24,0 × 10 2 (± 4,3 × 10 2 ) | –2274 (± 405) | 7,84 | –4,610 × 10 3 (± 0,405 × 10 3 ) | 0,41 × 10 –3 |
| шаг 3 | 23,2 × 10 2 (± 4. 2 × 10 2 ) 2 × 10 2 ) | –2668 (± 929) | 6,45 | –4,590 × 10 3 (± 0,929 × 10 3 ) | 0,43 × 10 –3 |
| При 343 K | |||||
| шаг 1 | 13,4 × 10 3 (± 4,2 × 10 3 ) | –32,20 × 10 3 (± 7,21 × 10 3 ) | –74,9 | –6,509 × 10 3 (± 7,21 × 10 3 ) | 0,7 × 10 –4 |
| шаг 2 | 6. 9 × 10 5 (± 2,3 × 10 5 ) 9 × 10 5 (± 2,3 × 10 5 ) | 31,00 × 10 3 (± 7,29 × 10 3 ) | 117 | –9,131 × 10 3 (± 7,29 × 10 3 ) | 0,145 × 10 –5 |
| шаг 3 | 6,73 × 10 3 (± 1,6 × 10 3 ) | –19,06 × 10 3 (± 1,38 × 10 3 ) | –38,0 | –6,026 × 10 3 (± 1,38 × 10 3 ) | 0.148 × 10 –5 |
2.7.2. Исследования молекулярного докинга Mb с EG
Чтобы узнать
структурные изменения или сохранение окружающей среды
фрагмент гема в Mb в присутствии EG, исследования молекулярного докинга
были выполнены. Сообщалось, что PEG 400 (полимер EG) взаимодействует с
с гемом и полипептидной цепью Mb, что приводит к разрушению гема
и потеря вторичных и третичных структур белка. 29 Однако, — показать не имеет значения
изменения в гемовой среде и вторичных и третичных структурах
мб в присутствии ЭГ при pH 7.0 и 25 ° C. Тем не менее
Вычислительный анализ показал, что существует слабое взаимодействие между
EG и Mb с энергией связи -2,7 ккал · моль -1 в этих экспериментальных условиях. показывает вид поверхности белка с
сайт связывания кармана ЭГ и донорно-акцепторная водородная связь
остатки. На этом рисунке также показано 2D-представление аминогруппы.
кислоты со слабым взаимодействием (обычная водородная связь и ван дер
Силы стенок) с EG, показанным в модели мяча и клюшки.EG взаимодействует
с Asp109, Glu136 и Arg139 через водородную связь со связью
расстояния 3,33, 3,12 и 2,97 Å соответственно.
Сообщалось, что PEG 400 (полимер EG) взаимодействует с
с гемом и полипептидной цепью Mb, что приводит к разрушению гема
и потеря вторичных и третичных структур белка. 29 Однако, — показать не имеет значения
изменения в гемовой среде и вторичных и третичных структурах
мб в присутствии ЭГ при pH 7.0 и 25 ° C. Тем не менее
Вычислительный анализ показал, что существует слабое взаимодействие между
EG и Mb с энергией связи -2,7 ккал · моль -1 в этих экспериментальных условиях. показывает вид поверхности белка с
сайт связывания кармана ЭГ и донорно-акцепторная водородная связь
остатки. На этом рисунке также показано 2D-представление аминогруппы.
кислоты со слабым взаимодействием (обычная водородная связь и ван дер
Силы стенок) с EG, показанным в модели мяча и клюшки.EG взаимодействует
с Asp109, Glu136 и Arg139 через водородную связь со связью
расстояния 3,33, 3,12 и 2,97 Å соответственно.
Взаимодействия
EG (модель мяча и клюшки) с Mb (мультипликационная модель,
зеленый) показывает вид поверхности и 2D-представление взаимодействия
белковых остатков с EG.
3. Обсуждение
Видимый спектр
met-Mb (черная линия) имеет резкую полосу Соре
на 409 нм, что является характеристикой шестикоординированного высокоспинового
гем с остатком гистидина (His-93) и связанной молекулой воды
в пятой и шестой координационных позициях атома железа,
соответственно. 35 Смена гема
окружающая среда приводит к нарушению белкового спектра. EG-обработанный
Mb не показывает существенных изменений в видимом спектре даже на его
более высокие концентрации (A). Это наблюдение согласуется с тем, о чем сообщалось ранее. 2 Все белки имеют характерный ультрафиолетовый
(УФ) спектр поглощения около 280 нм преимущественно из-за ароматических
аминокислоты тирозин и триптофан. 36 Это
собственность эксплуатируется путем наблюдения за изменениями в окружающей среде
ароматических остатков (третичная структура) белков. 37,38 EG даже в более высоких концентрациях (300 и 350 мг / мл –1 ) не нарушает окружающую среду ароматического остатка (B), следовательно, третичный
структура МБ. Это наблюдение подтверждается измерениями КД в ближнем УФ-диапазоне.
(В). Близость
двух остатков триптофана (Trp7 и Trp14 на спирали A) к
гемовой фрагмент в природном Mb приводит к частичному тушению
флуоресценция триптофана. 39 не показывает увеличения
ни в интенсивности флуоресценции Mb, ни в каком-либо сдвиге в λ max в присутствии EG, что позволяет предположить, что среда Trp является
не возмутился на добавление ЭГ.Интересно напомнить, что
Mb в присутствии полимеров ЭГ (ПЭГ 400 Да и 10 кДа) теряет
его третичная структура, выявленная измерениями флуоресценции. 5,29
Это наблюдение подтверждается измерениями КД в ближнем УФ-диапазоне.
(В). Близость
двух остатков триптофана (Trp7 и Trp14 на спирали A) к
гемовой фрагмент в природном Mb приводит к частичному тушению
флуоресценция триптофана. 39 не показывает увеличения
ни в интенсивности флуоресценции Mb, ни в каком-либо сдвиге в λ max в присутствии EG, что позволяет предположить, что среда Trp является
не возмутился на добавление ЭГ.Интересно напомнить, что
Mb в присутствии полимеров ЭГ (ПЭГ 400 Да и 10 кДа) теряет
его третичная структура, выявленная измерениями флуоресценции. 5,29
Компакт-диск с дальним УФ-излучением — это чувствительный метод отслеживания изменений
в
вторичный из белков. 40-42 Спектры КД Мб в дальней УФ в присутствии различных
концентрации ЭГ показывают, что не было значительного изменения
вторичная структура (A). Низкомолекулярный ПЭГ (ПЭГ 400 Да) был обнаружен
нарушить как третичную, так и вторичную структуру МБ, и это
вызывает состояние предварительно расплавленной глобулы. 29 Другой
исследование Mb в присутствии PEG (PEG 10 кДа) показало, что этот полимер
нарушает третичную структуру МБ без каких-либо значительных изменений
во вторичной структуре, что позволяет предположить, что ПЭГ 10 кДа дает
структура расплавленной глобулы. 5 Наше наблюдение
что ЭГ не влияет на вторичные и третичные структуры
Mb (см. -) 2 находится в соответствии с
что на других белках, который показывает отсутствие или незначительное изменение в
их структуры. 22,43 Напротив, эффект
ПЭГ на Мб и других белках в присутствии полимеров ЭГ
различные размеры, о которых сообщалось ранее, зависят от белка.Особенно,
ПЭГ (i) влияют как на вторичные, так и на третичные структуры, 1,2,29,44 (ii) влияют на третичную структуру без каких-либо значительных изменений
вторичная структура, 2,5,30 и (iii) не влияют ни на вторичные, ни на третичные структуры. 44,45
29 Другой
исследование Mb в присутствии PEG (PEG 10 кДа) показало, что этот полимер
нарушает третичную структуру МБ без каких-либо значительных изменений
во вторичной структуре, что позволяет предположить, что ПЭГ 10 кДа дает
структура расплавленной глобулы. 5 Наше наблюдение
что ЭГ не влияет на вторичные и третичные структуры
Mb (см. -) 2 находится в соответствии с
что на других белках, который показывает отсутствие или незначительное изменение в
их структуры. 22,43 Напротив, эффект
ПЭГ на Мб и других белках в присутствии полимеров ЭГ
различные размеры, о которых сообщалось ранее, зависят от белка.Особенно,
ПЭГ (i) влияют как на вторичные, так и на третичные структуры, 1,2,29,44 (ii) влияют на третичную структуру без каких-либо значительных изменений
вторичная структура, 2,5,30 и (iii) не влияют ни на вторичные, ни на третичные структуры. 44,45
Приведенное выше обсуждение показывает, что EG не влияет на вторичный
и третичные структуры Mb при pH 7,0 и 25 ° C. Вопрос
возникает: влияет ли ЭГ на термодинамическую стабильность белка?
Чтобы ответить на этот вопрос, мы измерили термическую денатурацию
МБ при отсутствии и наличии разных концентраций ЭГ (см. И).Мониторинг денатурации по [θ] 222 показывает
что температурные зависимости нативного и денатурированного белка
молекулы не зависят от [EG] (B). Это наблюдение предполагает, что структурные
свойства нативных и денатурированных молекул не нарушаются
пользователя EG. Напротив, хотя температурная зависимость гема и
Окружение trp в родном Mb не нарушается при добавлении
ЭГ, температурная зависимость этого свойства денатурированной молекулы
возмущается в присутствии толпы (см. A и A).Чтобы узнать, подвергся ли денатурированный белок гидрофобной
патчей, мы измерили связывание ВНС с денатурированным нагреванием белком в
наличие двух самых высоких концентраций ЭГ (300 и 350 мг / мл –1 ) при 70 ° C (). Было замечено, что денатурированные под действием тепла
Mb обнажила гидрофобные участки в присутствии EG, который связывает
в ANS (),
для есть увеличение интенсивности излучения с синим сдвигом.
Вопрос
возникает: влияет ли ЭГ на термодинамическую стабильность белка?
Чтобы ответить на этот вопрос, мы измерили термическую денатурацию
МБ при отсутствии и наличии разных концентраций ЭГ (см. И).Мониторинг денатурации по [θ] 222 показывает
что температурные зависимости нативного и денатурированного белка
молекулы не зависят от [EG] (B). Это наблюдение предполагает, что структурные
свойства нативных и денатурированных молекул не нарушаются
пользователя EG. Напротив, хотя температурная зависимость гема и
Окружение trp в родном Mb не нарушается при добавлении
ЭГ, температурная зависимость этого свойства денатурированной молекулы
возмущается в присутствии толпы (см. A и A).Чтобы узнать, подвергся ли денатурированный белок гидрофобной
патчей, мы измерили связывание ВНС с денатурированным нагреванием белком в
наличие двух самых высоких концентраций ЭГ (300 и 350 мг / мл –1 ) при 70 ° C (). Было замечено, что денатурированные под действием тепла
Mb обнажила гидрофобные участки в присутствии EG, который связывает
в ANS (),
для есть увеличение интенсивности излучения с синим сдвигом. 32
32
Анализ тепловой денатурации кривые ε 409 и [θ] 222 () для термодинамических параметры ( T м и Δ H м ) в соответствии с уравнением 3 дали значения T м и Δ H м белок (таблица 2).Из таблицы 2 видно, что Mb дестабилизируется в терминах T m по EG. Это наблюдение было проверено измерениями нано-DSF (), которые также показывают что T m уменьшается с увеличением концентрации ЭГ (таблица 2).
Значения T м , полученные в результате анализа
кривых денатурации ε 409, [θ] 222 и F 350 / F 330 Mb в отсутствие ЭГ находятся в пределах экспериментальных
ошибки, одинаковые.Это значение прекрасно согласуется с
полученные из измерений DSC. 46 Δ H м получены значения Mb при отсутствии ЭГ
из оптических методов (таблица 2) также согласуются с описанными спектроскопическими методами.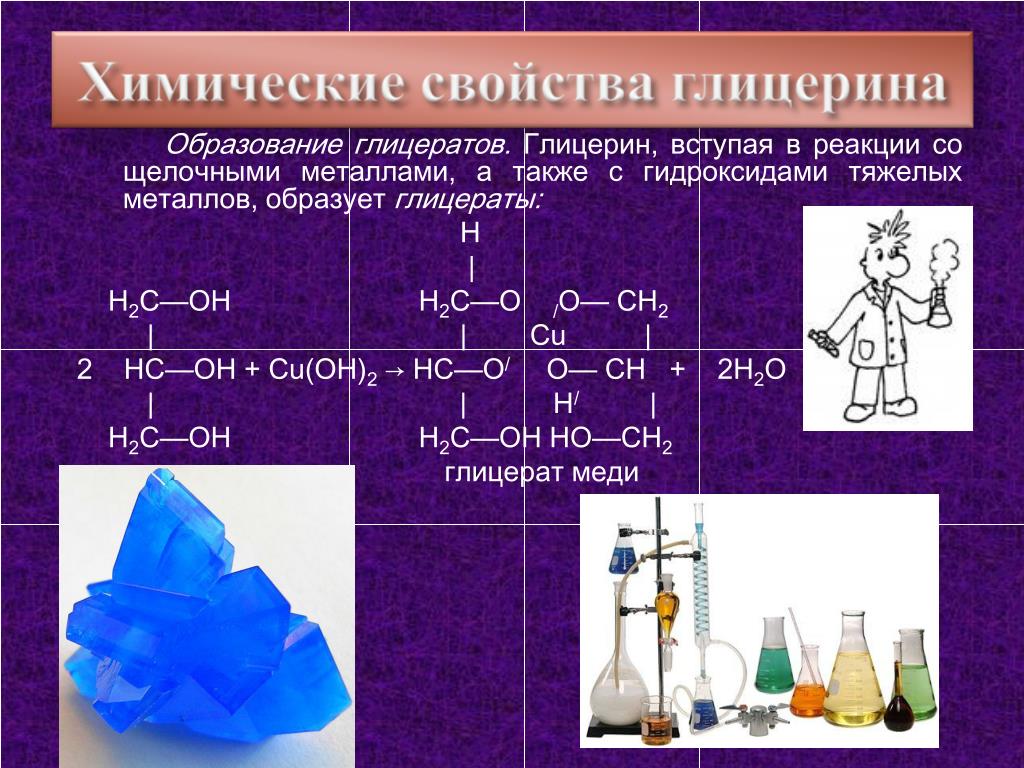 ранее. 47,48 Эти соглашения о термодинамических свойствах
полученные с помощью оптических и термодинамических методов подтверждают, что тепловая
денатурация Mb — это процесс с двумя состояниями. Напротив, ценности T m и Δ H m белка в присутствии заданной концентрации
EG не идентичны.Например, значения T m и Δ H m белка
по оценке с помощью зонда ε 409 уменьшение с 81,5 ° C
(0 мг / мл -1 EG) до 62,5 ° C (350 мг / мл -1 EG) и Δ H m от 120 ккал моль -1 (0 мг / мл -1 EG) до 101 ккал моль –1 , тогда как T м оценочно
при использовании датчика [θ 222 ] уменьшается с 81,6 ° C (0
мг мл –1 EG) до 63.7 ° C (350 мг · мл -1 EG) и Δ H m от 120 ккал · моль -1 (0 мг · мл -1 EG) до 101 ккал · моль -1 .
ранее. 47,48 Эти соглашения о термодинамических свойствах
полученные с помощью оптических и термодинамических методов подтверждают, что тепловая
денатурация Mb — это процесс с двумя состояниями. Напротив, ценности T m и Δ H m белка в присутствии заданной концентрации
EG не идентичны.Например, значения T m и Δ H m белка
по оценке с помощью зонда ε 409 уменьшение с 81,5 ° C
(0 мг / мл -1 EG) до 62,5 ° C (350 мг / мл -1 EG) и Δ H m от 120 ккал моль -1 (0 мг / мл -1 EG) до 101 ккал моль –1 , тогда как T м оценочно
при использовании датчика [θ 222 ] уменьшается с 81,6 ° C (0
мг мл –1 EG) до 63.7 ° C (350 мг · мл -1 EG) и Δ H m от 120 ккал · моль -1 (0 мг · мл -1 EG) до 101 ккал · моль -1 . Это наблюдаемое несовпадение предполагает, что тепловая
денатурация Mb в присутствии EG не является процессом с двумя состояниями.
Другой источник наблюдаемого расхождения может быть связан с вариацией
характеристик денатурированного состояния Mb с изменением
в [EG] (см. A).
Это наблюдаемое несовпадение предполагает, что тепловая
денатурация Mb в присутствии EG не является процессом с двумя состояниями.
Другой источник наблюдаемого расхождения может быть связан с вариацией
характеристик денатурированного состояния Mb с изменением
в [EG] (см. A).
Известно, что преимущественное связывание добавки с белок приводит к дестабилизации белков. 49 Кому подтверждают степень связывания и тип взаимодействия ЭГ с Mb при низких и высоких температурах, калориметрические исследования с использованием ITC были Выполнено. Кроме того, чтобы знать связывающий карман на белке для лиганд, вычислительные исследования (молекулярный докинг) также проводились вне.
На верхней панели термограмм () каждый пик на изотерме связывания представляет
однократное введение раствора ЭГ. Интеграция территории под
каждый пик нагнетания в тепловом профиле дает дифференциальную кривую
показано на нижней панели этого рисунка.Тепловой профиль не
показать любой специфический паттерн связывания между Mb и EG при 298 K (25 ° C),
что могло быть наиболее вероятной причиной отсутствия эффекта EG
от структурных свойств Mb при этой температуре. Однако когда
титрование проводили при 343 К (70 ° С), связывание происходило,
поскольку при этой температуре обнажаются гидрофобные участки белка
в полярную среду (см.), что будет способствовать раннему связыванию EG
к незащищенным неполярным поверхностям Mb и быстрому насыщению.
Однако когда
титрование проводили при 343 К (70 ° С), связывание происходило,
поскольку при этой температуре обнажаются гидрофобные участки белка
в полярную среду (см.), что будет способствовать раннему связыванию EG
к незащищенным неполярным поверхностям Mb и быстрому насыщению.
аффинность связывания, определяемая в терминах константы диссоциации
( K d ) — экспериментальная мера, определяющая
возможно ли взаимодействие лиганда и белка.В
аффинность связывания используется для измерения бимолекулярных взаимодействий и
ранжируйте в порядке его силы. 50 В таблице 3 сравниваются значения
термодинамические параметры связывания при двух температурах. Это видно в
эта таблица, что K d меньше на 343 K
чем при 298 К, что позволяет предположить, что EG связывается сильнее при более высоком
температура. 50,51 Помимо K a и K d , изменение энтальпии (Δ H ° ) измеряет изменение прочности
взаимодействие между молекулами, в то время как изменение энтропии (- T Δ S ° ) измеряет
изменить порядок в системе. Однако труднее
для интерпретации изменений свободной энергии, поскольку она зависит как от энтальпии,
и энтропия изменяется. 52,53 Приведены значения свободной энергии
в таблице 3 показывают, что
взаимодействие возможно (спонтанное) как при 298, так и при 343 K; тем не мение,
полное изменение свободной энергии (Δ G ° ) трехступенчатого связывания более отрицательно при 343 K, чем при 298 K,
что свидетельствует о спонтанности бимолекулярного взаимодействия. Феномен
компенсации энтропии-энтальпии применима в нашем случае,
для связывания уменьшит энтальпию, тогда как более сильное взаимодействие
между молекулами также приведет к уменьшению конфигурационного
свобода системы и, следовательно, уменьшение энтропии.Соответственно,
более слабые молекулярные взаимодействия приведут к более слабой молекулярной ассоциации
и увеличение энтропии. 52 Таблица 3 показывает, что привязка
между EG и Mb слаба при 298 К и управляется энтропией. Скорее всего,
эта слабая ассоциация не приводит к изменению структуры (-).
Однако труднее
для интерпретации изменений свободной энергии, поскольку она зависит как от энтальпии,
и энтропия изменяется. 52,53 Приведены значения свободной энергии
в таблице 3 показывают, что
взаимодействие возможно (спонтанное) как при 298, так и при 343 K; тем не мение,
полное изменение свободной энергии (Δ G ° ) трехступенчатого связывания более отрицательно при 343 K, чем при 298 K,
что свидетельствует о спонтанности бимолекулярного взаимодействия. Феномен
компенсации энтропии-энтальпии применима в нашем случае,
для связывания уменьшит энтальпию, тогда как более сильное взаимодействие
между молекулами также приведет к уменьшению конфигурационного
свобода системы и, следовательно, уменьшение энтропии.Соответственно,
более слабые молекулярные взаимодействия приведут к более слабой молекулярной ассоциации
и увеличение энтропии. 52 Таблица 3 показывает, что привязка
между EG и Mb слаба при 298 К и управляется энтропией. Скорее всего,
эта слабая ассоциация не приводит к изменению структуры (-). С другой стороны, бимолекулярное взаимодействие
относительно сильнее при 343 К, и в целом это как энтропия, так и
энтальпия управляемая. Это более сильное связывание EG с Mb, скорее всего,
из-за недавно обнаруженных гидрофобных пятен на поверхности
белок.Следовательно, термическая дестабилизация Mb в присутствии EG
происходит из-за взаимодействия лиганда с белком, подвергающимся воздействию
гидрофобные пятна. Следовательно, дестабилизация белка в
присутствие EG, показанное экспериментами ITC, связано со связыванием. В виде
известен факт, что жесткое отталкивание может привести к уплотнению
развернутых белков и потенциально макромолекулярных скоплений может
вести себя как энтропийная толпа. 54,55 Однако
развернутое состояние более открыто, а значит, остатки более доступны
скучать молекулы; приводит к связыванию мягкой частью взаимодействий
(мягкое взаимодействие или химическое взаимодействие) приведет к тому, что белок
в разложенном состоянии. 4,29,54 Следовательно, ожидается, что молекулы-краудеры будут демонстрировать разные взаимодействия.
С другой стороны, бимолекулярное взаимодействие
относительно сильнее при 343 К, и в целом это как энтропия, так и
энтальпия управляемая. Это более сильное связывание EG с Mb, скорее всего,
из-за недавно обнаруженных гидрофобных пятен на поверхности
белок.Следовательно, термическая дестабилизация Mb в присутствии EG
происходит из-за взаимодействия лиганда с белком, подвергающимся воздействию
гидрофобные пятна. Следовательно, дестабилизация белка в
присутствие EG, показанное экспериментами ITC, связано со связыванием. В виде
известен факт, что жесткое отталкивание может привести к уплотнению
развернутых белков и потенциально макромолекулярных скоплений может
вести себя как энтропийная толпа. 54,55 Однако
развернутое состояние более открыто, а значит, остатки более доступны
скучать молекулы; приводит к связыванию мягкой частью взаимодействий
(мягкое взаимодействие или химическое взаимодействие) приведет к тому, что белок
в разложенном состоянии. 4,29,54 Следовательно, ожидается, что молекулы-краудеры будут демонстрировать разные взаимодействия. природы при разных температурах, ведущих к стабилизации или дестабилизации
белка.
природы при разных температурах, ведущих к стабилизации или дестабилизации
белка.
Исследования молекулярного докинга показали, что взаимодействие
ЭГ с
Mb представляет собой слабое взаимодействие с низкой энергией связи −2,7
ккал моль –1 . показывает вид поверхности белка с карманом, связывающим
сайт EG и донорно-акцепторные остатки водородной связи. Эта фигура
показывает двухмерное представление аминокислот, показывающее слабые взаимодействия
(обычная водородная связь и силы Ван-дер-Уоллса) с лигандом
(показано на модели с мячом и клюшкой).ЭГ взаимодействует с Asp109, Glu136,
и Arg139 через водородную связь с расстояниями связи 3,33, 3,12,
и 2,97 Å соответственно. Кроме того, белковые остатки, участвующие в
Ван-дер-Ваальсовы взаимодействия — это Thr132, Ser108, Ile112 и Leu135.
Ранее опубликованные исследования молекулярного докинга показали, что ПЭГ 400
(который является полимером EG) взаимодействует с гемом и полипептидом
цепочка Mb, приводящая к разрушению гема и потере вторичных
и третичные структуры белка. 29 Однако в случае его мономера (EG) гем сохраняется в
присутствие EG во всех его концентрациях (A), и нет значительного изменения в
вторичная и третичная структуры Mb ().Это исследование показывает, что, хотя EG показывает
преимущественное взаимодействие с Mb (A и), не имеет
существенное влияние на структуру Мб при 25 ° С. Таким образом, стыковка
исследование поддерживает наблюдения исследований in vitro .
29 Однако в случае его мономера (EG) гем сохраняется в
присутствие EG во всех его концентрациях (A), и нет значительного изменения в
вторичная и третичная структуры Mb ().Это исследование показывает, что, хотя EG показывает
преимущественное взаимодействие с Mb (A и), не имеет
существенное влияние на структуру Мб при 25 ° С. Таким образом, стыковка
исследование поддерживает наблюдения исследований in vitro .
Концентрационная зависимость, структура и локализованная термодинамика
Abstract
Известно, что переполненная молекулярная среда влияет на структуру, термодинамику и динамику макромолекул. Большинство предыдущих работ по молекулярному краудингу были в основном сосредоточены на поведении макромолекул с меньшим акцентом на поведении краудера и молекул воды.В текущем исследовании мы сосредоточились на поведении краудера (этиленгликоля (ЭГ)), ионов соли и воды в присутствии ДНК с увеличением концентрации ЭГ. Мы исследовали поведение воды и краудера с помощью моделирования молекулярной динамики (МД) и расчета локализованных термодинамических свойств. Наши результаты показывают интересную конкуренцию между EG и молекулами воды за образование водородных связей (Н-связь) с ДНК. Хотя общее количество водородных связей с участием ДНК как с ЭГ, так и с водой остается по существу одинаковым независимо от увеличения концентрации ЭГ, наблюдается пропорциональное изменение в паттерне Н-связей между водой-водой, ЭГ-ЭГ и ЭГ-вода. рядом с ДНК и оптом.При низких концентрациях ЭГ смещение молекул воды около ДНК происходит относительно легко. Однако вытеснение воды затрудняется по мере увеличения концентрации ЭГ. Плотность Na + (Cl — ) рядом с ДНК увеличивается (уменьшается) по мере увеличения концентрации EG. Плотность Cl — вблизи Na + увеличивается с увеличением концентрации ЭГ. Также было обнаружено, что средняя свободная энергия, приходящаяся на воду в первой сольватной оболочке, увеличивается с увеличением концентрации ЭГ.Объединив все это вместе, появилась микроскопическая картина взаимодействия ЭГ, воды и соли в присутствии ДНК в зависимости от концентрации ЭГ.
Наши результаты показывают интересную конкуренцию между EG и молекулами воды за образование водородных связей (Н-связь) с ДНК. Хотя общее количество водородных связей с участием ДНК как с ЭГ, так и с водой остается по существу одинаковым независимо от увеличения концентрации ЭГ, наблюдается пропорциональное изменение в паттерне Н-связей между водой-водой, ЭГ-ЭГ и ЭГ-вода. рядом с ДНК и оптом.При низких концентрациях ЭГ смещение молекул воды около ДНК происходит относительно легко. Однако вытеснение воды затрудняется по мере увеличения концентрации ЭГ. Плотность Na + (Cl — ) рядом с ДНК увеличивается (уменьшается) по мере увеличения концентрации EG. Плотность Cl — вблизи Na + увеличивается с увеличением концентрации ЭГ. Также было обнаружено, что средняя свободная энергия, приходящаяся на воду в первой сольватной оболочке, увеличивается с увеличением концентрации ЭГ.Объединив все это вместе, появилась микроскопическая картина взаимодействия ЭГ, воды и соли в присутствии ДНК в зависимости от концентрации ЭГ.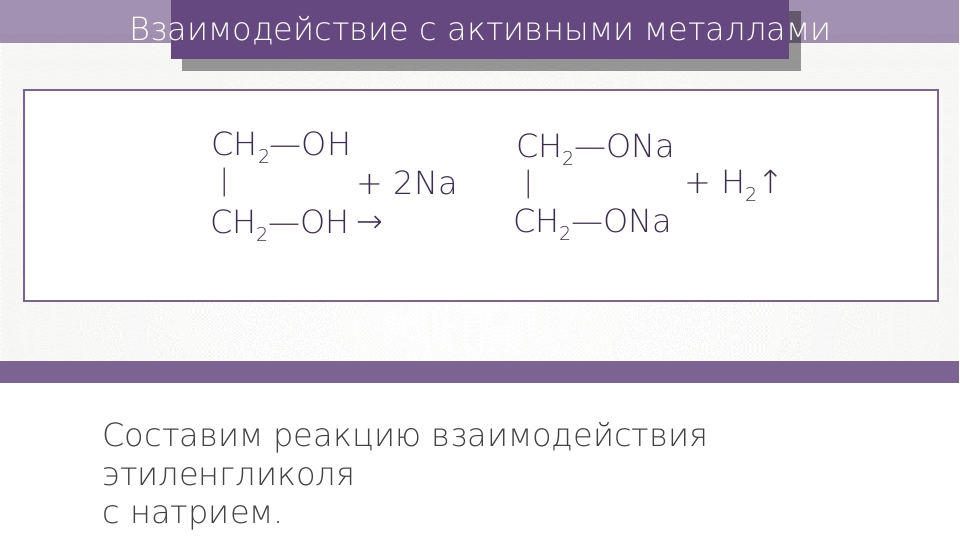
Образец цитирования: Jaiswal AK, Srivastava R, Pandey P, Bandyopadhyay P (2018) Микроскопическая картина взаимодействия воды и этиленгликоля вблизи модельной ДНК с помощью компьютерного моделирования: зависимость от концентрации, структура и локальная термодинамика. PLoS ONE 13 (11): e0206359. https://doi.org/10.1371/journal.pone.0206359
Редактор: Яаков Коби Леви, Институт науки Вейцмана, ИЗРАИЛЬ
Поступила: 17 февраля 2018 г .; Одобрена: 11 октября 2018 г .; Опубликовано: 14 ноября 2018 г.
Авторские права: © 2018 Jaiswal et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные есть в рукописи и дополнительных материалах.
Финансирование: Финансирование было предоставлено Советом по научным и инженерным исследованиям (SERB) Индии (SB / S1 / PC-048/2013) для P.B., грант UPE, предоставленный P.B. от Университета Джавахарлала Неру и гранта DST-PURSE. П.П. благодарит DBT-CoE (Департамент биотехнологии — Центр передового опыта) за грант на исследовательскую стипендию. Р.С. благодарит CSIR (Совет по научным и промышленным исследованиям) за предоставленную исследовательскую стипендию.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Живые клетки можно рассматривать как гетерогенную концентрированную среду из-за присутствия различных типов молекул. Например, концентрация молекул внутри клетки может варьироваться от 80–400 мг / мл [1,2], что соответствует примерно 5–40% заполнению клетки объемом [3].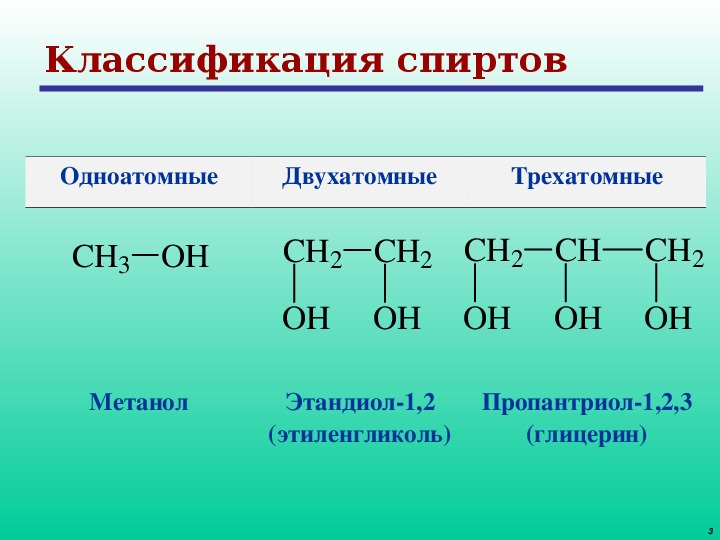 Эта внутриклеточная среда состоит из различных молекулярных видов, таких как белок, ДНК, РНК, полисахарид, небольшие молекулы-мессенджеры, липиды, и т. Д. . Было проведено значительное количество экспериментов in vitro , чтобы понять поведение переполненной внутриклеточной среды. Однако в нескольких статьях и обзорах высказано предположение, что эксперименты in vitro и , проведенные в разбавленном водном растворе, не всегда могут отражать физиологическое состояние скученности [4–7].Молекулярное скопление оказывает существенное влияние на поведение и удержание различных молекул внутри клетки. Одним из основных эффектов молекулярного скучивания является то, что из-за присутствия других молекул молекула не может занимать значительную область пространства, доступную в разбавленном растворе. Из-за этого исключения объема эффективная концентрация молекул изменяется, что может изменить равновесие различных биологических процессов [8]. Краудинг может иметь большое влияние на кинетику биологических процессов [4,9–16].
Эта внутриклеточная среда состоит из различных молекулярных видов, таких как белок, ДНК, РНК, полисахарид, небольшие молекулы-мессенджеры, липиды, и т. Д. . Было проведено значительное количество экспериментов in vitro , чтобы понять поведение переполненной внутриклеточной среды. Однако в нескольких статьях и обзорах высказано предположение, что эксперименты in vitro и , проведенные в разбавленном водном растворе, не всегда могут отражать физиологическое состояние скученности [4–7].Молекулярное скопление оказывает существенное влияние на поведение и удержание различных молекул внутри клетки. Одним из основных эффектов молекулярного скучивания является то, что из-за присутствия других молекул молекула не может занимать значительную область пространства, доступную в разбавленном растворе. Из-за этого исключения объема эффективная концентрация молекул изменяется, что может изменить равновесие различных биологических процессов [8]. Краудинг может иметь большое влияние на кинетику биологических процессов [4,9–16].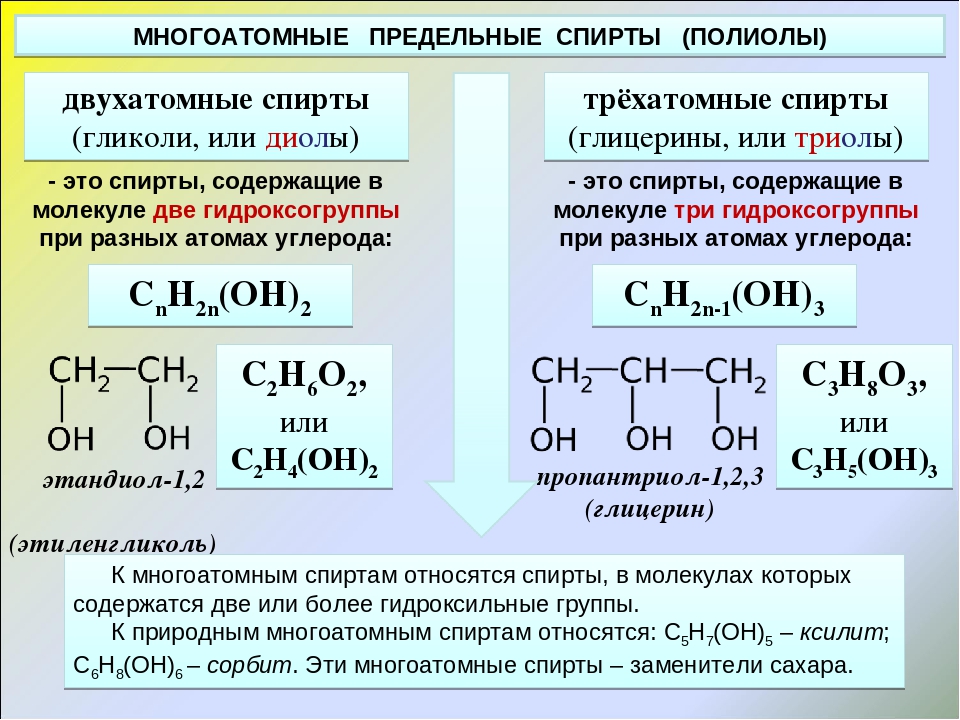 Другие эффекты, такие как межмолекулярные взаимодействия, а также исключение объема, также играют роль в молекулярном скоплении [10].
Другие эффекты, такие как межмолекулярные взаимодействия, а также исключение объема, также играют роль в молекулярном скоплении [10].
Значительный объем работы был проделан для белков в тесноте, как видно из ссылок, приведенных в предыдущем абзаце. Что касается нуклеиновых кислот, количество исследований в условиях тесноты сравнительно невелико [17]. Работа, проделанная с нуклеиновыми кислотами, в основном исследовала влияние различных окружающих сред растворителей на структуру и динамику ДНК.В интересной работе группа Уэльса исследовала структуру ДНК в неполярных растворителях, таких как CCl 4 [18], и показала, что молекула ДНК становится более жесткой и выбирает альтернативную конформацию, которая находится недалеко от ее водного аналога. Канг и др. . исследовали набухание модельной ДНК в переполненной полидисперсной среде [19]. Cheatham и др. . исследовали переход от A к B короткой ДНК в смеси вода / этанол в более ранней работе [20]. Ной и др. .также исследовал ту же проблему в более поздней работе [21]. Роль внешних агентов, таких как пиридин (который разворачивает структуру ДНК, заменяя взаимодействия стэкинга оснований), в структуре ДНК также была исследована [22], что предполагает, что он действительно может стабилизировать ДНК в кислой среде. Однако в большинстве работ упор был сделан на ДНК, микроскопические особенности смешанных растворителей в присутствии ДНК широко не исследовались.
.также исследовал ту же проблему в более поздней работе [21]. Роль внешних агентов, таких как пиридин (который разворачивает структуру ДНК, заменяя взаимодействия стэкинга оснований), в структуре ДНК также была исследована [22], что предполагает, что он действительно может стабилизировать ДНК в кислой среде. Однако в большинстве работ упор был сделан на ДНК, микроскопические особенности смешанных растворителей в присутствии ДНК широко не исследовались.
Среди работ, посвященных деталям растворителя, одна известная экспериментальная работа была получена от Spink et al .[23]. В этой работе было обнаружено, что небольшие нейтральные сорастворенные вещества, такие как этиленгликоль (ЭГ), дестабилизируют ДНК, изменяя термодинамическую активность молекул воды и напрямую взаимодействуя с ДНК. С другой стороны, высокомолекулярные сорастворенные вещества, такие как полиэтиленгликоль (ПЭГ), в основном работают за счет большого исключенного объема, который они создают. Было обнаружено, что ЭГ снижает активность воды и структурно изменяет сеть водородных связей воды.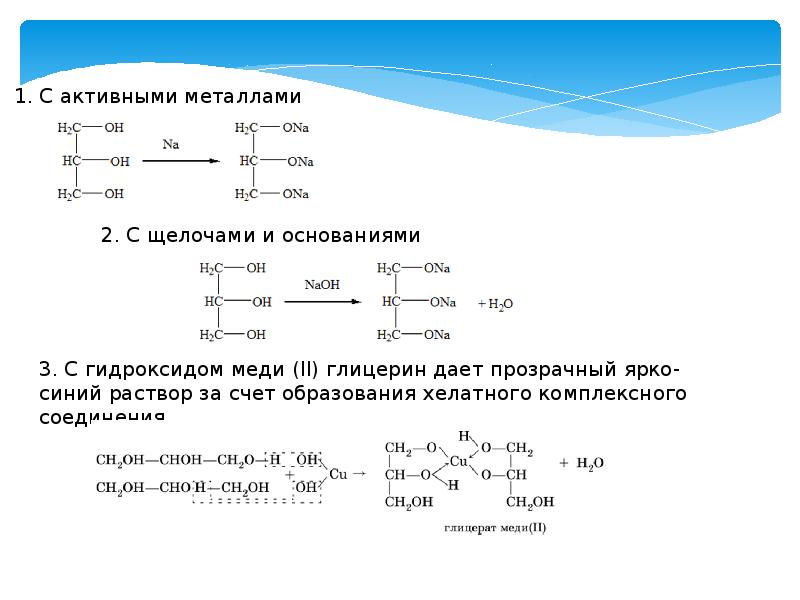 Следовательно, как прямые, так и косвенные взаимодействия преобладают с EG в системе ДНК плюс вода.Поскольку система ЭГ плюс вода имеет более низкую диэлектрическую проницаемость, чем только вода, ожидается, что электростатические взаимодействия будут менее экранированы в присутствии ЭГ.
Следовательно, как прямые, так и косвенные взаимодействия преобладают с EG в системе ДНК плюс вода.Поскольку система ЭГ плюс вода имеет более низкую диэлектрическую проницаемость, чем только вода, ожидается, что электростатические взаимодействия будут менее экранированы в присутствии ЭГ.
Среди других репрезентативных работ о влиянии краудинга на ДНК, Татейши-Каримта и Сугимото [24] изучали три небольших дуплекса и квадруплекс ДНК в различных концентрациях краудинга PEG 200 и PEG 8000 и показали, что, имитируя внутриклеточное скопление, заметное изменение можно наблюдать в стабильности, структуре и функции этих нуклеиновых кислот, которые могут быть очень полезны для целей нанотехнологии.Лю и др. . [25] изучали влияние краудеров на плавление ДНК и показали, что для ДНК с последовательностью A 20 (гомополимер аденина длиной 20 пар оснований) температура плавления увеличивается на 1 К в присутствии фиколла 70, тогда как в фиколле 70- поливинилпирролидон360 температура плавления увеличивается на 7,5 К. Они также пришли к выводу, что краудер большого размера вызывает больший эффект краудинга и, таким образом, приводит к более высокой температуре плавления ДНК. Более того, они заметили, что с увеличением концентрации краудинга в системе температура плавления ДНК увеличивается.Харве и др. . [26] изучили влияние краудинга и ограничения на гибрид ДНК / ДНК и ДНК / РНК и показали, что краудинг и конфайнмент увеличивают образование водородных связей между нуклеотидами. Таким образом, краудинг может способствовать созданию гибридной структуры нуклеотидов независимо от их длины, последовательности или типа. В одной из вычислительных работ Yildirim et al . [27] использовали среду с пониженным диэлектрическим континуумом, чтобы понять конформационное предпочтение ДНК в клеточно-подобной среде, и предположили, что в среде с пониженной диэлектрической проницаемостью каноническая B-форма структуры ДНК смещается в сторону неканонической A-формы структуры ДНК.
Они также пришли к выводу, что краудер большого размера вызывает больший эффект краудинга и, таким образом, приводит к более высокой температуре плавления ДНК. Более того, они заметили, что с увеличением концентрации краудинга в системе температура плавления ДНК увеличивается.Харве и др. . [26] изучили влияние краудинга и ограничения на гибрид ДНК / ДНК и ДНК / РНК и показали, что краудинг и конфайнмент увеличивают образование водородных связей между нуклеотидами. Таким образом, краудинг может способствовать созданию гибридной структуры нуклеотидов независимо от их длины, последовательности или типа. В одной из вычислительных работ Yildirim et al . [27] использовали среду с пониженным диэлектрическим континуумом, чтобы понять конформационное предпочтение ДНК в клеточно-подобной среде, и предположили, что в среде с пониженной диэлектрической проницаемостью каноническая B-форма структуры ДНК смещается в сторону неканонической A-формы структуры ДНК.
В данной работе мы исследовали структуру и термодинамику как ДНК, так и смешанного растворителя, воды и EG. Эта работа отличается от большинства предыдущих работ в том смысле, что и ДНК, и растворители рассматриваются на равных основаниях. Текущая работа также отличается от последней работы, выполненной Накано и др. . [28], где они рассмотрели локализованные свойства воды для G-квадруплекса и шпильки ДНК. Однако наша работа сосредоточена преимущественно на структуре первой сольватной оболочки небольшого сегмента ДНК, содержащей как воду, так и молекулы краудера, наряду с конкуренцией между краудером, молекулами воды и ионами за связывание с ДНК с термодинамической точки зрения на различные концентрации скученности.Мы взяли небольшой сегмент ДНК (последовательность 5’-GACCGAGCAGCCCGTACTCAGTC-3 ‘) в качестве нашей модельной системы. Эту ДНК помещали в растворитель, содержащий воду, EG (концентрация которой варьировалась) и 0,1 М NaCl. С точки зрения статистической механики, это чрезвычайно сложная система с пятью компонентами, имеющими дальнодействие. Многочастичные взаимодействия, присутствующие в системе, были смоделированы с использованием классических силовых полей.
Эта работа отличается от большинства предыдущих работ в том смысле, что и ДНК, и растворители рассматриваются на равных основаниях. Текущая работа также отличается от последней работы, выполненной Накано и др. . [28], где они рассмотрели локализованные свойства воды для G-квадруплекса и шпильки ДНК. Однако наша работа сосредоточена преимущественно на структуре первой сольватной оболочки небольшого сегмента ДНК, содержащей как воду, так и молекулы краудера, наряду с конкуренцией между краудером, молекулами воды и ионами за связывание с ДНК с термодинамической точки зрения на различные концентрации скученности.Мы взяли небольшой сегмент ДНК (последовательность 5’-GACCGAGCAGCCCGTACTCAGTC-3 ‘) в качестве нашей модельной системы. Эту ДНК помещали в растворитель, содержащий воду, EG (концентрация которой варьировалась) и 0,1 М NaCl. С точки зрения статистической механики, это чрезвычайно сложная система с пятью компонентами, имеющими дальнодействие. Многочастичные взаимодействия, присутствующие в системе, были смоделированы с использованием классических силовых полей. Нам было интересно понять как структурные особенности, так и термодинамику этой системы по мере увеличения концентрации ЭГ.Конкретная цель состояла в том, чтобы изучить микроскопическую картину ЭГ и воды рядом с ДНК, чтобы понять их связывание с ДНК и связывание между собой. Структурные флуктуации ДНК и роль ионов по сравнению с молекулами растворителя также были изучены. Одним из интересных аспектов этого исследования была конкуренция между водой и EG в присутствии сильно заряженной ДНК в сольватирующей ДНК. Были рассчитаны различные парно-корреляционные функции (ПКФ) между различными компонентами системы, чтобы получить непротиворечивую картину сольватации и термодинамики сольватации ДНК.Поскольку PCF связан с потенциалом средней силы, каждый PCF указывает среднее влияние остальной системы на степень свободы, учитываемую при вычислении PCF. Наряду с этим стандартным ПКФ, который имеет вклад от всех частей системы, были также рассчитаны локализованные термодинамические свойства, основанные на теории неоднородной сольватации Лазаридиса [29] вблизи ДНК.
Нам было интересно понять как структурные особенности, так и термодинамику этой системы по мере увеличения концентрации ЭГ.Конкретная цель состояла в том, чтобы изучить микроскопическую картину ЭГ и воды рядом с ДНК, чтобы понять их связывание с ДНК и связывание между собой. Структурные флуктуации ДНК и роль ионов по сравнению с молекулами растворителя также были изучены. Одним из интересных аспектов этого исследования была конкуренция между водой и EG в присутствии сильно заряженной ДНК в сольватирующей ДНК. Были рассчитаны различные парно-корреляционные функции (ПКФ) между различными компонентами системы, чтобы получить непротиворечивую картину сольватации и термодинамики сольватации ДНК.Поскольку PCF связан с потенциалом средней силы, каждый PCF указывает среднее влияние остальной системы на степень свободы, учитываемую при вычислении PCF. Наряду с этим стандартным ПКФ, который имеет вклад от всех частей системы, были также рассчитаны локализованные термодинамические свойства, основанные на теории неоднородной сольватации Лазаридиса [29] вблизи ДНК. Трехмерная эталонная модель места взаимодействия (3D-RISM) использовалась для расчета распределения воды [30].Кроме того, также были рассчитаны геометрические параметры, такие как образцы водородных связей между различными видами. И глобальная, и локальная термодинамика, структурные свойства были использованы, чтобы получить полное представление о микроскопической картине этой пятикомпонентной системы.
Трехмерная эталонная модель места взаимодействия (3D-RISM) использовалась для расчета распределения воды [30].Кроме того, также были рассчитаны геометрические параметры, такие как образцы водородных связей между различными видами. И глобальная, и локальная термодинамика, структурные свойства были использованы, чтобы получить полное представление о микроскопической картине этой пятикомпонентной системы.
Обнаружено, что молекулы ЭГ вторгаются в первую гидратную оболочку ДНК с увеличением концентрации ЭГ. Общее количество водородных связей (Н-связей) остается практически неизменным независимо от концентрации краудера.Молекулы Краудера собираются ближе к ДНК, заменяя воду. Однако замена воды после первой сольватационной оболочки происходит намного меньше. Население иона Na + вблизи ДНК увеличивается с увеличением концентрации ЭГ. Однако популяция Cl — уменьшается, что позволяет предположить, что область, близкая к ДНК, приобретает более отрицательную плотность заряда по мере добавления более плотных молекул.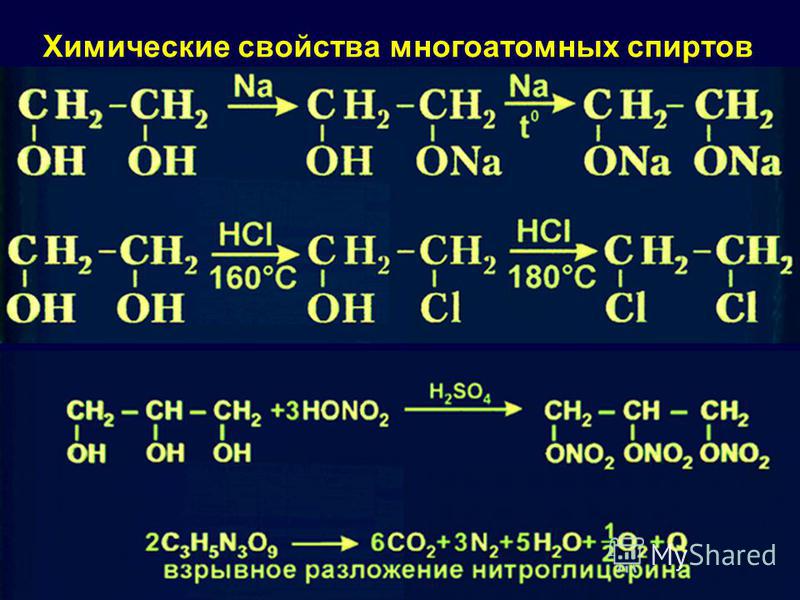 Было обнаружено, что средняя свободная энергия в расчете на воду изменяется от отрицательных к положительным значениям по мере увеличения концентрации краудера, но система стабилизируется благодаря компенсирующему эффекту EG в первой сольватной оболочке.Тонкие эффекты термодинамики, в основном энтальпийные, модулируют сложное поведение этой системы.
Было обнаружено, что средняя свободная энергия в расчете на воду изменяется от отрицательных к положительным значениям по мере увеличения концентрации краудера, но система стабилизируется благодаря компенсирующему эффекту EG в первой сольватной оболочке.Тонкие эффекты термодинамики, в основном энтальпийные, модулируют сложное поведение этой системы.
Методы
В этом разделе краткое описание моделирования молекулярной динамики и используемых методов, i . и ., Теория неоднородной сольватации по сетке (GIST) и модель эталонного места взаимодействия (RISM) для анализа роли воды, EG и соли в небольшом дуплексе ДНК. Для получения подробной информации об этих методах читатели могут быть отосланы к оригинальной литературе.
Сеточная теория неоднородной сольватации (GIST)
GIST был разработан Нгуеном и др. . [31], который основан на новаторской теории неоднородной сольватации (IST), предложенной Lazaridis и др. . [29,32]. В IST растворенное вещество создает поле в растворителе, вызывая колебания плотности растворителя. Можно считать, что термодинамические свойства IST происходят из двух источников. Первый — это локальное взаимодействие между растворенным веществом и растворителем (местный эффект), а второй — «разбавление» растворителя из-за присутствия растворенного вещества (термин высвобождения — глобальный эффект).В этом методе общее воздействие растворенного вещества на растворитель было приблизительно разделено на локальные и нелокальные эффекты, чтобы рассчитать свойства области растворителя ( e , g ., Первая сольватационная оболочка) при введении растворенное вещество.
В IST растворенное вещество создает поле в растворителе, вызывая колебания плотности растворителя. Можно считать, что термодинамические свойства IST происходят из двух источников. Первый — это локальное взаимодействие между растворенным веществом и растворителем (местный эффект), а второй — «разбавление» растворителя из-за присутствия растворенного вещества (термин высвобождения — глобальный эффект).В этом методе общее воздействие растворенного вещества на растворитель было приблизительно разделено на локальные и нелокальные эффекты, чтобы рассчитать свойства области растворителя ( e , g ., Первая сольватационная оболочка) при введении растворенное вещество.
В методе GIST все термины, приведенные в IST, не учитываются при оценке энтропии и энтальпии. Для энтропии учитывается только термин растворенное вещество-растворитель (энтропия реорганизации воды не учитывается). При расчете энтальпии сольватации учитываются взаимодействия как растворенное вещество-растворитель, так и взаимодействие растворитель-растворитель (высвобождающая часть взаимодействия растворитель-растворитель не учитывается). Численные оценки трехмерных (3D) интегралов, появляющихся в выражении энтропии и энергии в теории неоднородной сольватации Лазаридиса, выполняются с использованием дискретных сумм по трехмерным сеточным вокселям. Интересующая трехмерная область R, которая может содержать как растворенное вещество, так и растворитель, делится на небольшие сетки или воксели. Термодинамические величины рассчитываются для каждого из вокселей из траектории молекулярной динамики (МД).
Численные оценки трехмерных (3D) интегралов, появляющихся в выражении энтропии и энергии в теории неоднородной сольватации Лазаридиса, выполняются с использованием дискретных сумм по трехмерным сеточным вокселям. Интересующая трехмерная область R, которая может содержать как растворенное вещество, так и растворитель, делится на небольшие сетки или воксели. Термодинамические величины рассчитываются для каждого из вокселей из траектории молекулярной динамики (МД).
Парная корреляционная функция или функция радиального распределения г ( r k ) воды для воксела с центром в позиции r k определяется как: где N k — общее количество молекул воды, суммированное по всем N f кадрам траектории, атомы кислорода которой находятся в вокселе k , ρ 0 — объемная плотность воды, а V k — объем воксела k .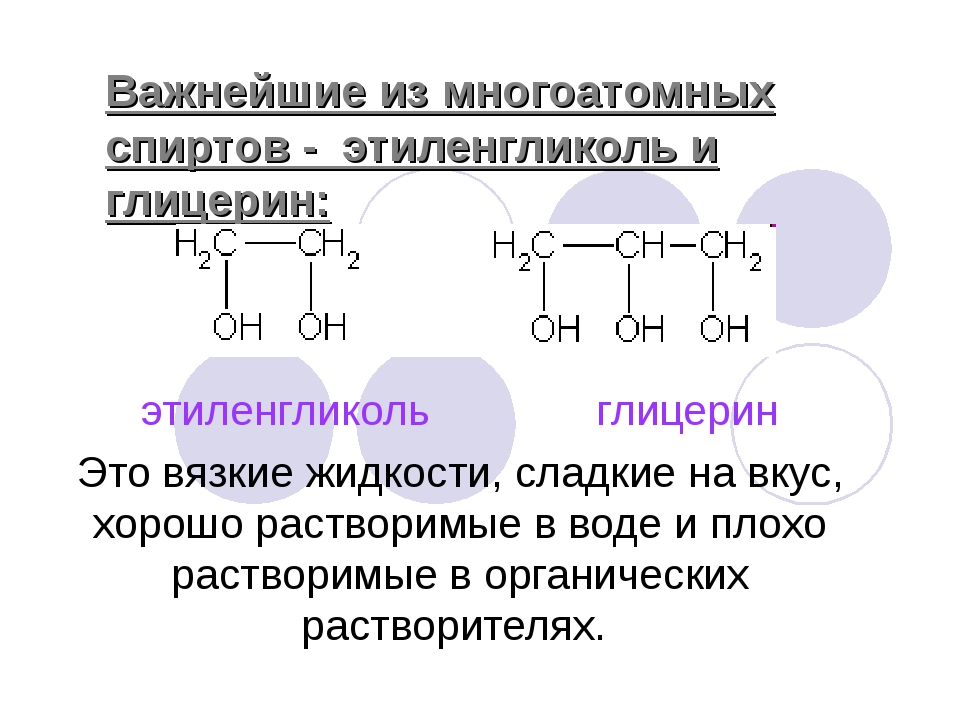
GIST использует значения g ( r k ) и параметры силового поля, определенные для МД-моделирования, для вычисления термодинамических величин для каждого воксела определенной области R. Значения термодинамических величин для всех вокселей области R добавляются, чтобы получить общую сумму. Наконец, разделив значения этих термодинамических величин для области R на среднее количество молекул воды, присутствующих в области R, мы получим нормированные значения соответствующих термодинамических величин на воду.
Нормализованная средняя свободная энергия (которая используется в данной работе) на молекулу воды по отношению к объемной воде в области R определяется как где, и представляют разницу в потенциале взаимодействия растворенное вещество-вода и вода-вода в области R по отношению к системе объемной воды, а и представляют собой изменение трансляции и ориентационной энтропии на воду в области R по отношению к системе объемной воды.
Следует отметить, что существуют некоторые ограничения в методе GIST, такие как растворенное вещество удерживается, а скопления и ионы соли удаляются с траектории, потому что все остальное, кроме воды, считается растворенным веществом в GIST. Таким образом, GIST не учитывает прямое присутствие краудеров и ионов соли в кадрах траектории. Однако в расчет включается объем, исключенный краудсерами. Результаты, полученные от GIST, следует брать с этими приближениями.
Таким образом, GIST не учитывает прямое присутствие краудеров и ионов соли в кадрах траектории. Однако в расчет включается объем, исключенный краудсерами. Результаты, полученные от GIST, следует брать с этими приближениями.
3D-RISM: трехмерная эталонная модель сайта взаимодействия
Ниже приводится краткое введение в метод 3D-RISM. Чтобы узнать о дальнейших подробностях, читатель может ознакомиться с оригинальной литературой [33–35]. Расчет 3D-RISM использует уравнение Орнштейна-Цернике (OZ), которое приведено ниже для однокомпонентной молекулярной жидкости; где h (1 , 2) и c (1 , 2) представляют собой функцию полной и прямой корреляции, соответственно. ρ — плотность жидкости. Числа в скобках представляют положение и ориентационные координаты. В методе 3D-RISM распределение плотности растворителя (который может включать соль) рассчитывается вокруг растворенного вещества с фиксированной геометрией. g (1 , 2) связано с общей корреляционной функцией h (1 , 2) как g (1 , 2) = h (1 , 2) — 1 .
Перед расчетом 3D-RISM свойства растворителя рассчитываются с использованием одномерного (1D) RISM, который дает функцию парной корреляции между различными участками молекулярной жидкости (эти участки обычно центрированы по атомам, но не обязательно).Уравнение OZ требует другого уравнения, связывающего h и c (замыкающее отношение), чтобы его решение стало возможным. Некоторые из вариантов: Перкус-Йевик (PY), Уравнение гиперсетевой цепи (HNC) и Коваленка-Хирата (KH). В этой работе замыкание KH использовалось с диэлектрически согласованной (DRISM) версией RISM. В данной работе использовался стандартный протокол выполнения расчета RISM. Сначала был проведен 1D-RISM расчет воды с концентрацией 0,1 М NaCl.Это дает функцию парной корреляции и функцию восприимчивости, которые необходимы для расчета 3D-RISM.
Детали моделирования молекулярной динамики (МД)
Чтобы исследовать влияние краудинга на структуру ДНК, сольватацию, термодинамику сольватации и сложное взаимодействие между различными молекулярными частицами при сольватации ДНК, ДНК из 23 пар оснований (5′-GACCGAGCAGCCCGTACTCAGTC-3 ‘) (схематическое изображение смоделированная ДНК и атомы, определяющие большую и малую бороздки, показаны на рис. 1).В этом исследовании в качестве краудера использовался этиленгликоль (EG). Структура ДНК была создана с помощью программы nab , доступной в AMBER14 [36]. Атомный заряд EG был рассчитан на уровне теории RHF / 6-31G * с использованием процедуры RESP [37], реализованной на сервере RED [37-40] (атомные заряды приведены в таблице A в файле S1). Параметры силового поля, отличные от зарядов, были получены с использованием предкамеры [41] и багра [42]. Для молекулярной упаковки воды (TIP3P), ЭГ и ДНК использовался пакет Packmol [43].Для моделирования молекулярной динамики исходные структуры были подготовлены с использованием модуля tleap AMBER14. ДНК моделировали в четырех различных средах с различной концентрацией EG (0%, 10%, 20% и 30% EG по объему модуля моделирования) и использовали концентрацию соли (NaCl) 0,1 M. Для ионов Na + и Cl — использовались параметры ионов Йонга и Читама [44]. Состав четырех систем приведен в Таблице 1. В остальной части рукописи различные системы будут обозначаться начальным заполнением объема краудерами ( и .
1).В этом исследовании в качестве краудера использовался этиленгликоль (EG). Структура ДНК была создана с помощью программы nab , доступной в AMBER14 [36]. Атомный заряд EG был рассчитан на уровне теории RHF / 6-31G * с использованием процедуры RESP [37], реализованной на сервере RED [37-40] (атомные заряды приведены в таблице A в файле S1). Параметры силового поля, отличные от зарядов, были получены с использованием предкамеры [41] и багра [42]. Для молекулярной упаковки воды (TIP3P), ЭГ и ДНК использовался пакет Packmol [43].Для моделирования молекулярной динамики исходные структуры были подготовлены с использованием модуля tleap AMBER14. ДНК моделировали в четырех различных средах с различной концентрацией EG (0%, 10%, 20% и 30% EG по объему модуля моделирования) и использовали концентрацию соли (NaCl) 0,1 M. Для ионов Na + и Cl — использовались параметры ионов Йонга и Читама [44]. Состав четырех систем приведен в Таблице 1. В остальной части рукописи различные системы будут обозначаться начальным заполнением объема краудерами ( и . e ., 0%, 10%, 20% и 30%).
e ., 0%, 10%, 20% и 30%).
Все МД-моделирование проводилось с использованием пакета AMBER14 [36]. Для ДНК использовалось силовое поле ff12sb (ff99bsc0) [45–48]. Метод Эвальда между частицами и сеткой (PME) [49] использовался для расчета электростатических взаимодействий, а алгоритм SHAKE [50] использовался для ограничения связей с участием атомов водорода. Температуру контролировали с помощью динамики Ланжевена [51], а постоянное давление поддерживали с помощью баростата Берендсена [52].
Минимизация энергии всех четырех систем была проведена в три этапа: во-первых, путем ограничения ДНК и EG, растворитель (вода) и ионы были минимизированы.На втором этапе молекулы воды, ионы и ЭГ были минимизированы путем ограничения ДНК, а на третьем этапе вся система была минимизирована. Затем последовал постепенный нагрев системы в шесть этапов с шагом 50 K на каждом этапе в ансамбле NVT. В процессе нагрева сдерживались молекулы ДНК и ЭГ. После нагрева системы уравновешивались в течение 60 пс в 5 этапов в ансамбле NPT. Во время уравновешивания ограничение от ДНК последовательно снижалось с 10 до 0 ккал / моль (10, 5, 1, 0.1, 0,0). После уравновешивания все системы были смоделированы (производственный цикл) в течение 100 нс с временным шагом 2 фс. Для всех четырех систем были проведены три независимые траектории. Для проверки сходимости нашего моделирования одна траектория из трех была продлена до 300 нс. Следовательно, для каждой концентрации было проведено моделирование МД длительностью 500 нс. Если не указано иное, все графики, показанные в этой рукописи, взяты из прогона MD 500 нс.
Во время уравновешивания ограничение от ДНК последовательно снижалось с 10 до 0 ккал / моль (10, 5, 1, 0.1, 0,0). После уравновешивания все системы были смоделированы (производственный цикл) в течение 100 нс с временным шагом 2 фс. Для всех четырех систем были проведены три независимые траектории. Для проверки сходимости нашего моделирования одна траектория из трех была продлена до 300 нс. Следовательно, для каждой концентрации было проведено моделирование МД длительностью 500 нс. Если не указано иное, все графики, показанные в этой рукописи, взяты из прогона MD 500 нс.
Есть две проблемы с точностью наших результатов, полученных при моделировании MD.Во-первых, это выбор силового поля, а во-вторых, сходимость траекторий. Что касается проблемы силового поля, следует отметить, что в этой работе мы использовали силовое поле ff99bsc0 для ДНК при моделировании. Поскольку существует более новое силовое поле ff99parmbsc1 [53], доступное для ДНК в AMBER, мы сравнили как структурные, так и термодинамические свойства системы ДНК плюс вода, используя оба силовых поля. Мы исследовали разницу в различных структурах ДНК и свойствах растворителей, таких как среднеквадратичное отклонение (RMSD), среднеквадратичное отклонение (RMSF), расстояние от конца до конца, угол изгиба ДНК и парная корреляционная функция (PCF) воды вокруг остова ДНК. (обсуждается в разделе 1 файла S1 и на рисунках A, B, C и D в файле S1).Мы заметили, что, за исключением RMSD, ни одно из рассчитанных свойств не показало значительной разницы при использовании любого из двух силовых полей. Поскольку основное внимание в этой статье уделялось взаимодействию воды (и краудера) с ДНК в терминах их ПКФ (который связан с потенциалом средней силы), мы полагаем, что наши результаты будут существенно нечувствительны к выбору различных (недавних) ЯНТАРНЫЕ силовые поля.
Мы исследовали разницу в различных структурах ДНК и свойствах растворителей, таких как среднеквадратичное отклонение (RMSD), среднеквадратичное отклонение (RMSF), расстояние от конца до конца, угол изгиба ДНК и парная корреляционная функция (PCF) воды вокруг остова ДНК. (обсуждается в разделе 1 файла S1 и на рисунках A, B, C и D в файле S1).Мы заметили, что, за исключением RMSD, ни одно из рассчитанных свойств не показало значительной разницы при использовании любого из двух силовых полей. Поскольку основное внимание в этой статье уделялось взаимодействию воды (и краудера) с ДНК в терминах их ПКФ (который связан с потенциалом средней силы), мы полагаем, что наши результаты будут существенно нечувствительны к выбору различных (недавних) ЯНТАРНЫЕ силовые поля.
Сходимость траекторий моделирования является критической точкой с точки зрения распределения различных частиц (воды, ЭГ и ионов).Известно, что сближение распределения ионов занимает больше всего времени среди рассматриваемых в данной работе разновидностей. Мы проверили сходимость ионов, вычислив среднюю популяцию Na + вокруг ДНК. Мы рассчитали среднюю популяцию Na + в большой и малой бороздке ДНК при различной концентрации краудинга, используя программное обеспечение CURVES + и CANION, которое использует систему криволинейных геликоидальных координат (CHC) для расчета распределения [54]. В этом представлении колебания ДНК намного меньше по сравнению с декартовым представлением.Три параметра D, R и A используются для определения положения или координат ионов, где D, R и A представляют шаг пары оснований, расстояние между ионом и осью спирали, соответствующее шагу пары оснований, и угол между вектором R и вектор, представляющий длинную ось шага пары оснований, соответственно. Значения R были приняты равными 10,25 Å, значение A было взято от 33 до 147 градусов для малой канавки и упора для большой канавки, а значение D было взято от 2 до 22 (подробное описание см. В дополнительных материалах [54]).Из рисунка E в файле S1 видно, что схождение основных канавок при каждой концентрации происходит по аналогичной схеме, и сходимость достигается в пределах 300 нс.
Мы проверили сходимость ионов, вычислив среднюю популяцию Na + вокруг ДНК. Мы рассчитали среднюю популяцию Na + в большой и малой бороздке ДНК при различной концентрации краудинга, используя программное обеспечение CURVES + и CANION, которое использует систему криволинейных геликоидальных координат (CHC) для расчета распределения [54]. В этом представлении колебания ДНК намного меньше по сравнению с декартовым представлением.Три параметра D, R и A используются для определения положения или координат ионов, где D, R и A представляют шаг пары оснований, расстояние между ионом и осью спирали, соответствующее шагу пары оснований, и угол между вектором R и вектор, представляющий длинную ось шага пары оснований, соответственно. Значения R были приняты равными 10,25 Å, значение A было взято от 33 до 147 градусов для малой канавки и упора для большой канавки, а значение D было взято от 2 до 22 (подробное описание см. В дополнительных материалах [54]).Из рисунка E в файле S1 видно, что схождение основных канавок при каждой концентрации происходит по аналогичной схеме, и сходимость достигается в пределах 300 нс. Для малой бороздки разница больше между различными концентрациями EG. За исключением системы 30% EG, другие системы сходятся в пределах 300 нс. Для системы 30% EG сходимость достигается около 400 нс. Для воды и EG известно, что прямой расчет их плотности вокруг ДНК будет нечетким в результате флуктуации ДНК.Для этого мы идентифицировали два участка из 4 пар оснований (GAGC и TACT из последовательности ДНК 5’-GACCGAGCAGCCCGTACTCAGTC-3 ‘), которые демонстрируют наименьшие колебания, как видно из графика RMSF на рис. 2 (b). Для этих двух участков мы рассчитали распределение воды и EG с помощью модуля GRID (описанного в разделе 2 в файле S1) CPPTRAJ вокруг этих двух участков. Рисунки F-L в файле S1 показывают, что концентрации воды и EG хорошо сходятся для всех четырех систем. Более того, наши рассчитанные ПКФ (описанные в следующих разделах) остаются неизменными при увеличении длины одной траектории на 200 нс.Следовательно, мы можем сделать вывод, что все моделирование сходилось для интересующих нас свойств.
Для малой бороздки разница больше между различными концентрациями EG. За исключением системы 30% EG, другие системы сходятся в пределах 300 нс. Для системы 30% EG сходимость достигается около 400 нс. Для воды и EG известно, что прямой расчет их плотности вокруг ДНК будет нечетким в результате флуктуации ДНК.Для этого мы идентифицировали два участка из 4 пар оснований (GAGC и TACT из последовательности ДНК 5’-GACCGAGCAGCCCGTACTCAGTC-3 ‘), которые демонстрируют наименьшие колебания, как видно из графика RMSF на рис. 2 (b). Для этих двух участков мы рассчитали распределение воды и EG с помощью модуля GRID (описанного в разделе 2 в файле S1) CPPTRAJ вокруг этих двух участков. Рисунки F-L в файле S1 показывают, что концентрации воды и EG хорошо сходятся для всех четырех систем. Более того, наши рассчитанные ПКФ (описанные в следующих разделах) остаются неизменными при увеличении длины одной траектории на 200 нс.Следовательно, мы можем сделать вывод, что все моделирование сходилось для интересующих нас свойств.
Рис. 2.
(a) Среднее среднеквадратичное отклонение (RMSD) в Å по отношению к исходной структуре, использованной в моделировании. (b) Среднее среднеквадратичное отклонение (RMSF) в Å для каждого основания ДНК.
https://doi.org/10.1371/journal.pone.0206359.g002
Подробная информация о расчетах GIST и RISM
Чтобы понять термодинамику сольватации ДНК, была использована программа GIST [29,55] AMBER14.Для расчетов GIST было выполнено отдельное моделирование путем ограничения ДНК для всех четырех систем. Для всех четырех систем были запущены две траектории по 100 нс каждая. Объемная плотность воды ? 0 и средняя энергия взаимодействия вода-вода были рассчитаны на основе отдельного 100-нс моделирования водяного бокса TIP3P.
Расчет RISM проводился в два этапа. Сначала стандартные RISM-расчеты с замыканием KH проводились при 300 K с плотностью воды 55.5 M и концентрация NaCl 0,1 M. Это дает функцию восприимчивости к растворителю в одном измерении, которая использовалась на следующем этапе для расчета 3D-RISM. Расчеты 3D-RISM были выполнены с закрытием KH [35] для 50 снимков каждой системы с буферным расстоянием для растворителя 30 Å. Все ПКФ в этой работе были рассчитаны с размером ячейки 0,1 Å, за исключением ДНК-Cl – ПКФ, где размер ячейки был взят 0,5 Å.
Расчеты 3D-RISM были выполнены с закрытием KH [35] для 50 снимков каждой системы с буферным расстоянием для растворителя 30 Å. Все ПКФ в этой работе были рассчитаны с размером ячейки 0,1 Å, за исключением ДНК-Cl – ПКФ, где размер ячейки был взят 0,5 Å.
Результаты
1. Вариация структуры ДНК при различных концентрациях краудинга
Чтобы исследовать структурные вариации ДНК, рассматриваемой в этом исследовании, мы рассчитали различные структурные свойства, такие как среднеквадратичное отклонение (RMSD), среднеквадратичное отклонение (RMSF), ширину большой и малой бороздок ДНК с увеличением большая концентрация.RMSD ДНК относительно исходной структуры для каждой системы показано на рис. 2 (а) после усреднения по трем траекториям. Структура ДНК при концентрации краудинга 0% имеет среднее RMSD 5,6 ± 0,58 Å (число после 5,6 обозначает стандартное отклонение) относительно исходной структуры ДНК. При концентрации краудинга 10%, 20% и 30% среднее RMSD составляет 6,5 ± 0,64 Å, 6,4 ± 0,67 Å и 6,7 ± 0,65 Å при концентрациях EG 10%, 20% и 30% соответственно. Чтобы лучше понять колебания в структуре ДНК, мы дополнительно вычислили среднеквадратичное колебание (RMSF) каждого основания в ДНК, которое показано на рис. 2 (b).Существенной разницы в RMSF оснований ДНК с увеличением концентрации EG не наблюдалось. Кроме того, сравнивая среднюю структуру ДНК при различных концентрациях скученности (Рисунок M в файле S1), мы заметили, что общая структура ДНК не изменилась с увеличением скученности в среде (RMSD средней структуры при 10% , 20% и 30% скученности по отношению к 0% скученности составляют 0,268 Å, 0,274 Å и 0,457 Å соответственно). Кроме того, мы также рассчитали общее количество водородных связей, образованных между основаниями ДНК для соответствующих четырех систем краудинга.Мы заметили, что общее количество водородных связей по существу не изменяется с увеличением концентрации краудинга (Рисунок N в файле S1) (среднее количество водородных связей для 0%, 10%, 20% и 30% краудинга составляет 66,53 ± 2,87. , 66,26 ± 2,96, 65,86 ± 3,23 и 66,73 ± 2,89 соответственно).
Чтобы лучше понять колебания в структуре ДНК, мы дополнительно вычислили среднеквадратичное колебание (RMSF) каждого основания в ДНК, которое показано на рис. 2 (b).Существенной разницы в RMSF оснований ДНК с увеличением концентрации EG не наблюдалось. Кроме того, сравнивая среднюю структуру ДНК при различных концентрациях скученности (Рисунок M в файле S1), мы заметили, что общая структура ДНК не изменилась с увеличением скученности в среде (RMSD средней структуры при 10% , 20% и 30% скученности по отношению к 0% скученности составляют 0,268 Å, 0,274 Å и 0,457 Å соответственно). Кроме того, мы также рассчитали общее количество водородных связей, образованных между основаниями ДНК для соответствующих четырех систем краудинга.Мы заметили, что общее количество водородных связей по существу не изменяется с увеличением концентрации краудинга (Рисунок N в файле S1) (среднее количество водородных связей для 0%, 10%, 20% и 30% краудинга составляет 66,53 ± 2,87. , 66,26 ± 2,96, 65,86 ± 3,23 и 66,73 ± 2,89 соответственно). Из приведенных выше результатов можно сделать вывод, что нет никаких серьезных различий в структуре ДНК в результате увеличения концентрации скопления, за исключением увеличения флуктуации структуры в условиях скопления людей.
Из приведенных выше результатов можно сделать вывод, что нет никаких серьезных различий в структуре ДНК в результате увеличения концентрации скопления, за исключением увеличения флуктуации структуры в условиях скопления людей.
Чтобы понять влияние скученности на структуру ДНК, мы рассчитали ширину большой и малой бороздок ДНК. Ширина основной и малой бороздок была рассчитана с использованием метода, разработанного Hassan & Calladine [56]. Этот метод рассчитывает расстояния между нитями P-P с учетом направления сахарно-фосфатного остова. Мы дополнительно скорректировали ширину большой и малой канавок, вычтя 5,8 Å из полученных значений ширины, которые соответствуют ван-дер-ваальсовым радиусам двух фосфатов.Ширина большой и малой бороздок свободных концевых остатков в ДНК не рассчитывалась из-за их больших колебаний. Следовательно, на рис. 3 (a) и 3 (b) показаны ширина большой и малой бороздок 21 пары оснований ДНК. Как видно из фиг. 3 (a) и 3 (b), не наблюдалось значительных различий в ширине большой и малой бороздок ДНК при различных концентрациях скопления.
Мы проанализировали другие параметры структуры ДНК с помощью инструмента 3DNA [57]. Параметры ДНК, такие как смещение, скольжение, подъем, наклон, крен, скручивание, смещение по оси x, смещение по оси Y, наклон и вершина, были рассчитаны и показаны на рисунках O и P в файле S1.Помимо структурных параметров ДНК, мы также проанализировали расстояние от конца до конца ДНК и угол изгиба ДНК (рисунок Q в файле S1). Среднее расстояние от конца до конца (в Å) составило 70,33 ± 1,94, 70,67 ± 2,37, 69,87 ± 2,18 и 70,44 ± 2,55 для 0%, 10%, 20% и 30% загруженных систем соответственно. Средний угол изгиба (в градусах) ДНК составил 164,09 ± 8,64, 164,04 ± 8,28, 161,18 ± 10,00 и 163,38 ± 8,45 для 0%, 10%, 20% и 30% скученных систем соответственно. По существу, не наблюдалось заметных изменений в структурных параметрах ДНК, расстоянии от конца до конца ДНК и углу изгиба ДНК при различных концентрациях краудинга.
Анализ существенной динамики ДНК.
Анализ существенной динамики [58] был проведен для исследования влияния увеличения концентрации краудера на конформационную динамику и основные движения молекулы ДНК, поскольку динамическое поведение любой биологической молекулы является ключом к их функции. Существенный анализ динамики был выполнен путем выполнения анализа главных компонентов (ПК) с использованием модуля cpptraj в AMBER14. Поскольку было показано, что приблизительно 100 собственных векторов могут объяснить почти всю вариацию ДНК независимо от ее последовательности [59], мы рассчитали первые 100 ПК для всех четырех систем.Мы заметили, что первые два ПК по существу захватили 70% основных движений, связанных с молекулой ДНК. Оба ПК, и . и ., PC1 и PC2 показывают изгибающее движение ДНК, но в ортогональных направлениях (рис. 4), которое по существу остается одинаковым во всех системах, и . и ., Порядок этих ПК остается неизменным во всех четырех системах (от 0% до 30% EG). Кроме того, вклады относительного движения различных оснований в первые два компонента также оказались сопоставимыми во всех четырех системах (как показано на рис. 4 (c) и 4 (d)).Приведенные выше наблюдения показывают, что компьютеры не переворачиваются, и .
Существенный анализ динамики был выполнен путем выполнения анализа главных компонентов (ПК) с использованием модуля cpptraj в AMBER14. Поскольку было показано, что приблизительно 100 собственных векторов могут объяснить почти всю вариацию ДНК независимо от ее последовательности [59], мы рассчитали первые 100 ПК для всех четырех систем.Мы заметили, что первые два ПК по существу захватили 70% основных движений, связанных с молекулой ДНК. Оба ПК, и . и ., PC1 и PC2 показывают изгибающее движение ДНК, но в ортогональных направлениях (рис. 4), которое по существу остается одинаковым во всех системах, и . и ., Порядок этих ПК остается неизменным во всех четырех системах (от 0% до 30% EG). Кроме того, вклады относительного движения различных оснований в первые два компонента также оказались сопоставимыми во всех четырех системах (как показано на рис. 4 (c) и 4 (d)).Приведенные выше наблюдения показывают, что компьютеры не переворачиваются, и . и ., Основные движения ДНК остаются в основном такими же с увеличением концентрации краудера. Это означает, что динамика ДНК не изменяется при изменении среды скопления людей, что согласуется с приведенным выше разделом.
и ., Основные движения ДНК остаются в основном такими же с увеличением концентрации краудера. Это означает, что динамика ДНК не изменяется при изменении среды скопления людей, что согласуется с приведенным выше разделом.
Рис. 4. Основные движения ДНК, зафиксированные первыми двумя ПК, и вклад относительного движения различных оснований в ПК.
(a) Первый режим, показывающий изгибающееся движение ДНК.(b) Второй режим, показывающий изгибающее движение ДНК в направлении, перпендикулярном первому ПК. (c) RMSF в Å, рассчитанная вдоль первого ПК. (d) RMSF в Å, рассчитанная по второму ПК.
https://doi.org/10.1371/journal.pone.0206359.g004
PCA дает важное представление о природе основных движений биомолекул. Собственные векторы, спроецированные на декартовы координаты, дают информацию о движении биомолекулы, связанной с каждым собственным вектором.К сожалению, учитывая высокую размерность, сравнение движений, связанных с каждым собственным вектором, количественно для нескольких систем очень сложно. Принимая во внимание это, мы далее вычислили два индекса подобия γ и ζ [60,61] (описанных в разделе 3 в файле S1) между первыми десятью собственными векторами четырех систем, чтобы зафиксировать изменение в динамике ДНК как эффект увеличения концентрации скученности. Обе меры сходства отражают, насколько хорошо существенная динамика данных биомолекул следует конформационному переходу.Их значения варьируются от 0 (нет сходства) до 1 (идентичные движения). Индекс абсолютного подобия, γ, придает равный вес всем собственным векторам важного пространства (определяемого «важным набором» собственных векторов) и, таким образом, нечувствителен к относительной важности собственных векторов, а также к перестановкам, сделанным в собственных векторах в существенных космос. Напротив, ζ учитывает относительную важность собственных векторов, а также может обнаруживать перестановки, сделанные в собственных векторах. В целом поведение обоих индексов подобия схоже.Однако было показано, что ζ более эффективен при различении аномальных условий [60].
Принимая во внимание это, мы далее вычислили два индекса подобия γ и ζ [60,61] (описанных в разделе 3 в файле S1) между первыми десятью собственными векторами четырех систем, чтобы зафиксировать изменение в динамике ДНК как эффект увеличения концентрации скученности. Обе меры сходства отражают, насколько хорошо существенная динамика данных биомолекул следует конформационному переходу.Их значения варьируются от 0 (нет сходства) до 1 (идентичные движения). Индекс абсолютного подобия, γ, придает равный вес всем собственным векторам важного пространства (определяемого «важным набором» собственных векторов) и, таким образом, нечувствителен к относительной важности собственных векторов, а также к перестановкам, сделанным в собственных векторах в существенных космос. Напротив, ζ учитывает относительную важность собственных векторов, а также может обнаруживать перестановки, сделанные в собственных векторах. В целом поведение обоих индексов подобия схоже.Однако было показано, что ζ более эффективен при различении аномальных условий [60]. Рисунок R в файле S1 показывает, что существует близкое сходство между характером движений, отобранных ДНК во всех четырех системах. Индекс абсолютного сходства γ находится в диапазоне от 0,84 до 0,94, а значения ζ также находятся в диапазоне от 0,84 до 0,94. Это говорит о том, что динамика ДНК не изменяется при изменении среды скопления людей.
Рисунок R в файле S1 показывает, что существует близкое сходство между характером движений, отобранных ДНК во всех четырех системах. Индекс абсолютного сходства γ находится в диапазоне от 0,84 до 0,94, а значения ζ также находятся в диапазоне от 0,84 до 0,94. Это говорит о том, что динамика ДНК не изменяется при изменении среды скопления людей.
2. Структурные свойства воды и краудера
2.1 Парная корреляционная функция (ПКФ) воды и скопления ДНК.
PCF (г (r)) воды и молекул краудера вокруг основной цепи ДНК были рассчитаны для понимания сольватационной структуры ДНК при различной концентрации молекул краудера. G (r) атома вида (воды или краудера) вокруг атома ДНК определяется как: где ρ ( r ) — плотность атома этого вида на расстоянии r от атома ДНК, а ρ ° — объемная плотность этого вида.
Объемная плотность воды и молекул краудера для различных систем приведена в таблице 2. Они были получены путем деления общего количества видов каждого типа на средний размер ящика в моделировании. Все функции радиального распределения для системы с скоплением 0%, 10%, 20% и 30% были нормализованы с соответствующей объемной плотностью системы при 300 К. Парная корреляционная функция кислорода воды и кислорода (O1) скопления вокруг атома OP1 ДНК (усредненная по всем атомам OP1) показана на рис. 5 (а) и 5 (б) соответственно.Парная корреляционная функция O1 и O4 краудера вокруг атома OP1 ДНК оказалась одинаковой. Когда ДНК поддерживается при концентрации скопления 0%, высота первого пика ( i , e , вероятность найти воду на таком расстоянии) составляет 2,60, в то время как при концентрации скопления 10% высота первого пика составляет 2,46 (рис. 5 (а)). Для систем с 20% и 30% загруженностью высота первого пика составляет 2,41 и 2,40 соответственно. Высота первого пика для графика g (r) краудера-ДНК составляет 5,44 при 10% концентрации краудера (рис. 5 (b)).Это указывает на то, что вероятность найти краудера рядом с ДНК намного больше, чем найти его в большом количестве по сравнению с обнаружением воды в этих двух регионах.
Все функции радиального распределения для системы с скоплением 0%, 10%, 20% и 30% были нормализованы с соответствующей объемной плотностью системы при 300 К. Парная корреляционная функция кислорода воды и кислорода (O1) скопления вокруг атома OP1 ДНК (усредненная по всем атомам OP1) показана на рис. 5 (а) и 5 (б) соответственно.Парная корреляционная функция O1 и O4 краудера вокруг атома OP1 ДНК оказалась одинаковой. Когда ДНК поддерживается при концентрации скопления 0%, высота первого пика ( i , e , вероятность найти воду на таком расстоянии) составляет 2,60, в то время как при концентрации скопления 10% высота первого пика составляет 2,46 (рис. 5 (а)). Для систем с 20% и 30% загруженностью высота первого пика составляет 2,41 и 2,40 соответственно. Высота первого пика для графика g (r) краудера-ДНК составляет 5,44 при 10% концентрации краудера (рис. 5 (b)).Это указывает на то, что вероятность найти краудера рядом с ДНК намного больше, чем найти его в большом количестве по сравнению с обнаружением воды в этих двух регионах. При концентрациях скопления 20% и 30% высота первого пика составляет 4,50 и 4,63. Это показывает, что при увеличении концентрации краудинга плотность краудера вокруг атома OP1 ДНК уменьшается по сравнению с объемной плотностью в их соответствующих системах. Это означает, что проникновение молекул краудера в первую сольватную оболочку ДНК уменьшается по сравнению с их объемной плотностью краудера с увеличением концентрации краудинга.
При концентрациях скопления 20% и 30% высота первого пика составляет 4,50 и 4,63. Это показывает, что при увеличении концентрации краудинга плотность краудера вокруг атома OP1 ДНК уменьшается по сравнению с объемной плотностью в их соответствующих системах. Это означает, что проникновение молекул краудера в первую сольватную оболочку ДНК уменьшается по сравнению с их объемной плотностью краудера с увеличением концентрации краудинга.
Рис. 5. Функции радиального распределения кислорода воды и краудера вокруг атома OP1 ДНК.
(а) г (г) кислорода воды вокруг атома OP1 остова ДНК. Ось X представляет собой расстояние между кислородом воды и атомом OP1 ДНК, а ось Y представляет собой g (r). G (r) нормировано на объемную плотность воды для соответствующих систем. (б) g (r) O1 краудера (EG) вокруг атома OP1 остова ДНК. G (r) нормировано на объемную плотность краудера для соответствующих систем.Спутниковый снимок также показан на (a) и (b), который представляет увеличенный вид первого пика g (r).
https://doi.org/10.1371/journal.pone.0206359.g005
Далее мы вычислили координационное число молекул воды и краудера в первой сольватной оболочке OP1 ДНК путем следующей интеграции с использованием правила трапеции: где r m — положение первого минимума g (r), а ρ o — объемная плотность воды или плотности воды в соответствующих системах.
Координационное число молекул воды и краудера в первой сольватной оболочке OP1 ДНК приведено в таблице 3. Можно видеть, что с увеличением концентрации краудинга координационное число O воды в первой сольватной оболочке вокруг OP1 ДНК непрерывно уменьшается. Но сумма координационных чисел О воды и О краудера почти остается постоянной. Это показывает, что потеря координационного числа O воды вокруг OP1 ДНК в основном компенсируется атомами кислорода, присутствующими в молекулах краудера.Это означает, что молекулы-краудеры располагаются таким образом, что взаимодействие, потерянное при изменении распределения воды, в основном компенсируется.
2.2 Распределение ионов вокруг ДНК и растворителя.
В этой работе к ДНК, растворителю и ионам относились одинаково. Следовательно, становится важным аспектом понять поведение ионов вокруг молекул ДНК и растворителя (воды и EG) с увеличением концентрации краудера. Сначала мы попытались понять поведение ионов вокруг ДНК как эффект увеличения концентрации скопления.Для этого были выполнены два типа анализа: анализ плотности ионов и расчет PCF (g (r)).
Анализ плотности ионов был выполнен с использованием формализма криволинейных геликоидальных координат (CHC) с использованием программ CURVES + и CANION [54,62,63]. Положение каждого иона определялось по каждой траектории моделирования относительно спиральной оси ДНК. Криволинейное геликоидальное пространство определялось размером ячейки 0,5 Å по R, ⅙ по D (шаг пары оснований) и 5 градусов по A.
Мы проанализировали распределение Na + в большой и малой бороздке ДНК, построив график распределения ионов Na + в геликоидальном пространстве с использованием всех трех возможных 2D-параметров (DA, DR и RA) для всех четырех систем. На рис. 6 показана молярность ионов Na + в малой бороздке (диапазон A от 33 ° до 147 °) и большой бороздке (диапазон A от 147 ° до 33 °) ДНК. Как видно из графика DA (рис. 6), ионы Na + имеют столбчатое распределение в малой бороздке ДНК под постоянным углом A ~ 85 °, и плотность ионов увеличивается с увеличением концентрации краудинга. . Плотность Na + также увеличивается в некоторых участках большой бороздки ДНК с увеличением концентрации скопления.Аналогичная картина возникает и на графике DR (рис. 7). Видно, что ионы Na + распределены на постоянном расстоянии R = 5 Å от оси спирали, и их плотность увеличивается с увеличением концентрации краудинга. Кроме того, на рис. 8 показано распределение плотности Na + в 2D (в виде молярности) в большой канавке (верхний полукруг) и малой канавке (нижний полукруг). В соответствии с графиком DA и DR, из графика RA (R и A преобразуются обратно в декартовы координаты для простой цели визуализации) очевидно, что распределение Na + в некоторых областях, как в большой, так и в малой бороздке ДНК увеличивается с увеличением концентрации скопления людей.
На рис. 6 показана молярность ионов Na + в малой бороздке (диапазон A от 33 ° до 147 °) и большой бороздке (диапазон A от 147 ° до 33 °) ДНК. Как видно из графика DA (рис. 6), ионы Na + имеют столбчатое распределение в малой бороздке ДНК под постоянным углом A ~ 85 °, и плотность ионов увеличивается с увеличением концентрации краудинга. . Плотность Na + также увеличивается в некоторых участках большой бороздки ДНК с увеличением концентрации скопления.Аналогичная картина возникает и на графике DR (рис. 7). Видно, что ионы Na + распределены на постоянном расстоянии R = 5 Å от оси спирали, и их плотность увеличивается с увеличением концентрации краудинга. Кроме того, на рис. 8 показано распределение плотности Na + в 2D (в виде молярности) в большой канавке (верхний полукруг) и малой канавке (нижний полукруг). В соответствии с графиком DA и DR, из графика RA (R и A преобразуются обратно в декартовы координаты для простой цели визуализации) очевидно, что распределение Na + в некоторых областях, как в большой, так и в малой бороздке ДНК увеличивается с увеличением концентрации скопления людей. Из всех этих рисунков можно сделать вывод, что с увеличением концентрации краудинга плотность иона Na + увеличивается в большой и малой бороздке ДНК. При изучении распределения иона Cl — было видно, что плотность Cl — уменьшается с увеличением концентрации скопления (рис. S в файле S1).
Из всех этих рисунков можно сделать вывод, что с увеличением концентрации краудинга плотность иона Na + увеличивается в большой и малой бороздке ДНК. При изучении распределения иона Cl — было видно, что плотность Cl — уменьшается с увеличением концентрации скопления (рис. S в файле S1).
Рис. 6. Среднее распределение Na + , рассчитанное с использованием CHC в плоскости DA (A в градусах, D — шаг пары оснований).
(a) скученность 0% (b) скученность 10% (c) скученность 20% (d) скученность 30%. Цветовая шкала от синего до красного представляет возрастающую молярность.
https://doi.org/10.1371/journal.pone.0206359.g006
Рис. 7. Среднее распределение Na + , рассчитанное с использованием CHC в плоскости DR (R в Å, а D — шаг пары оснований).
(a) скученность 0% (b) скученность 10% (c) скученность 20% (d) скученность 30%. Цветовая шкала от синего до красного представляет возрастающую молярность.
https: // doi.org / 10.1371 / journal.pone.0206359.g007
Рис. 8. Среднее распределение Na + , рассчитанное с использованием CHC после преобразования R и A в декартовы координаты (X и Y указаны в Å).
(a) скученность 0% (b) скученность 10% (c) скученность 20% (d) скученность 30%. Цветовая шкала от синего до красного представляет возрастающую молярность. Верхний полукруг представляет собой большую бороздку, а нижний — малую бороздку ДНК. Вертикальный радиальный вектор указывает центр большой канавки.
https://doi.org/10.1371/journal.pone.0206359.g008
Далее мы вычислили g (r) атомов Na + и Cl — вокруг атома OP1 ДНК. В соответствии с анализом плотности ионов при исследовании g (r) ионов Na + и Cl — вокруг атома OP1 ДНК (рисунки T (a) и T (b) в файле S1) мы обнаружили, что локальная плотность Na + увеличивается, а Cl — уменьшается (как по отношению к плотности этих ионов в объеме) при увеличении концентрации краудинга.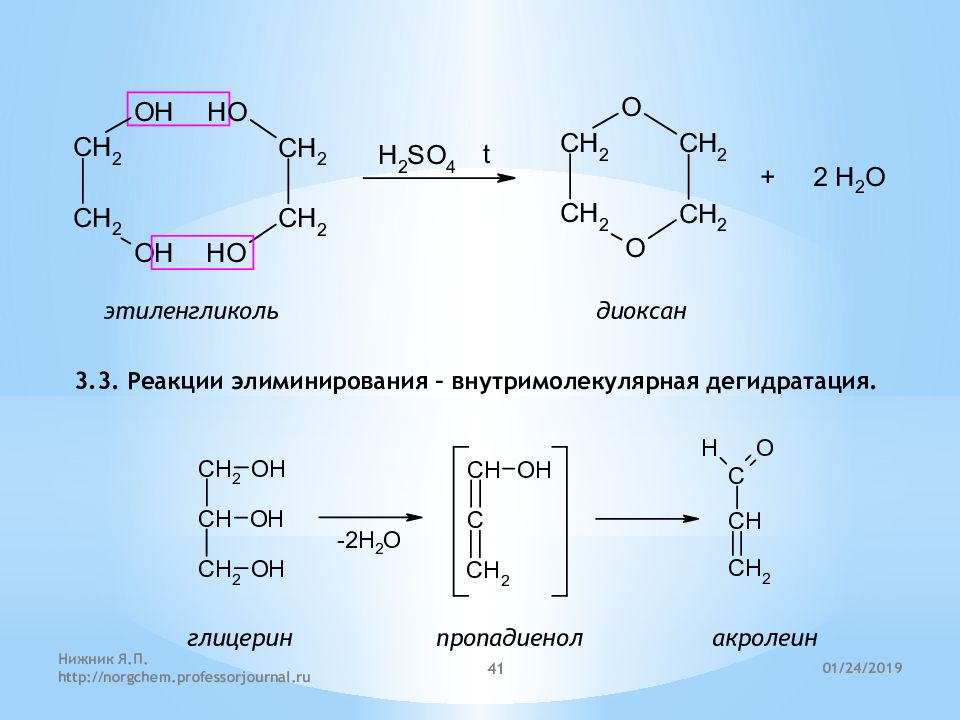 Оба анализа показывают, что добавление ЭГ в значительной степени повлияло на электростатику системы. В результате ДНК может вмещать больше ионов Na + в непосредственной близости от нее. Однако ДНК отталкивает ионы Cl — больше с увеличением концентрации ЭГ. Затем мы исследовали распределение Na + и Cl — вокруг молекул воды. Как видно из рисунков U (a) и U (b) в файле S1, плотность Na + увеличивается на небольшую долю; однако плотность Cl — значительно увеличивается с увеличением концентрации ЭГ.Аналогичное поведение распределения ионов (Na + и Cl — ) наблюдалось вокруг EG (Рисунки V (a) и V (b) в файле S1), за исключением того, что плотность Cl — вокруг воды более сопоставима. к ЭГ, при всех концентрациях ЭГ.
Оба анализа показывают, что добавление ЭГ в значительной степени повлияло на электростатику системы. В результате ДНК может вмещать больше ионов Na + в непосредственной близости от нее. Однако ДНК отталкивает ионы Cl — больше с увеличением концентрации ЭГ. Затем мы исследовали распределение Na + и Cl — вокруг молекул воды. Как видно из рисунков U (a) и U (b) в файле S1, плотность Na + увеличивается на небольшую долю; однако плотность Cl — значительно увеличивается с увеличением концентрации ЭГ.Аналогичное поведение распределения ионов (Na + и Cl — ) наблюдалось вокруг EG (Рисунки V (a) и V (b) в файле S1), за исключением того, что плотность Cl — вокруг воды более сопоставима. к ЭГ, при всех концентрациях ЭГ.
Сложную электростатику, состоящую из пяти компонентов, нетривиально объяснить количественно. Однако одна модель могла быть следующей. Добавление EG увеличивает плотность отрицательного заряда вокруг ДНК, что является причиной того, что больше Na + накапливается рядом с ДНК с увеличением концентрации EG.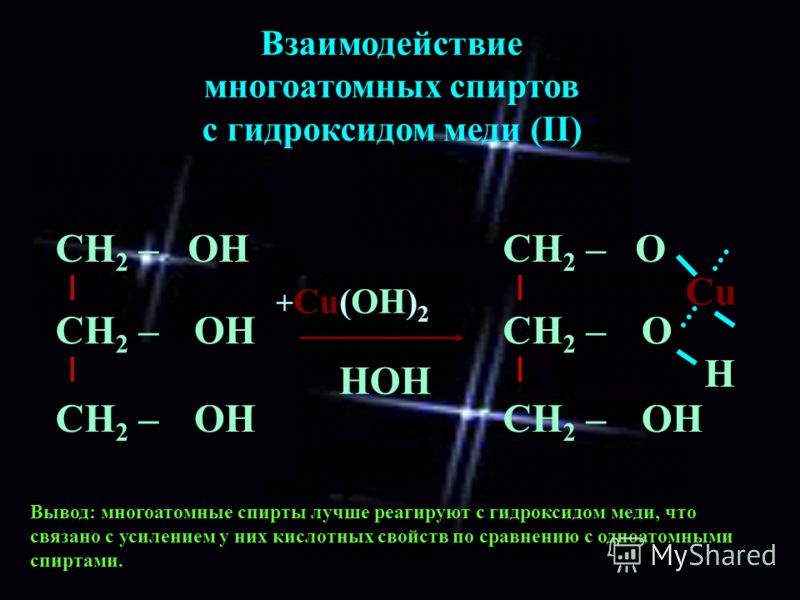 Большее количество Na + около воды и EG (поскольку ДНК покрыта водой и EG) делает электрическое поле вокруг воды и EG более положительным, что привлекает больше Cl —. Эта модель поддерживается ПКФ Na + -Cl — (Рисунок V (c) в файле S1), который показывает увеличение плотности Cl — вокруг Na + по мере увеличения концентрации ЭГ. Как и ожидалось, добавление EG не только приводит к исключению объема, но также изменяет электростатику системы.Таким образом, это нельзя просто объяснить только пониженной диэлектрической проницаемостью.
Большее количество Na + около воды и EG (поскольку ДНК покрыта водой и EG) делает электрическое поле вокруг воды и EG более положительным, что привлекает больше Cl —. Эта модель поддерживается ПКФ Na + -Cl — (Рисунок V (c) в файле S1), который показывает увеличение плотности Cl — вокруг Na + по мере увеличения концентрации ЭГ. Как и ожидалось, добавление EG не только приводит к исключению объема, но также изменяет электростатику системы.Таким образом, это нельзя просто объяснить только пониженной диэлектрической проницаемостью.
2.3 Водородная связь между ДНК-водой и ДНК-краудером.
Известно, что водородные связи между водой и ДНК являются одной из важных причин стабильности ДНК. Таким образом, мы исследовали изменение водородных связей между водой-ДНК и EG-ДНК в зависимости от концентрации EG. Все водородные связи между ДНК-вода и ДНК-EG были рассчитаны с отсечкой расстояния донор-акцептор (расстояние D-A), равное 3. 5 Å и при угле водородной связи (угол D-H-A) отсечение 135 °, соответственно. Из рис.9 видно, что количество водородных связей между ДНК и водой уменьшается с увеличением концентрации краудера (среднее количество водородных связей составляет 553, 425, 352 и 303, что соответствует 0%, 10%, Концентрации 20% и 30%). С другой стороны, было обнаружено, что среднее количество водородных связей между ДНК и краудером составляет 0, 93, 154 и 194, что соответствует 0%, 10%, 20% и 30% концентрации краудинга соответственно.Исходя из этих данных, мы можем сказать: (i) количество водородных связей между ДНК и водой уменьшается, но увеличивается для ДНК и краудсеров по мере увеличения концентрации краудинга, и (ii) общее количество водородных связей с участием ДНК остается практически таким же, i . и ., Водородные связи, вовлекающие как воду, так и краудер с ДНК. Однако очевидно, что водородные связи, исходящие от краудеров, не пропорциональны увеличению их концентрации (с 10% до 20% увеличение количества водородных связей составляет около 40%, а при переходе с 20% до 30% это примерно 20%), что означает, что вытеснение воды из ДНК изначально легко, но становится трудным по мере увеличения концентрации краудера.
5 Å и при угле водородной связи (угол D-H-A) отсечение 135 °, соответственно. Из рис.9 видно, что количество водородных связей между ДНК и водой уменьшается с увеличением концентрации краудера (среднее количество водородных связей составляет 553, 425, 352 и 303, что соответствует 0%, 10%, Концентрации 20% и 30%). С другой стороны, было обнаружено, что среднее количество водородных связей между ДНК и краудером составляет 0, 93, 154 и 194, что соответствует 0%, 10%, 20% и 30% концентрации краудинга соответственно.Исходя из этих данных, мы можем сказать: (i) количество водородных связей между ДНК и водой уменьшается, но увеличивается для ДНК и краудсеров по мере увеличения концентрации краудинга, и (ii) общее количество водородных связей с участием ДНК остается практически таким же, i . и ., Водородные связи, вовлекающие как воду, так и краудер с ДНК. Однако очевидно, что водородные связи, исходящие от краудеров, не пропорциональны увеличению их концентрации (с 10% до 20% увеличение количества водородных связей составляет около 40%, а при переходе с 20% до 30% это примерно 20%), что означает, что вытеснение воды из ДНК изначально легко, но становится трудным по мере увеличения концентрации краудера. Это было дополнительно проверено путем расчета общего количества молекул воды и краудера в первой сольватной оболочке, как показано на рис. 10.
Это было дополнительно проверено путем расчета общего количества молекул воды и краудера в первой сольватной оболочке, как показано на рис. 10.
Рис. 9. Среднее количество водородных связей между ДНК-ЭГ и ДНК-вода.
Красная линия соответствует количеству водородных связей между ДНК-вода, а зеленая линия соответствует количеству водородных связей между молекулами ДНК-EG. Концентрации скопления даны в процентах.
https://doi.org/10.1371/journal.pone.0206359.g009
Рис. 10. Среднее количество молекулярных частиц, присутствующих в первой сольватной оболочке ДНК (в пределах 3,5 Å от поверхности ДНК).
Зеленые, красные и черные линии соответствуют количеству EG, количеству воды и количеству EG + вода, присутствующих в первой сольватной оболочке ДНК. Концентрации скопления даны в процентах.
https://doi.org/10.1371/journal.pone.0206359.g010
Рис. 10 и таблица 4 показывают, что с увеличением концентрации молекул краудера непрерывное уменьшение среднего количества молекул воды и непрерывное увеличение среднее количество молекул краудера наблюдалось в первой сольватной оболочке ДНК (которая принята за 3. 5 Å от поверхности ДНК). По мере увеличения краудинга в системе от 0 до 10%, уменьшение количества молекул воды составило 169, в то время как увеличение количества молекул краудера составило 80. Количество молекул воды уменьшилось до 109, когда скопление увеличилось с 10% до 20. %, что меньше, чем уменьшение количества молекул воды при скоплении увеличилось с 0% до 10%. При дальнейшем увеличении концентрации краудинга с 20% до 30% уменьшение количества молекул воды (которое составляет 74) оказалось еще меньшим по сравнению с уменьшением количества молекул воды, которое уменьшилось, когда краудинг увеличился с 10. % до 20%.Из рис. 10 также ясно, что общее количество видов (вода + краудер) в первой сольватной оболочке уменьшается с увеличением концентрации краудера. Это означает, что одна молекула краудера вытесняет более одной молекулы воды в первой сольватной оболочке ДНК. Как видно из таблицы 4, одиночная молекула EG вытесняет примерно две молекулы воды из первой сольватной оболочки ДНК.
5 Å от поверхности ДНК). По мере увеличения краудинга в системе от 0 до 10%, уменьшение количества молекул воды составило 169, в то время как увеличение количества молекул краудера составило 80. Количество молекул воды уменьшилось до 109, когда скопление увеличилось с 10% до 20. %, что меньше, чем уменьшение количества молекул воды при скоплении увеличилось с 0% до 10%. При дальнейшем увеличении концентрации краудинга с 20% до 30% уменьшение количества молекул воды (которое составляет 74) оказалось еще меньшим по сравнению с уменьшением количества молекул воды, которое уменьшилось, когда краудинг увеличился с 10. % до 20%.Из рис. 10 также ясно, что общее количество видов (вода + краудер) в первой сольватной оболочке уменьшается с увеличением концентрации краудера. Это означает, что одна молекула краудера вытесняет более одной молекулы воды в первой сольватной оболочке ДНК. Как видно из таблицы 4, одиночная молекула EG вытесняет примерно две молекулы воды из первой сольватной оболочки ДНК.
2.4 Динамика воды в первой сольватной оболочке ДНК.
Молекулы воды динамичны по своей природе, и динамика молекул воды в непосредственной близости от биомолекул может играть решающую роль в функционировании и стабильности биомолекул [28,64,65].В предыдущем разделе мы количественно оценили количество молекул воды, присутствующих в первой гидратной оболочке ДНК для соответствующих четырех концентраций EG, и наблюдали, что количество молекул воды в первой гидратной оболочке ДНК уменьшается с увеличением концентрации краудинга. Кроме того, мы также показали, что количество водородных связей, образованных между ДНК и водой, уменьшается с увеличением концентрации краудинга. Оба этих расчета дают более или менее общую картину структуры растворителя вокруг ДНК.Однако маршруты динамической релаксации молекул воды не были обнаружены. Одна из величин, отражающих динамику молекул воды, заключается в вычислении среднего времени пребывания (MRT), которое в среднем оценивает, как долго молекула воды остается вокруг биомолекулы. Сообщалось, что поведение молекул воды и структуры воды вокруг белков вполне закономерно. Однако существует неоднородность в поведении молекул воды вокруг ДНК [66]. Различные группы и исследования сообщили о разном времени пребывания молекул воды в канавках ДНК, которое варьируется от 200 пс до 1 нс [67,68].В случае ДНК, которая представляет собой сильно заряженную систему, несколько факторов определяют поведение молекул воды, такие как топография (ширина и глубина бороздок), последовательное расположение оснований и, что наиболее важно, химический состав азотистых оснований, молекул воды и окружающей среды. окружающая обстановка. В нашем случае мы заинтересованы в регистрации изменения времени пребывания молекул воды как эффекта увеличения концентрации краудинга в системе. MRT рассчитывали, взяв среднее значение времени пребывания каждой молекулы воды в первой гидратной оболочке (3.5 Å от поверхности ДНК). Для расчета времени пребывания каждая молекула воды в первой гидратной оболочке отслеживалась на предмет их присутствия и отсутствия в последующих снимках (для этого расчета снимки сохранялись с промежутком каждые 0,1 пикосекунды от 5 нс участка траектории МД).
Сообщалось, что поведение молекул воды и структуры воды вокруг белков вполне закономерно. Однако существует неоднородность в поведении молекул воды вокруг ДНК [66]. Различные группы и исследования сообщили о разном времени пребывания молекул воды в канавках ДНК, которое варьируется от 200 пс до 1 нс [67,68].В случае ДНК, которая представляет собой сильно заряженную систему, несколько факторов определяют поведение молекул воды, такие как топография (ширина и глубина бороздок), последовательное расположение оснований и, что наиболее важно, химический состав азотистых оснований, молекул воды и окружающей среды. окружающая обстановка. В нашем случае мы заинтересованы в регистрации изменения времени пребывания молекул воды как эффекта увеличения концентрации краудинга в системе. MRT рассчитывали, взяв среднее значение времени пребывания каждой молекулы воды в первой гидратной оболочке (3.5 Å от поверхности ДНК). Для расчета времени пребывания каждая молекула воды в первой гидратной оболочке отслеживалась на предмет их присутствия и отсутствия в последующих снимках (для этого расчета снимки сохранялись с промежутком каждые 0,1 пикосекунды от 5 нс участка траектории МД). . На рис. 11 показано время пребывания (в пикосекундах) всех молекул воды, присутствующих в первой гидратной оболочке ДНК. Из рисунка хорошо видно, что время пребывания молекул воды в первой гидратной оболочке ДНК увеличивается с увеличением концентрации краудинга.Для 0% краудинга MRT молекулы воды оказалось равным 140,94 пс. Из графика MRT (рисунок W в файле S1) можно видеть, что MRT увеличивается со 140,94 пс (скученность 0%) до 330,10 пс (скученность 30%) с увеличением концентрации EG. Взятые вместе, мы обнаружили, что время пребывания около 10,27% молекул воды при 0% скученности, 12,84% для 10% скученности, 25,44% для 20% скученности и 36,30% для 30% скученности больше, чем MRT для 30% скученности. система (330,10 пс). Это говорит о том, что молекулы воды в первой гидратной оболочке находятся рядом с ДНК в течение более длительных периодов времени, –. и ., Молекулы воды становятся прочно связанными с ДНК с увеличением скученности в системе. В целом можно сделать вывод, что с увеличением концентрации краудинга слабосвязанные молекулы воды легко вытесняются молекулами EG в первой гидратной оболочке ДНК; однако прочно связанные молекулы воды находятся в непосредственной близости от ДНК, что приводит к более длительному времени пребывания.
. На рис. 11 показано время пребывания (в пикосекундах) всех молекул воды, присутствующих в первой гидратной оболочке ДНК. Из рисунка хорошо видно, что время пребывания молекул воды в первой гидратной оболочке ДНК увеличивается с увеличением концентрации краудинга.Для 0% краудинга MRT молекулы воды оказалось равным 140,94 пс. Из графика MRT (рисунок W в файле S1) можно видеть, что MRT увеличивается со 140,94 пс (скученность 0%) до 330,10 пс (скученность 30%) с увеличением концентрации EG. Взятые вместе, мы обнаружили, что время пребывания около 10,27% молекул воды при 0% скученности, 12,84% для 10% скученности, 25,44% для 20% скученности и 36,30% для 30% скученности больше, чем MRT для 30% скученности. система (330,10 пс). Это говорит о том, что молекулы воды в первой гидратной оболочке находятся рядом с ДНК в течение более длительных периодов времени, –. и ., Молекулы воды становятся прочно связанными с ДНК с увеличением скученности в системе. В целом можно сделать вывод, что с увеличением концентрации краудинга слабосвязанные молекулы воды легко вытесняются молекулами EG в первой гидратной оболочке ДНК; однако прочно связанные молекулы воды находятся в непосредственной близости от ДНК, что приводит к более длительному времени пребывания.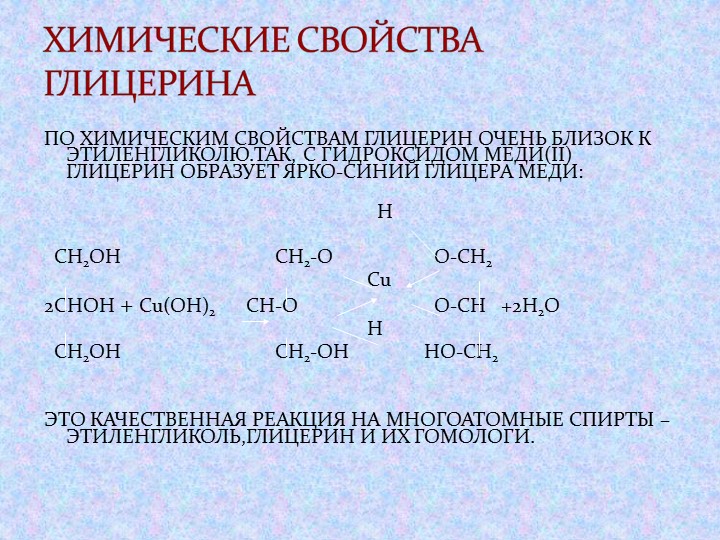
Чтобы получить представление о движении воды в объеме, рассчитывается коэффициент диффузии воды для всех четырех систем (рис. X в файле S1).Результаты ясно показывают уменьшение коэффициента диффузии с увеличением концентрации ЭГ, что подразумевает медленное движение молекул воды в присутствии ЭГ.
2.5 Сольватационная оболочка вокруг пар оснований AT и GC.
Мы рассчитали локальную плотность молекул воды вокруг пар оснований AT и GC (среднее значение по траекториям MD), чтобы понять структуру сольватации вокруг них. Локальная плотность молекул воды вокруг пар оснований показана на рисунках 12 и 13.На обоих рисунках показаны изоповерхностные плотности воды 3,8 (серый цвет), 5,5 (зеленый цвет) и 7 (красный цвет) или более. Как видно из рисунков, локальная плотность молекул воды уменьшается с увеличением концентрации скопления вокруг атомов основной цепи (OP1, OP2, P) ДНК, что согласуется с g (r) воды вокруг ДНК. Плотность воды вокруг малой бороздки и больших бороздок ДНК не сильно зависит от увеличения концентрации скопления. Это говорит о том, что более крупные молекулы способны перемещать молекулы воды вокруг основной цепи ДНК, но замена воды из большой и малой бороздок ДНК сравнительно трудна.
Это говорит о том, что более крупные молекулы способны перемещать молекулы воды вокруг основной цепи ДНК, но замена воды из большой и малой бороздок ДНК сравнительно трудна.
Рис. 12. Плотность воды вокруг пары оснований AT при концентрации скопления 0%, 10%, 20% и 30%.
Показаны изоповерхностные плотности (локальная числовая плотность) воды более 3,8 (серая сетка), 5,5 (зеленая сетка) и 7,0 (сплошное красное вещество). Здесь показана средняя структура пары оснований AT.
https://doi.org/10.1371/journal.pone.0206359.g012
Рис. 13. Плотность воды вокруг пары оснований GC при концентрации краудинга 0%, 10%, 20% и 30%.
Изоповерхностная плотность (местная числовая плотность) воды больше 3.Показаны 8 (серая сетка), 5.5 (зеленая сетка) и 7.0 (красный сплошной цвет). Здесь показана средняя структура пары оснований GC.
https://doi.org/10.1371/journal.pone.0206359.g013
2.6 Влияние скученности на водяной корешок малой канавки.

Одним из важнейших факторов сольватации ДНК является водная борозда отростка. В ранее опубликованных работах было показано, что молекулы воды прочно связываются с атомами малых бороздок (N3, O2) и основной фосфатной группой ДНК и, следовательно, имеют более длительное время пребывания вокруг этих атомов [69,70].Это сильное взаимодействие молекул воды с O2 пиримидина и N3 пурина в малой бороздке ДНК помогает в формировании малой бороздки водяного шипа. В новом исследовании [71] с помощью нелинейной колебательной спектроскопии ДНК было показано, что молекулы воды в малой бороздке ДНК образуют хиральную надстройку и, следовательно, образуют хиральный шип сольватации в малой бороздке. Биологическое значение хирального хребта воды до сих пор не известно, но оно указывает на то, что воды в малой бороздке сильно отличаются от других молекул воды, присутствующих в системе.
Структура позвоночника с малой бороздкой ДНК была тщательно изучена, но то, как скученность влияет на этот позвоночник с малой бороздкой, еще предстоит изучить. Чтобы количественно определить водный стержень малой бороздки ДНК, мы рассчитали количество молекул воды в пределах 3,5 Å от атомов N3, N2, h31, h32, O2 (определения атомов можно увидеть на рис. 1 (b) и 1 (c)). A, T, G и C с возрастающей концентрацией краудинга, как показано в Таблице 5. Поскольку молекула EG (краудер) имеет две группы -ОН, будет происходить постоянная конкуренция между водой и краудером за образование водородных связей с ДНК с малой бороздкой. атомы пар оснований AT и GC.Мы обнаружили, что среднее количество молекул воды в водяной корешке малой бороздки уменьшается по мере увеличения концентрации скопления. И среднее количество молекул краудера, вторгающихся в водяной корешок малой бороздки, увеличивается с увеличением концентрации скопления. Как видно из таблицы 4, одна молекула EG заменяет почти две молекулы воды из сольватационной оболочки ДНК в тесноте, но в случае водного шипа с малой бороздкой почти 1,5–1,6 (таблица 5) молекулы воды заменяются на молекулы воды. единственная молекула краудера.
Чтобы количественно определить водный стержень малой бороздки ДНК, мы рассчитали количество молекул воды в пределах 3,5 Å от атомов N3, N2, h31, h32, O2 (определения атомов можно увидеть на рис. 1 (b) и 1 (c)). A, T, G и C с возрастающей концентрацией краудинга, как показано в Таблице 5. Поскольку молекула EG (краудер) имеет две группы -ОН, будет происходить постоянная конкуренция между водой и краудером за образование водородных связей с ДНК с малой бороздкой. атомы пар оснований AT и GC.Мы обнаружили, что среднее количество молекул воды в водяной корешке малой бороздки уменьшается по мере увеличения концентрации скопления. И среднее количество молекул краудера, вторгающихся в водяной корешок малой бороздки, увеличивается с увеличением концентрации скопления. Как видно из таблицы 4, одна молекула EG заменяет почти две молекулы воды из сольватационной оболочки ДНК в тесноте, но в случае водного шипа с малой бороздкой почти 1,5–1,6 (таблица 5) молекулы воды заменяются на молекулы воды. единственная молекула краудера. Возможно, это происходит из-за узкой и глубокой структуры малой бороздки В-ДНК, которая делает относительно трудным вытеснение прочно связанных молекул воды из малой бороздки ДНК для более тесных молекул.
Возможно, это происходит из-за узкой и глубокой структуры малой бороздки В-ДНК, которая делает относительно трудным вытеснение прочно связанных молекул воды из малой бороздки ДНК для более тесных молекул.
Далее мы рассчитали время жизни водородной связи каждой водородной связи между атомами малой бороздки и молекулами воды. На рис. 14 показано максимальное время жизни водородной связи, образованной водой с атомами малой бороздки ДНК. Из рисунка видно, что за исключением двух областей максимальное время жизни водородных связей выше в переполненных системах по сравнению с системой при 0% краудфандинге.Среднее максимальное время жизни (в пикосекундах) составило 19,20 ± 6,32, 24,80 ± 10,34, 23,56 ± 13,43 и 25,50 ± 11,48 для концентраций скопления 0%, 10%, 20% и 30% соответственно. Также следует отметить, что увеличение времени жизни водородной связи не является монотонным с увеличением концентрации краудинга.
3. Свойства растворителя-растворителя
3.1 Функции радиального распределения и координационное число вода-вода, вода-ЭГ и ЭГ-ЭГ.

В этом разделе мы попытались понять, как изменяется структура растворителя по мере увеличения скученности в системе.Для этого были рассчитаны ПКФ вода-вода, краудер-вода и краудер-краудер при различных концентрациях краудинга (рис. 15). Координационные числа первой сольватационной оболочки воды вокруг воды, воды вокруг толпы и толпы вокруг толпы также были рассчитаны из соответствующих ПКФ в различных концентрациях скученности, что показано в таблице 6. Мы видим, что высоты первых пиков всех ПКФ увеличиваются по мере увеличения скученности. в системе. Однако, как видно из Таблицы 6, координационное число воды вокруг воды и воды вокруг скопления уменьшается с увеличением концентрации скопления.Координационное число толпы вокруг толпы увеличивается с увеличением концентрации толпы. Это согласуется с выводами, представленными в предыдущих разделах.
3.2 Водородные связи между водой-водой, водой-EG и EG-EG при различных концентрациях скопления во всей системе.
Кислород воды имеет естественную тенденцию к образованию водородной связи с водородом, присоединенным к электроотрицательному атому, а водород воды имеет такую же тенденцию к образованию водородной связи с другими электроотрицательными атомами. С другой стороны, этиленгликоль также имеет две группы -ОН, которые могут образовывать водородные связи с водой и ДНК. И вода, и этиленгликоль могут быть донором или акцептором водородной связи при образовании водородной связи. Могут быть четыре типа связей с участием воды и EG: вода-вода (WW), вода (донор) -EG (акцептор) (WE), EG (донор)-вода (акцептор) (EW) и EG-EG. (EE).
С другой стороны, этиленгликоль также имеет две группы -ОН, которые могут образовывать водородные связи с водой и ДНК. И вода, и этиленгликоль могут быть донором или акцептором водородной связи при образовании водородной связи. Могут быть четыре типа связей с участием воды и EG: вода-вода (WW), вода (донор) -EG (акцептор) (WE), EG (донор)-вода (акцептор) (EW) и EG-EG. (EE).
При исследовании H-связей WW (рис. 16) мы видим, что количество H-связей на воду в локальной области (в пределах 7 Å от поверхности ДНК) меньше, чем в объеме для всех концентраций краудера.Даже когда нет толпы, это правда. Отчасти это связано с тем, что первый слой воды образует водородную связь с ДНК и, следовательно, образует меньшие водородные связи с другими водами. Для H-связей EE при концентрации краудинга 10% количество H-связей на EG практически одинаково вблизи ДНК и в основной массе. Однако при более высоких концентрациях краудера EG в массе образует больше H-связей с другими EG. Тенденция монотонно возрастает с увеличением концентрации толпы. Это говорит о том, что существует оптимальное количество EG, которые можно разместить рядом с ДНК, заменив воду.Судя по количеству водородных связей на EG, между двумя EG находятся молекулы воды. Они также отражаются в ПКФ EG-EG (рис. 15 (c)), поскольку высота первого пика меньше, чем ПКФ вода-вода и вода-EG. Однако замена вод становится более трудной с увеличением концентрации скопления людей, как обсуждалось ранее.
Это говорит о том, что существует оптимальное количество EG, которые можно разместить рядом с ДНК, заменив воду.Судя по количеству водородных связей на EG, между двумя EG находятся молекулы воды. Они также отражаются в ПКФ EG-EG (рис. 15 (c)), поскольку высота первого пика меньше, чем ПКФ вода-вода и вода-EG. Однако замена вод становится более трудной с увеличением концентрации скопления людей, как обсуждалось ранее.
Рис. 16. Среднее количество водородных связей на вид в непосредственной близости от ДНК (в пределах 7 Å от поверхности ДНК) и во всей системе.
WW norm , WE norm , EW norm и EE norm представляют собой нормализованное количество водородных связей между водой-водой, водой-EG, EG-водой и EG-EG, соответственно. В легендах надстрочный индекс {norm, W, local} обозначает нормализацию по общему количеству молекул воды в локальной области (в пределах 7 Å от поверхности ДНК), {norm, EG, local} обозначает нормализацию по общему количеству молекул EG. в локальной области {норма, W, целое} представляет собой нормализацию по общему количеству молекул воды в полной системе, а {норма, ЭГ, целое} представляет собой нормализацию по общему количеству ЭГ в полной системе.
в локальной области {норма, W, целое} представляет собой нормализацию по общему количеству молекул воды в полной системе, а {норма, ЭГ, целое} представляет собой нормализацию по общему количеству ЭГ в полной системе.
https://doi.org/10.1371/journal.pone.0206359.g016
Для водородных связей WE и EW количество связей на воду практически одинаково для местного региона и большого объема. Однако количество H-связей на EG намного меньше в локальном регионе. Скорее всего, это связано с тем, что количество водородных связей с участием одного ЭГ больше в объеме. Увеличение количества связей происходит из-за увеличения количества молекул воды вокруг EG в объеме.
Общее количество водородных связей для WW, WE, EW, EE как для объема, так и для 7 Å от ДНК приведено в таблицах B и C в файле S1.Расчет водородных связей для полной системы качественно согласуется с ранее опубликованными работами [72–74].
4. Локальная термодинамика переполненной системы
ПКФ, рассчитанные для разных видов в последних разделах, дают представление об их среднем взаимодействии. — kTlng ( r ) ( k и T — постоянная Больцмана и абсолютная температура, соответственно) дает потенциал средней силы (PMF) на выбранной переменной (в нашем случае это было расстояние между разными парами видов), усредненные по всем остальным степеням свободы системы.В текущем разделе мы рассмотрели локальные свойства воды вблизи ДНК. Это дает еще один способ увидеть сложные взаимодействия, происходящие в нашей системе.
— kTlng ( r ) ( k и T — постоянная Больцмана и абсолютная температура, соответственно) дает потенциал средней силы (PMF) на выбранной переменной (в нашем случае это было расстояние между разными парами видов), усредненные по всем остальным степеням свободы системы.В текущем разделе мы рассмотрели локальные свойства воды вблизи ДНК. Это дает еще один способ увидеть сложные взаимодействия, происходящие в нашей системе.
4.1. Свободная энергия, приходящаяся на одну молекулу воды в первой сольватной оболочке ДНК.
Мы использовали GIST, реализованный в модуле cpptraj в Amber 14, для изучения термодинамических свойств молекул воды, присутствующих в первой сольватационной оболочке дуплекса ДНК из 23 пар оснований. Размер сетки GIST был принят равным 0,5 Å, а локальная область (R) была определена таким образом, чтобы она покрывала всю ДНК с запасом в 4 Å от поверхности ДНК.Размер коробки для расчета GIST вокруг ДНК составляет 28 Å × 28 Å × 84 Å, что представляет собой первую сольватную оболочку вокруг ДНК. Поскольку GIST не позволяет рассматривать другие молекулы, кроме воды, как часть растворителя, ионы краудера и соли были удалены с траекторий до расчета GIST. Объемная плотность воды ρ 0 (требуется для расчета члена энтропии сольватации) и средняя энергия взаимодействия вода-вода (необходимая для ссылки на энергию взаимодействия вода-вода), которые требуются для расчета GIST, были получены из TIP3P water симуляция коробки при 300 K как 0.0334 молекулы / Å 3 и -9,565 ккал / моль соответственно.
Поскольку GIST не позволяет рассматривать другие молекулы, кроме воды, как часть растворителя, ионы краудера и соли были удалены с траекторий до расчета GIST. Объемная плотность воды ρ 0 (требуется для расчета члена энтропии сольватации) и средняя энергия взаимодействия вода-вода (необходимая для ссылки на энергию взаимодействия вода-вода), которые требуются для расчета GIST, были получены из TIP3P water симуляция коробки при 300 K как 0.0334 молекулы / Å 3 и -9,565 ккал / моль соответственно.
Мы проанализировали трансляционную и ориентационную энтропию воды, потенциал взаимодействия вода-ДНК и потенциал взаимодействия вода-вода, вычисленный с помощью GIST, для их конвергенции как функции времени моделирования (рисунок Y в файле S1). Мы обнаружили, что трансляционная энтропия, энергия взаимодействия растворенного вещества и растворителя ΔE sw и без привязки (потенциал взаимодействия вода-вода не относится к объемной воде) энергия взаимодействия вода-вода E ww сходятся хорошо, но мы не смогли получить сходимость по ориентационной энтропии для длины выполненного моделирования.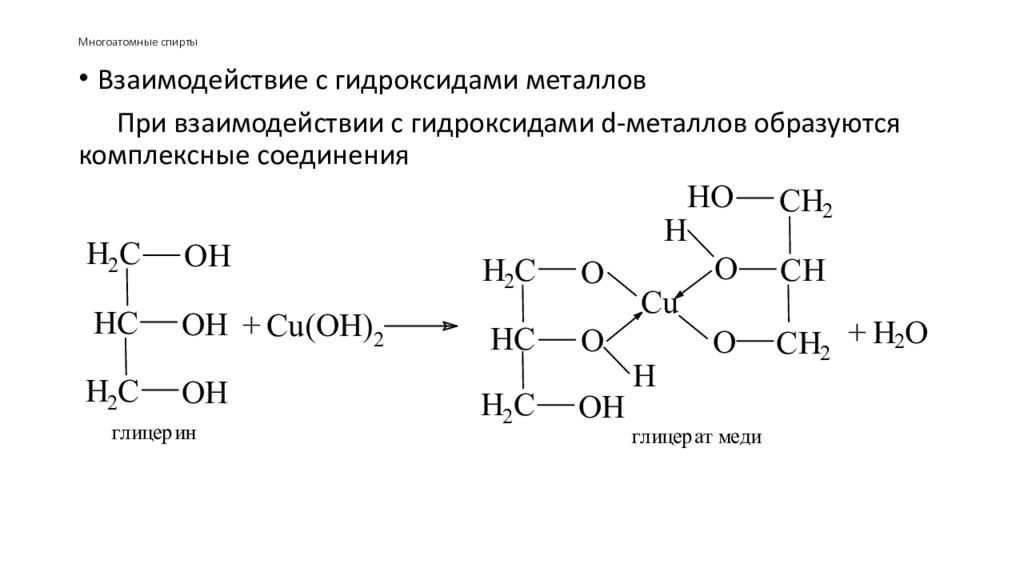 Одной из причин отсутствия сходящейся ориентационной энтропии могло быть то, что многие важные ориентационные степени свободы молекул воды не могли быть исследованы в достаточной степени в течение продолжительности моделирования. Ориентационная энтропия воды не сходилась при расширении моделирования до 150 нс, о чем также сообщили Накано и др. . [28]. Было обнаружено, что значения энтропии на порядок меньше значений энтальпии, как показано в Таблице 7. Следовательно, отсутствие сходимости ориентационной энтропии не повлияет на выводы, сделанные в данном разделе.
Одной из причин отсутствия сходящейся ориентационной энтропии могло быть то, что многие важные ориентационные степени свободы молекул воды не могли быть исследованы в достаточной степени в течение продолжительности моделирования. Ориентационная энтропия воды не сходилась при расширении моделирования до 150 нс, о чем также сообщили Накано и др. . [28]. Было обнаружено, что значения энтропии на порядок меньше значений энтальпии, как показано в Таблице 7. Следовательно, отсутствие сходимости ориентационной энтропии не повлияет на выводы, сделанные в данном разделе.
Поскольку было обнаружено, что ориентационная энтропия на воду не сходится ни в одной из систем, мы не включили ориентационную энтропию для изменения свободной энергии в расчеты воды. Мы все еще можем сказать следующее: как показано на рис. 17 (а), можно сказать, что трансляционная энтропия на молекулу воды увеличивается с увеличением концентрации краудинга. Это говорит о том, что молекулы воды могут исследовать больше трансляционных степеней свободы по мере увеличения скученности в системе, что может быть связано с меньшим количеством молекул воды в первой сольватной оболочке ДНК.
Рис. 17. Термодинамические свойства, рассчитанные по GIST в ккал / моль.
(a) Ссылочная нормализованная трансляционная энтропия (b) ссылочный нормализованный потенциал взаимодействия вода-ДНК с и (c) ссылочный нормализованный потенциал взаимодействия вода-вода по отношению к объемной воде при различной концентрации скопления.
https://doi.org/10.1371/journal.pone.0206359.g017
Потенциал взаимодействия растворенного вещества и растворителя в расчете на воду показан на рис. 17 (b).Было обнаружено, что с увеличением скопления людей концентрация постоянно уменьшается, что согласуется с ранее опубликованными результатами [28]. Это говорит о том, что с увеличением концентрации краудинга слабовзаимодействующие молекулы воды заменяются молекулами краудинга. В результате только сильно связанные молекулы воды могут взаимодействовать с ДНК, что снижает потенциал взаимодействия растворенного вещества и растворителя по мере увеличения концентрации краудинга.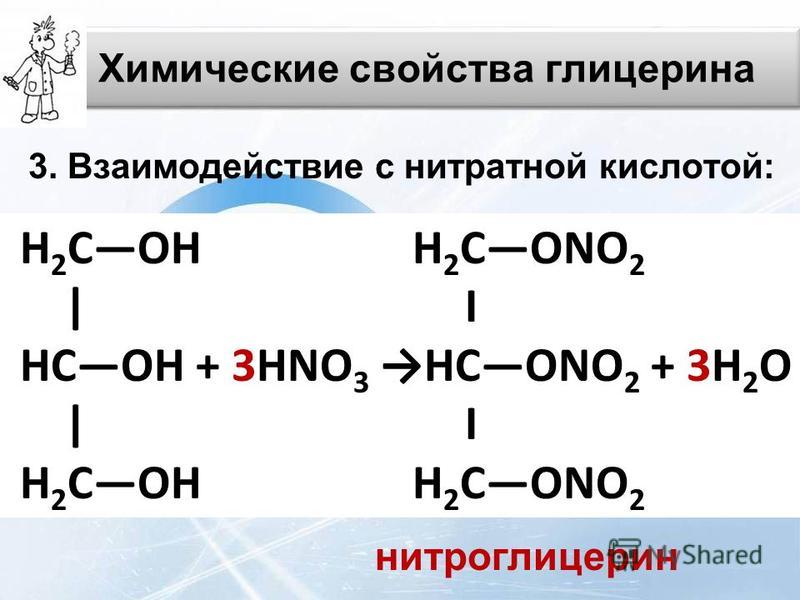 Из Рис. 17 (c) видно, что с увеличением скученности концентрация в расчете на воду увеличивается.Это происходит из-за вторжения молекул краудера в область R, нарушающих взаимодействие воды с водой.
Из Рис. 17 (c) видно, что с увеличением скученности концентрация в расчете на воду увеличивается.Это происходит из-за вторжения молекул краудера в область R, нарушающих взаимодействие воды с водой.
Как показано на рис. 18, свободная энергия, приходящаяся на одну молекулу воды, увеличивается с увеличением концентрации краудинга. Следует отметить, что энтальпийное взаимодействие с краудерами не учитывается. Если мы посмотрим на общее количество водородных связей в локальной области (в пределах 7 Å от поверхности ДНК, таблица C в файле S1), можно сделать вывод, что эти числа увеличиваются для случая водонасыщения.Следовательно, вероятно, что потеря стабильности в расчете на воду может быть, по крайней мере, частично компенсирована благоприятными водородными связями вода-EG.
4.2 Связывание свободной энергии молекулы краудера с ДНК.
Поскольку метод GIST в настоящее время работает только для воды, для расчета приблизительной свободной энергии связи на молекулу краудера мы использовали молекулярную механику — трехмерную модель эталонного места взаимодействия (MM-3DRISM). Следующая формула была использована для расчета приблизительной свободной энергии связывания молекулы краудера с ДНК: где N C — количество молекул краудера, лежащих в пределах 15 Å от поверхности ДНК (это связано с тем, что корреляции ДНК-краудера теряются за пределами расстояния 15 Å, что также видно в g (r ) скопления вокруг ДНК (рис. 5 (b)), угловые скобки представляют среднее значение, полученное по 50 снимкам МД-моделирования и где E представляет потенциальную энергию растворенного вещества, рассчитанную с использованием силового поля MM, представляет собой свободную энергию сольватации комплекса ДНК-EG, представляет свободную энергию сольватации ДНК и представляет собой свободную энергию сольватации краудера, рассчитанную с использованием 3DRISM.
Следующая формула была использована для расчета приблизительной свободной энергии связывания молекулы краудера с ДНК: где N C — количество молекул краудера, лежащих в пределах 15 Å от поверхности ДНК (это связано с тем, что корреляции ДНК-краудера теряются за пределами расстояния 15 Å, что также видно в g (r ) скопления вокруг ДНК (рис. 5 (b)), угловые скобки представляют среднее значение, полученное по 50 снимкам МД-моделирования и где E представляет потенциальную энергию растворенного вещества, рассчитанную с использованием силового поля MM, представляет собой свободную энергию сольватации комплекса ДНК-EG, представляет свободную энергию сольватации ДНК и представляет собой свободную энергию сольватации краудера, рассчитанную с использованием 3DRISM.
Энтропия ДНК и всех краудеров не учитывалась. Как обсуждалось в разделе результатов 1, что на флуктуацию структуры ДНК не сильно влияет концентрация EG, пренебрежение энтропией не может привести к большой ошибке. Однако мы не можем комментировать энтропию ЭГ при различных концентрациях ЭГ. Мы ожидаем, что поскольку члены энтропии имеют гораздо меньшую величину, качественная тенденция вычисленных значений с использованием RISM может быть надежной даже без энтропии EG.
Однако мы не можем комментировать энтропию ЭГ при различных концентрациях ЭГ. Мы ожидаем, что поскольку члены энтропии имеют гораздо меньшую величину, качественная тенденция вычисленных значений с использованием RISM может быть надежной даже без энтропии EG.
Было обнаружено, что свободная энергия связывания на краудер при концентрациях краудинга 10%, 20% и 30% составляет -0.57 ± 0,11, -0,56 ± 0,06 и -0,51 ± 0,06 ккал / моль. Игнорируя незначительное увеличение свободной энергии связывания в расчете на одного краудера, мы можем сказать, что стабильность краудера, в среднем, существенно не меняется с увеличением концентрации краудера.
Обсуждение
Одна из важных целей равновесной статистической механики — знать равновесное распределение различных компонентов в многокомпонентной системе. Это может быть расположение противоионов вокруг макроионов, расположение воды вокруг гидрофильных и гидрофобных растворенных веществ, и т. Д. .Объяснение такого вида наблюдения с помощью микроскопической картины исследовалось в большом количестве работ [75–78].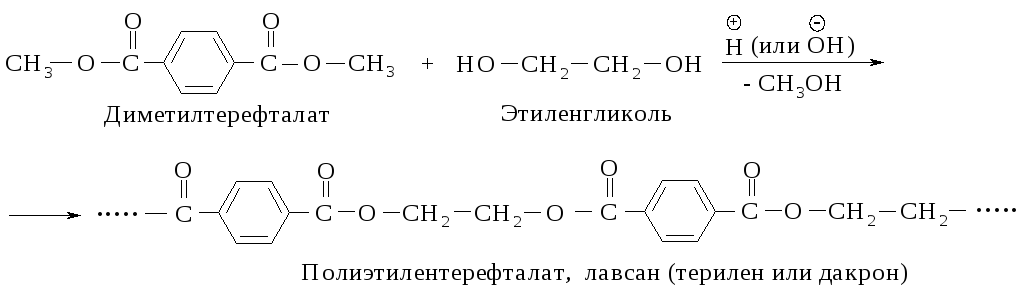 Однако, насколько нам известно, было не так много исследований, в которых изучались бы распределение и термодинамика воды, ионов и скопления вокруг ДНК. Мы хотели понять, как меняется распределение разных видов при изменении концентрации одного вида, а именно более краудшой молекулы этиленгликоля. И каковы основные взаимодействия, вызывающие изменения, мы пытаемся понять.
Однако, насколько нам известно, было не так много исследований, в которых изучались бы распределение и термодинамика воды, ионов и скопления вокруг ДНК. Мы хотели понять, как меняется распределение разных видов при изменении концентрации одного вида, а именно более краудшой молекулы этиленгликоля. И каковы основные взаимодействия, вызывающие изменения, мы пытаемся понять.
Вначале мы дадим некоторую связь наблюдений, полученных в данной работе, с наблюдениями, полученными в предыдущих работах. Влияние сорастворимого вещества на структурную стабильность и динамику ДНК исследовалось в различных предыдущих работах [27,79–84]. Основное различие между этими работами и текущей работой состоит в том, что в настоящей работе исследовались как локальные, так и глобальные эффекты скопления людей. Было обнаружено, что ЭГ проникает в сольватную оболочку ДНК, замещая воду, но это становится более трудным по мере увеличения концентрации ЭГ.Это означает, что некоторые воды прочно связаны с ДНК, и их замена энергетически не приветствуется. Было обнаружено, что координационное число молекул воды уменьшается, в то время как координационное число молекул краудинга вокруг ДНК увеличивается с увеличением концентрации краудинга в системе. Это согласуется с предыдущим МД-моделированием и наблюдениями, полученными из ближней ИК-спектроскопии [72,73] для смеси чистая вода-ЭГ. Кроме того, мы заметили, что потеря координационного числа воды компенсируется увеличением координационного числа краудера, сохраняя почти постоянным общее количество водородных связей, исходящих от воды и молекул краудера вблизи ДНК.Среди различных возможностей водородной связи было обнаружено, что максимальная водородная связь вода-вода, за которой следуют водородные связи вода-EG и, наконец, водородная связь EG-EG для объемного растворителя. Это соответствует ранее полученным данным Weng et al . [73] для смесей вода-ЭГ. Однако мы обнаружили, что количество H-связей EG-EG нельзя пренебречь (ссылка [72] обнаружила, что количество по существу незначительно).
Было обнаружено, что координационное число молекул воды уменьшается, в то время как координационное число молекул краудинга вокруг ДНК увеличивается с увеличением концентрации краудинга в системе. Это согласуется с предыдущим МД-моделированием и наблюдениями, полученными из ближней ИК-спектроскопии [72,73] для смеси чистая вода-ЭГ. Кроме того, мы заметили, что потеря координационного числа воды компенсируется увеличением координационного числа краудера, сохраняя почти постоянным общее количество водородных связей, исходящих от воды и молекул краудера вблизи ДНК.Среди различных возможностей водородной связи было обнаружено, что максимальная водородная связь вода-вода, за которой следуют водородные связи вода-EG и, наконец, водородная связь EG-EG для объемного растворителя. Это соответствует ранее полученным данным Weng et al . [73] для смесей вода-ЭГ. Однако мы обнаружили, что количество H-связей EG-EG нельзя пренебречь (ссылка [72] обнаружила, что количество по существу незначительно).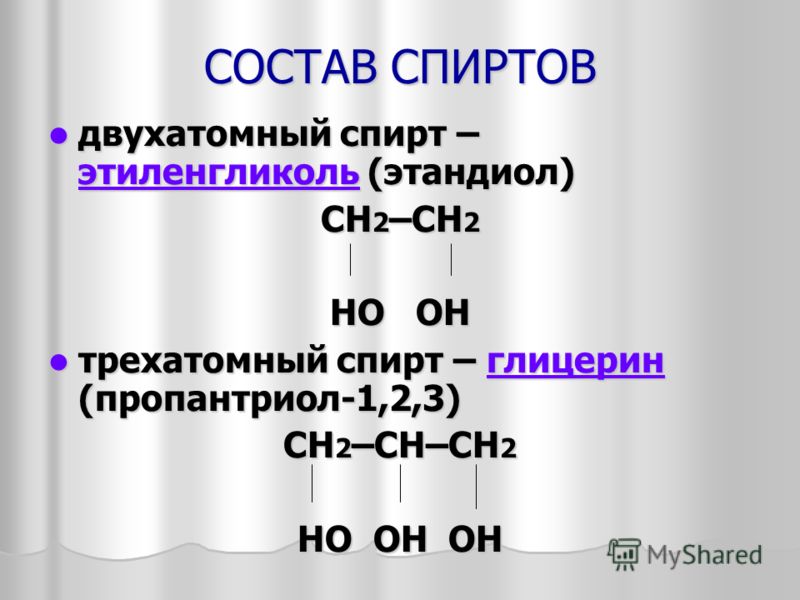 Это может быть связано с изменением электростатики (из-за наличия ДНК) системы.Среднее время пребывания воды в первой сольватной оболочке ДНК и время жизни водородной связи в малой бороздке ДНК дали представление о сложной динамике воды в различных средах.
Это может быть связано с изменением электростатики (из-за наличия ДНК) системы.Среднее время пребывания воды в первой сольватной оболочке ДНК и время жизни водородной связи в малой бороздке ДНК дали представление о сложной динамике воды в различных средах.
С точки зрения локальной термодинамики, свободная энергия, приходящаяся на воду в первой сольватной оболочке, увеличивается с увеличением концентрации ЭГ. Энтропия играет менее важную роль в локальной свободной энергии воды. Однако свободная энергия в расчете на одну толпу (в пределах 15 Å от ДНК) остается аналогичной с увеличением концентрации EG.Следует отметить, что расчеты локализованной свободной энергии имеют приблизительные значения. Следовательно, значения не следует принимать количественно. Однако качественная картина, вырисовывающаяся из этих расчетов, дает представление о природе первой сольватной оболочки.
Наблюдения, полученные в результате этого исследования, можно резюмировать следующим образом: (а) ЭГ нарушает сеть водородных связей и электростатику как вблизи, так и вдали от ДНК, (б) количество водородных связей с ДНК растворителями остается практически неизменным (однако, их природа изменяется по мере того, как EG вторгается в первую сольватную оболочку ДНК), (c) образец водородных связей между водой и EG вблизи ДНК отличается от основной массы, (d) динамика ДНК и структурные флуктуации незначительны, в первую очередь из-за малой длины дуплекса (e) приблизительная локализованная свободная энергия на воду и на толпу показывает монотонное увеличение на воду по мере увеличения концентрации EG (однако для толпы она по существу такая же), (f) MRT воды в первая сольватационная оболочка ДНК увеличивается с увеличением концентрации.
Один важный вопрос: основаны ли наши наблюдения на энтропии и / или на энтальпии? По существу, пики всех PCF не расширяются при увеличении концентрации краудера. Это указывает на то, что первичное взаимодействие является энтальпийным. Энтропийная стоимость расположения молекул EG рядом с ДНК при более низкой концентрации больше, чем при более высокой концентрации [85]. Однако даже при концентрации EG 10% ДНК-EG PCF показывает резкий первый пик, что указывает на то, что стоимость энтропии компенсируется энтальпийным эффектом (а также увеличением энтропии от выделения воды вблизи ДНК).DNA-Na + PCF показывает более тонкую структуру при 30% EG, чем при более низких концентрациях. Это указывает на сильное взаимодействие макроион (здесь ДНК — макроион) с противоионным взаимодействием в присутствии бинарного растворителя. Предыдущая работа показала, что во взаимодействии макроион-противоион присутствуют как энтальпийный, так и энтропийный эффекты [86]. Вероятно, здесь тоже происходит это. Что касается ПКФ с ионами, WAT-Cl — (EG-Cl —) PCF шире, чем WAT-Na + PCF (EG-Na + ).Поскольку Cl — далек от ДНК, он не так сильно связан ни с водой, ни с EG. Этим же объясняется уширение второго пика в ПКФ Na + и Cl —. Следовательно, из серии рассчитанных ПКФ можно сделать вывод, что эффекты первой сольватационной оболочки в основном определяются энтальпией. К такому же выводу следует и расчет GIST, в котором использовалась другая методология для извлечения свойств оболочки первой сольватации. Мы также отмечаем, что электростатика в нашей системе не может быть объяснена простым масштабированием диэлектрической проницаемости, потому что существует значительная неоднородность плотности заряда вблизи ДНК, по крайней мере, до второй сольватационной оболочки.Маловероятно, что средний эффект этого будет зафиксирован одной диэлектрической проницаемостью.
Что касается ПКФ с ионами, WAT-Cl — (EG-Cl —) PCF шире, чем WAT-Na + PCF (EG-Na + ).Поскольку Cl — далек от ДНК, он не так сильно связан ни с водой, ни с EG. Этим же объясняется уширение второго пика в ПКФ Na + и Cl —. Следовательно, из серии рассчитанных ПКФ можно сделать вывод, что эффекты первой сольватационной оболочки в основном определяются энтальпией. К такому же выводу следует и расчет GIST, в котором использовалась другая методология для извлечения свойств оболочки первой сольватации. Мы также отмечаем, что электростатика в нашей системе не может быть объяснена простым масштабированием диэлектрической проницаемости, потому что существует значительная неоднородность плотности заряда вблизи ДНК, по крайней мере, до второй сольватационной оболочки.Маловероятно, что средний эффект этого будет зафиксирован одной диэлектрической проницаемостью.
Наконец, у нас остается уместный вопрос относительно наших наблюдений и их зависимости от используемой модели. Основным недостатком нашей модели является то, что она неполяризуема, как это обычно бывает с силовыми полями биомолекулярных симуляций. Следовательно, плотность заряда одного вида не изменяется в ответ на присутствие другого заряженного вещества. Вероятно, что сильные взаимодействия первой сольватной оболочки останутся сильными даже при поляризуемом потенциале.Главное изменение может произойти в районе немного далеком от ДНК. Следует отметить, что водородное связывание может быть очень кооперативным. Однако в неполяризуемой модели, используемой в настоящей работе, кооперативность не отражена должным образом. Это может изменить некоторые выводы, сделанные в текущей работе.
Основным недостатком нашей модели является то, что она неполяризуема, как это обычно бывает с силовыми полями биомолекулярных симуляций. Следовательно, плотность заряда одного вида не изменяется в ответ на присутствие другого заряженного вещества. Вероятно, что сильные взаимодействия первой сольватной оболочки останутся сильными даже при поляризуемом потенциале.Главное изменение может произойти в районе немного далеком от ДНК. Следует отметить, что водородное связывание может быть очень кооперативным. Однако в неполяризуемой модели, используемой в настоящей работе, кооперативность не отражена должным образом. Это может изменить некоторые выводы, сделанные в текущей работе.
Заключение
Цель данной работы — понять влияние краудинга на структуру и термодинамику сольватации ДНК на молекулярном уровне в растворителе EG плюс вода. Наши результаты показывают, что существует интересная и нетривиальная конкуренция с участием ЭГ, воды и ионов соли, которая в основном регулируется сложной электростатикой и водородными связями. Наши результаты в основном совпадают с экспериментом и предыдущим моделированием, проведенным с использованием смеси чистого ЭГ и воды для образования водородных связей. Наши результаты предполагают проведение экспериментов, которые могут захватить структурную и термодинамику локализованной области около ДНК (например, с использованием методов двумерной ближней инфракрасной области (2D-NIR)). Эта работа может быть расширена (а) с использованием поляризуемого силового поля, которое должно улавливать Н-связи более количественно, и (б) путем использования его для изучения влияния последовательности ДНК.
Наши результаты в основном совпадают с экспериментом и предыдущим моделированием, проведенным с использованием смеси чистого ЭГ и воды для образования водородных связей. Наши результаты предполагают проведение экспериментов, которые могут захватить структурную и термодинамику локализованной области около ДНК (например, с использованием методов двумерной ближней инфракрасной области (2D-NIR)). Эта работа может быть расширена (а) с использованием поляризуемого силового поля, которое должно улавливать Н-связи более количественно, и (б) путем использования его для изучения влияния последовательности ДНК.
Ссылки
- 1.ван ден Берг Б. Влияние макромолекулярного краудинга на сворачивание и агрегацию белков. EMBO J. 1999; 18: 6927–6933. pmid: 10601015
- 2. Ривас Дж., Ферроне Ф., Херцфельд Дж. Жизнь в многолюдном мире. EMBO Rep. 2004; 5: 23–27. pmid: 14710181
- 3.
Эллис Р.Дж., Минтон А.П. Клеточная биология: присоединяйтесь к толпе.
 Природа. 2003. 425: 27–28. pmid: 12955122
Природа. 2003. 425: 27–28. pmid: 12955122 - 4. Эллис Р.Дж. Макромолекулярная скученность: очевидна, но недооценена. Trends Biochem Sci.2001; 26: 597–604. pmid: 115
- 5. Кузнецова И.М., Туроверов К.К., Уверский В.Н. Что макромолекулярное скопление может сделать с белком. Int J Mol Sci. 2014; 15: 23090–23140. pmid: 25514413
- 6. Чжоу Х.-Х, Ривас Г., Минтон А.П. Макромолекулярная скученность и изоляция: биохимические, биофизические и потенциальные физиологические последствия. Анну Рев Биофиз. 2008. 37: 375–397. pmid: 18573087
- 7. Кристиансен А., Ван К., Чунг М.С., Виттунг-Стафшеде П.Влияние макромолекулярных агентов на сворачивание белков in vitro и in silico. Biophys Rev. Springer-Verlag; 2013; 5: 137–145. pmid: 28510156
- 8. З. С. Б., М. А. П. Макромолекулярное скопление: биохимические, биофизические и физиологические последствия. Annu Rev Biophys Biomol Struct. 22: 27–65. pmid: 7688609
- 9.
 Корнберг А. Десять заповедей: Уроки энзимологии репликации ДНК. Журнал бактериологии. 2000. С. 3613–3618. pmid: 10850972
Корнберг А. Десять заповедей: Уроки энзимологии репликации ДНК. Журнал бактериологии. 2000. С. 3613–3618. pmid: 10850972 - 10.Knowles DB, LaCroix AS, Deines NF, Shkel I, Record MT. Разделение преимущественного взаимодействия и исключенного объемного влияния на стабильность дуплекса ДНК и шпильки. Proc Natl Acad Sci. 2011; 108: 12699–12704. pmid: 21742980
- 11. Риджуэй Д., Бродерик Дж., Лопес-Кампистроус А., Ру’Аини М., Винтер П., Гамильтон М. и др. Крупнозернистое молекулярное моделирование диффузии и кинетики реакций в переполненной виртуальной цитоплазме. Биофиз Дж. 2008; 94: 3748–3759. pmid: 18234819
- 12.McGuffee SR, Elcock AH. Диффузия, скученность и стабильность белка в динамической молекулярной модели бактериальной цитоплазмы. Бриггс Дж. М., редактор. PLoS Comput Biol. 2010; 6: e1000694. pmid: 20221255
- 13.
Элкок А. Модели эффектов макромолекулярного краудинга и необходимость количественного сравнения с экспериментом.
 Curr Opin Struct Biol. Elsevier Current Trends; 2010. 20: 196–206. pmid: 20167475
Curr Opin Struct Biol. Elsevier Current Trends; 2010. 20: 196–206. pmid: 20167475 - 14. Frembgen-Kesner T, Elcock AH. Компьютерное моделирование бактериальной цитоплазмы [Интернет].Биофизические обзоры. Springer-Verlag; 2013. С. 109–119. pmid: 237
- 15. Андо Т., Сколник Дж. Краудинг и гидродинамические взаимодействия, вероятно, доминируют над движением макромолекул in vivo. Proc Natl Acad Sci. 2010; 107: 18457–18462. pmid: 20937902
- 16. Hasnain S, McClendon CL, Hsu MT, Jacobson MP, Bandyopadhyay P. Новая крупнозернистая модель цитоплазмы E. coli: точный расчет коэффициента диффузии белков и наблюдение аномальной диффузии.Роккатано Д., редактор. PLoS One. Публичная научная библиотека; 2014; 9: e106466. pmid: 25180859
- 17. Накано С., Миёси Д., Сугимото Н. Влияние молекулярного скопления на структуры, взаимодействия и функции нуклеиновых кислот. Chem Rev.2014; 114: 2733–2758. pmid: 24364729
- 18.
 Арчелла А., Портелла Дж., Коллепардо-Гевара Р., Чакраборти Д., Уэльс Д. Д., Ороско М. Структура и свойства ДНК в аполярных растворителях. J. Phys Chem B. Американское химическое общество; 2014; 118: 8540–8548.pmid: 24968001
Арчелла А., Портелла Дж., Коллепардо-Гевара Р., Чакраборти Д., Уэльс Д. Д., Ороско М. Структура и свойства ДНК в аполярных растворителях. J. Phys Chem B. Американское химическое общество; 2014; 118: 8540–8548.pmid: 24968001 - 19. Кан Х., Тоан Н.М., Хён С., Тирумалай Д. Неожиданное набухание жесткой ДНК в полидисперсной тесноте. J Am Chem Soc. Американское химическое общество; 2015; 137: 10970–10978. pmid: 26267166
- 20. Cheatham TE, Crowley MF, Fox T, Kollman PA. Картина на молекулярном уровне стабилизации A-ДНК в смешанных растворах этанола и воды. Proc Natl Acad Sci U S. A. Национальная академия наук; 1997; 94: 9626–30.
- 21. Ной А., Перес А., Лотон, Калифорния, Ороско М.Теоретическое исследование больших конформационных переходов в ДНК: конформационное изменение B↔A в воде и этанол / вода. Nucleic Acids Res. Издательство Оксфордского университета; 2007. 35: 3330–3338. pmid: 17459891
- 22.
Portella G, Terrazas M, Villegas N, González C, Orozco M.
 Может ли денатурант стабилизировать ДНК? Пиридин обращает денатурацию ДНК в кислый pH. Angew Chemie Int Ed. Вили-Блэквелл; 2015; 54: 10488–10491. pmid: 26224143
Может ли денатурант стабилизировать ДНК? Пиридин обращает денатурацию ДНК в кислый pH. Angew Chemie Int Ed. Вили-Блэквелл; 2015; 54: 10488–10491. pmid: 26224143 - 23. Spink CH, Председатель JB. Влияние гидратации, высвобождения ионов и исключенного объема на плавление триплексной и дуплексной ДНК.Биохимия. 1999; 38: 496–508. pmid: 98
- 24. Татейши-Каримта Х., Сугимото Н. Контроль стабильности и структуры нуклеиновых кислот с использованием соколятов. Методы. 2014; 67: 151–158. pmid: 24270066
- 25. Лю И, Шан И, Лю Х, Ху И, Цзян Дж. Эффект краудинга на плавление ДНК: молекулярная термодинамическая модель с явным растворителем. Phys Chem Chem Phys. 2012; 14: 15400. pmid: 23059955
- 26.
Харве К.С., Лареу Р., Раджагопалан Р., Рагхунатх М.Понимание того, как переполненная внутренняя часть клеток стабилизирует гибриды ДНК / ДНК и ДНК / РНК — прогнозы in silico и доказательства in vitro. Nucleic Acids Res.
 2009. 38: 172–181. pmid: 19854935
2009. 38: 172–181. pmid: 19854935 - 27. Йилдирим А., Шарма М., Варнер Б.М., Фанг Л., Фейг М. Конформационные предпочтения ДНК в условиях пониженной диэлектрической проницаемости. J. Phys Chem B. 2014; 118: 10874–10881. pmid: 25166278
- 28. Накано М., Татейши-Каримата Х, Танака С., Тама Ф., Мияшита О, Накано С. и др. Термодинамические свойства молекул воды в присутствии косолюта зависят от структуры ДНК: исследование с использованием теории неоднородной сольватации сетки.Nucleic Acids Res. 2015; gkv1133. pmid: 26538600
- 29. Лазаридис Т. Неоднородный жидкостной подход к термодинамике сольватации. 1. Теория. J. Phys Chem B. 1998; 102: 3531–3541.
- 30. Лучко Т., Гусаров С., Роу Д.Р., Симмерлинг С., Кейс Д.А., Тушинский Дж. И др. Трехмерная молекулярная теория сольватации в сочетании с молекулярной динамикой в Амбере. J Chem Theory Comput. Общественный доступ NIH; 2010. 6: 607–624. pmid: 20440377
- 31.
 Nguyen CN, Kurtzman Young T., Gilson MK.Теория сеточной неоднородной сольватации: структура гидратации и термодинамика миниатюрного рецептора кукурбита [7] урила. J Chem Phys. 2012; 137: 044101. pmid: 22852591
Nguyen CN, Kurtzman Young T., Gilson MK.Теория сеточной неоднородной сольватации: структура гидратации и термодинамика миниатюрного рецептора кукурбита [7] урила. J Chem Phys. 2012; 137: 044101. pmid: 22852591 - 32. Лазаридис Т. Неоднородный жидкостной подход к термодинамике сольватации. 2. Приложения к простым жидкостям. J. Phys Chem B. 1998; 102: 3542–3550.
- 33. Беглов Д., Ру Б. Интегральное уравнение для описания сольватации полярных молекул в жидкой воде. J. Phys Chem B. 1997; 101: 7821–7826.
- 34. Коваленко А., Хирата Ф. Трехмерные профили плотности воды в контакте с растворенным веществом произвольной формы: подход RISM. Chem Phys Lett. 1998. 290: 237–244.
- 35. Коваленко А., Хирата Ф. Самосогласованное описание границы раздела металл – вода с помощью теории функционала плотности Кона – Шэма и трехмерной эталонной модели узла взаимодействия. J Chem Phys. 1999; 110: 10095–10112.
- 36.
 Дело Том Дарден Томас Э. Читхэм III Карлос Симмерлинг Адриан Ройтберг Джунмей Ван Д.А., Гётц SDSC AW, Иштван Колоссвари Будапешт U, Шоу Франческо Паесани Цзянь Лю Сюнгу Ву Томас Штайнбрехер Д.Справочное руководство Amber 14. https://www.researchgate.net/profile/Tai-Sung_Lee/publication/270588529_Amber_2014/links/5501add20cf2d60c0e5fd2b6/Amber-2014.pdf
Дело Том Дарден Томас Э. Читхэм III Карлос Симмерлинг Адриан Ройтберг Джунмей Ван Д.А., Гётц SDSC AW, Иштван Колоссвари Будапешт U, Шоу Франческо Паесани Цзянь Лю Сюнгу Ву Томас Штайнбрехер Д.Справочное руководство Amber 14. https://www.researchgate.net/profile/Tai-Sung_Lee/publication/270588529_Amber_2014/links/5501add20cf2d60c0e5fd2b6/Amber-2014.pdf - 37. Бейли С.И., Цеплак П., Корнелл В., Коллман, Пенсильвания. Метод с хорошим поведением, основанный на электростатическом потенциале, с использованием ограничений заряда для получения атомных зарядов: модель RESP. J. Phys Chem. 1993; 97: 10269–10280.
- 38. Vanquelef E, Simon S, Marquant G, Garcia E, Klimerak G, Delepine JC и др. КРАСНЫЙ. Сервер: веб-сервис для получения зарядов RESP и ESP и построения библиотек силовых полей для новых молекул и молекулярных фрагментов.Nucleic Acids Res. 2011; 39: W511 – W517. pmid: 21609950
- 39.
Дюпрадо Ф.-И, Пигаш А., Заффран Т.
 , Савино С., Лелонг Р., Гривель Н. и др. Красный. инструменты: достижения в области расчета зарядов RESP и ESP и создания библиотеки силовых полей. Phys Chem Chem Phys. 2010; 12: 7821. pmid: 20574571
, Савино С., Лелонг Р., Гривель Н. и др. Красный. инструменты: достижения в области расчета зарядов RESP и ESP и создания библиотеки силовых полей. Phys Chem Chem Phys. 2010; 12: 7821. pmid: 20574571 - 40. Фриш MJ, Trucks GW, Schlegel HB, Scuseria GE, Robb MA, Cheeseman JR и др. Gaussian 09 Редакция E.01.
- 41. Ван Дж., Ван В., Коллман П.А., Дело DA.Автоматическое определение типа атома и типа связи в молекулярно-механических расчетах. Модель графа Дж. Моля. 2006; 25: 247–260. pmid: 16458552
- 42. Ван Дж., Вольф Р.М., Колдуэлл Дж. В., Коллман П.А., Дело DA. Разработка и тестирование общего силового поля Янтаря. J. Comput Chem. 2004. 25: 1157–1174. pmid: 15116359
- 43.
Мартинес Л., Андраде Р., Биргин Е. Г., Мартинес Дж. М.. PACKMOL: Пакет для построения начальных конфигураций для моделирования молекулярной динамики. J. Comput Chem.2009. 30: 2157–2164. pmid: 1
44
- 44.
Джунг И.С., Читам Т.
 Е. Определение параметров щелочных и галогенидных одновалентных ионов для использования в симуляциях биомолекул с явной сольватом. J. Phys Chem B. Американское химическое общество; 2008; 112: 9020–9041. pmid: 185
Е. Определение параметров щелочных и галогенидных одновалентных ионов для использования в симуляциях биомолекул с явной сольватом. J. Phys Chem B. Американское химическое общество; 2008; 112: 9020–9041. pmid: 185 - 45. Cheatham TE, Cieplak P, Kollman PA. Модифицированная версия Cornell et al. Силовое поле с улучшенными фазами сахарной складки и спиральным повторением. J Biomol Struct Dyn. 1999; 16: 845–862. pmid: 10217454
- 46.Перес А., Марчан И., Свозил Д., Спонер Дж., Читхэм Т.Э., Лотон, Калифорния и др. Уточнение силового поля AMBER для нуклеиновых кислот: улучшение описания α / γ-конформеров. Биофиз Дж. 2007; 92: 3817–3829. pmid: 17351000
- 47. Ван Дж., Цеплак П., Коллман П.А. Насколько хорошо модель сдержанного электростатического потенциала (RESP) работает при расчете конформационных энергий органических и биологических молекул? J. Comput Chem. 2000; 21: 1049–1074.
- 48.
Zgarbová M, Otyepka M, Šponer J, Mládek A, Banáš P, Cheatham TE, et al.
 Уточнение работы Cornell et al. Силовое поле нуклеиновых кислот на основе справочных квантово-химических расчетов гликозидных торсионных профилей. J Chem Theory Comput. 2011; 7: 2886–2902. pmid: 21
Уточнение работы Cornell et al. Силовое поле нуклеиновых кислот на основе справочных квантово-химических расчетов гликозидных торсионных профилей. J Chem Theory Comput. 2011; 7: 2886–2902. pmid: 215
- 49. Дарден Т., Йорк Д., Педерсен Л. Сетка частиц Эвальда: метод N ⋅log ( N ) для сумм Эвальда в больших системах. J Chem Phys. Американский институт физики; 1993; 98: 10089–10092.
- 50. Ryckaert J-P, Ciccotti G, Berendsen HJ. Численное интегрирование декартовых уравнений движения системы со связями: молекулярная динамика н-алканов.J. Comput Phys. 1977; 23: 327–341.
- 51. Ву X, Брукс BR. Самостоятельный метод моделирования динамики Ланжевена. Chem Phys Lett. Северная Голландия; 2003; 381: 512–518.
- 52. Берендсен HJC, Postma JPM, ван Гунстерен В.Ф., ДиНола А., Хаак мл. Молекулярная динамика с привязкой к внешней ванне. J Chem Phys. Американский институт физики; 1984. 81: 3684–3690.
- 53.
 Ивани I, Данс П.Д., Ной А., Перес А., Фаустино I, больница А и др. Parmbsc1: усовершенствованное силовое поле для моделирования ДНК.Нат методы. Издательская группа «Природа»; 2016; 13: 55–58. pmid: 26569599
Ивани I, Данс П.Д., Ной А., Перес А., Фаустино I, больница А и др. Parmbsc1: усовершенствованное силовое поле для моделирования ДНК.Нат методы. Издательская группа «Природа»; 2016; 13: 55–58. pmid: 26569599 - 54.
Лавери Р., Мэддокс Дж. Х., Паси М., Закжевска К. Анализ распределения ионов вокруг ДНК. Nucleic Acids Res. Издательство Оксфордского университета; 2014; 42: 8138–8149. pmid: 24
2 - 55. Рэмси С., Нгуен С., Саломон-Феррер Р., Уокер Р.К., Гилсон М.К., Курцман Т. Сольватационное термодинамическое отображение молекулярных поверхностей в AmberTools: GIST. J. Comput Chem. 2016; 37: 2029–2037. pmid: 27317094
- 56.Эль Хасан Ма, Калладин CR. Два различных режима изгиба ДНК, индуцированного белками. J Mol Biol. 1998. 282: 331–343. pmid: 9735291
- 57. Лу Икс-Дж. 3DNA: программный пакет для анализа, восстановления и визуализации трехмерных структур нуклеиновых кислот. Nucleic Acids Res. 2003. 31: 5108–5121.
 pmid: 12
pmid: 122 - 58. Амадей А., Линссен ABM, Berendsen HJC. Существенная динамика белков. Proteins Struct Funct Genet. Вили-Блэквелл; 1993; 17: 412–425.pmid: 8108382
- 59. Перес А., Блас Дж. Р., Руэда М., Лопес-Бес Дж. М., де ла Крус Х, Ороско М. Изучение существенной динамики B-ДНК. J Chem Theory Comput. 2005; 1: 790–800. pmid: 26641895
- 60. Перес А., Блас Дж. Р., Руэда М., Лопес-Бес Дж. М., де ла Крус Х, Ороско М. Изучение существенной динамики B-ДНК. J Chem Theory Comput. 2005; 1: 790–800. pmid: 26641895
- 61. Данс П.Д., Данилан Л., Ивани И., Дршата Т., Ланкаш Ф., Больница А и др. Динамика додекамера Дрю – Дикерсона в долгосрочном масштабе.Nucleic Acids Res. Издательство Оксфордского университета; 2016; 44: 4052–4066. pmid: 27084952
- 62. Dans PD, Faustino I, Battistini F, Zakrzewska K, Lavery R, Orozco M. Раскрытие зависимого от последовательности полиморфного поведения d (CpG) шагов в B-ДНК.
 Nucleic Acids Res. Издательство Оксфордского университета; 2014; 42: 11304–11320. pmid: 25223784
Nucleic Acids Res. Издательство Оксфордского университета; 2014; 42: 11304–11320. pmid: 25223784- 63. Паси М., Мэддокс Дж. Х., Лавери Р. Анализ распределения ионов вокруг ДНК: зависимость распределения ионов калия от последовательности из микросекундной молекулярной динамики.Nucleic Acids Res. Издательство Оксфордского университета; 2015; 43: 2412–2423. pmid: 25662221
- 64. КАУЗМАНН В. Некоторые факторы в интерпретации денатурации белков. Adv Protein Chem. 1959; 14: 1–63. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/14404936 pmid: 14404936
- 65. Биззарри А.Р., Каннистраро С. Молекулярная динамика воды на границе раздела белок-растворитель. J. Phys Chem B. 2002; 106: 6617–6633.
- 66. Саха Д., Супекар С., Мукерджи А.Распределение времени пребывания воды вокруг пар оснований ДНК: управляющие факторы и происхождение неоднородности. J. Phys Chem B. 2015; 119: 11371–11381. pmid: 25993473
- 67. Денисов В.
 П., Карлстрём Г., Вену К., Галле Б. Кинетика гидратации ДНК. J Mol Biol. 1997. 268: 118–136. pmid:46
П., Карлстрём Г., Вену К., Галле Б. Кинетика гидратации ДНК. J Mol Biol. 1997. 268: 118–136. pmid:46- 68. Лиепинш Э., Оттинг Г., Вютрих К. ЯМР-наблюдение отдельных молекул гидратной воды, связанных с дуплексами ДНК: прямое свидетельство наличия хребта гидратной воды в водном растворе.Nucleic Acids Res. 1992; 20: 6549–6553. pmid: 1480475
- 69. Араи С., Чатаке Т., Охара Т., Курихара К., Танака И., Сузуки Н. и др. Сложная ориентация воды в малой бороздке декамера В-ДНК d (CCATTAATGG) 2, наблюдаемая с помощью нейтронографических измерений. Nucleic Acids Res. Издательство Оксфордского университета; 2005; 33: 3017–24. pmid: 153
- 70. Аффингер П., Вестхоф Э. Связывание воды и ионов вокруг r (UpA) 12 и d (TpA) 12O-олигомеров — сравнение с дуплексами РНК и ДНК (CpG) 12.J Mol Biol. 2001; 305: 1057–1072. pmid: 11162114
- 71. Макдермотт ML, Vanselous H, Corcelli SA, Petersen PB. Хиральный стержень гидратации ДНК.
 ACS Cent Sci. Американское химическое общество; 2017; 3: 708–714. pmid: 28776012
ACS Cent Sci. Американское химическое общество; 2017; 3: 708–714. pmid: 28776012- 72. Чен Ю., Одзаки Ю., Чарнецкий М.А. Молекулярная структура и водородные связи в чистом жидком этиленгликоле и смесях этиленгликоль-вода изучены с помощью NIR-спектроскопии. Phys Chem Chem Phys. 2013; 15: 18694. pmid: 24071663
- 73.Weng L, Chen C, Zuo J, Li W. Изучение молекулярной динамики влияния температуры и концентрации на водородно-связывающие способности этиленгликоля и глицерина: последствия для криоконсервации. J. Phys Chem A. 2011; 115: 4729–4737. pmid: 21500852
- 74. Кайзер А., Исмаилова О., Коскела А., Хубер С. Е., Риттер М., Козенца Б. и др. Новый взгляд на этиленгликоль: моделирование молекулярной динамики и визуализация жидкости и ее сети водородных связей. J Mol Liq. 2014; 189: 20–29.pmid: 24748697
- 75. Хирата Ф., Леви РМ. Индуцированные солью конформационные изменения в ДНК: анализ с использованием теории полимерного RISM.
 J. Phys Chem. 1989; 93: 479–484. Доступно: https://pubs.acs.org/doi/pdf/10.1021/j100338a092
J. Phys Chem. 1989; 93: 479–484. Доступно: https://pubs.acs.org/doi/pdf/10.1021/j100338a092- 76. Feig M, Pettitt BM. Картина молекулярного моделирования гидратации ДНК вокруг A- и B-ДНК. Биополимеры. Вили-Блэквелл; 1998; 48: 199.
- 77. Shanker S, Bandyopadhyay P. Как ион Mg2 + и водная сеть влияют на стабильность и структуру пар оснований не-Ватсона – Крика в E.coli петля E 5S рРНК: исследование молекулярной динамики и эталонной модели сайта взаимодействия (RISM). J Biomol Struct Dyn. Тейлор и Фрэнсис; 2017; 35: 2103–2122. pmid: 27426235
- 78. Аллахьяров Э., Д’Амико И., Лёвен Х. Притяжение между одноименными макроионами за счет кулоновского истощения. Phys Rev Lett. Американское физическое общество; 1998. 81: 1334–1337.
- 79. Альберго Д.Д., Тернер Д.Х. Влияние растворителя на термодинамику образования двойной спирали в (dG-dC) 3. Биохимия.Американское химическое общество; 1981; 20: 1413–1418.
- 80.
 Накано С., Ямагути Д., Татейши-Каримата Х., Миёси Д., Сугимото Н. Изменения гидратации при свертывании ДНК, изученные в экспериментах с осмотическим стрессом. Биофиз Дж. Биофизическое общество; 2012; 102: 2808–17. pmid: 22735531
Накано С., Ямагути Д., Татейши-Каримата Х., Миёси Д., Сугимото Н. Изменения гидратации при свертывании ДНК, изученные в экспериментах с осмотическим стрессом. Биофиз Дж. Биофизическое общество; 2012; 102: 2808–17. pmid: 22735531- 81. Спинк Ч., Гарбетт Н. Энтальпии плавления ДНК в присутствии осмолитов. Biophys Chem. Эльзевир; 2007. 126: 176–185. pmid: 160
- 82. Baltierra-Jasso LE, Мортен MJ, Laflör L, Quinn SD, Magennis SW.Индуцированная краудингом гибридизация шпилек с одиночной ДНК. J Am Chem Soc. Американское химическое общество; 2015; 137: 16020–16023. pmid: 26654490
- 83. Накано Шу-ичи, Каримата Хисаэ, Омичи Тацуо, Каваками Дзюнджи и Сугимото Наоки. Влияние молекулярного краудинга с длиной нуклеотида и косолютной структурой на стабильность дуплекса ДНК. Американское химическое общество; 2004; pmid: 15521733
- 84. Миёси Д., Накао А., Сугимото Н. Молекулярное скопление людей регулирует структурный переключатель G-квадруплекса ДНК † .
 Биохимия. 2002; 41: 15017–15024. pmid: 12475251
Биохимия. 2002; 41: 15017–15024. pmid: 12475251- 85. Lazaridis T, Paulaitis ME. Энтропия гидрофобной гидратации: новая статистическая механическая формулировка. J. Phys Chem. 1992; 96: 3841–3855. Доступно: https://pubs.acs.org/doi/pdf/10.1021/j100188a051
- 86. Сьёстрём Л., Окессон Т., Йонссон Б. Инверсия заряда в двойных электрических слоях — баланс между энергией и энтропией. Berichte der Bunsengesellschaft für Phys Chemie. Вили-Блэквелл; 1996; 100: 889–893.
Конструкция поверхности с плотными цепями полиэтиленгликоля и ее характеристики
- 1
Schultz, J., Mrksich, M., Bhatia, SN & Brady, DJ Biosensing: International Research and Development (Springer, Токио, 2006 г.).
Книга Google Scholar
- 2
Эдвардс, Р. Иммунодиагностика. Практический подход (Серия практических подходов) (Oxford University Press, Лондон, 1999).

Google Scholar
- 3
Уайлд, Д. Г. (ред.). The Immunoassay Handbook 3rd edn (Elsevier, Amsterdam, 2005).
Google Scholar
- 4
Куриен Б. Т. и Хэл Скофилд Р. (ред.). Блоттинг и обнаружение белков: методы и протоколы (методы в молекулярной биологии) (Humana Press, New York, 2009).
Книга Google Scholar
- 5
Фунг, Э. Методы и протоколы белковых массивов (методы в молекулярной биологии) (Humana Press, New York, 2010).
Google Scholar
- 6
Hermanson, G. T. Bioconjugate Techniques 2nd edn (Academic Press, Waltham, 2008).
Google Scholar
- 7
Беккер, Г. С., Коупленд, К. В. и Листер, С. А. Коровье бешенство, губчатая энцефалопатия крупного рогатого скота (Nova Publishers, Hauppauge, 2008).

Google Scholar
- 8
Мори, Ю., Нагаока, С., Такиучи, Х., Кикучи, Т., Ногучи, Н., Танзава, Х., Нойсики, Ю. Новые антитромбогенные материалы с длинной полиэтиленоксидной цепью. Пер. Являюсь. Soc. Артиф. Междунар. Органы 28 , 459 (1982) Схема 5: гибридизированная поверхность олигоДНК / поли (этиленгликоль) (ПЭГ) (плотно упакованная смесь цепи ПЭГ улучшает не только необрастающий характер, но также и ориентацию олигоДНК).Рисунок 7: Зондирование поверхностного плазмонного резонанса (SPR) комплементарной одноцепочечной ДНК (оцДНК, красная полоса) и несовпадающей оцДНК (синяя полоса) на зондовой оцДНК-сульфанил (SH) -иммобилизованной поверхности золота: (1) голая и (2 ) поверхность, модифицированная полиэтиленгликолем (ПЭГ) / поли [2- (N, N-диметиламино) этилметакрилат] (ПАМА, 5k / 5k). Этот рисунок воспроизведен из Yoshimoto et al. , 73 любезно предоставлено издателем Химическим обществом Японии. Схема 6: Смешанная поли (этиленгликоль) (ПЭГ) связанная цепь, содержащая свободную сульфанильную (SH) группу на конце цепи ПЭГ на поверхности золота (цепь ПЭГ улучшает необрастающий характер и предотвращает образование петли группы SH-конца на золоте поверхность).

CAS PubMed Google Scholar
- 9
Jeon, S. I. и Andrade, J. D. Взаимодействие белков и поверхностей в присутствии полиэтиленоксида: II. Влияние размера белка. J. Colloid Interface Sci. 142 , 159–166 (1991).
CAS Статья Google Scholar
- 10
Gölander, C.-G., Herron, J. N., Lim, K., Claesson, P., Stenius, P.И Андраде, Дж. Д. в Поли (этиленгликоль) Химия, биотехнические и биомедицинские применения (изд. Харрис, Дж. М.) 221–245 (Пленум, Нью-Йорк, 1992).
Google Scholar
- 11
Лина Ю.С., Хлади В. и Гёландер1, К.-Г. Коллоиды и поверхности Б. Биоинтерфейсы 3 , 49–62 (1994).
Артикул Google Scholar
- 12
Pasche, S., Vo1ro1s, J., Griesser, H.J., Spencer, N.D. и Textor, M. Влияние ионной силы и поверхностного заряда на адсорбцию белка на ПЭГилированных поверхностях.
 J. Phys. Chem. B 109 , 17545–17552 (2005).
J. Phys. Chem. B 109 , 17545–17552 (2005).CAS PubMed Статья Google Scholar
- 13
Оцука, Х., Нагасаки, Ю. и Катаока, К. Характеристика поверхности функционализированного полилактида посредством покрытия из гетеробифункциональных блок-сополимеров поли (этиленгликоля) / полилактида. Биомакромолекулы 1 , 39–48 (2000).
CAS PubMed Статья Google Scholar
- 14
Uchida, K., Otsuka, H., Kaneko, M., Kataoka, K. & Nagasaki, Y. Слой реактивного поли (этиленгликоля) для достижения специфического восприятия поверхностного плазмонного резонанса с высоким отношением сигнал / шум Соотношение: существенная роль короткого подстеточного слоя штифтов в минимизации неспецифической адсорбции. Анал. Chem. 77 , 1075–1080 (2005).
CAS Статья Google Scholar
- 15
Нагасаки Ю.
 Разработка поверхностей из полиэтиленгликоля, связанных цепями, для получения высокоэффективных бионаночастиц. Sci. Technol. Adv. Матер. 11 , 054505 (2010).
Разработка поверхностей из полиэтиленгликоля, связанных цепями, для получения высокоэффективных бионаночастиц. Sci. Technol. Adv. Матер. 11 , 054505 (2010).PubMed Статья Google Scholar
- 16
Юань, X., Фабрегат, Д., Йошимото, К. и Нагасаки, Ю. Дизайн высокофункционального антиферритин-иммунолатекса путем гибридизации полимеров антиферритин / смешанный ПЭГ на субмикрочастицах полистирола. Биоматериалы (Symp. Ser.) 1054 , 243–258 (2010) (Глава 13).
CAS Статья Google Scholar
- 17
Harbers, GM, Barber, TA, Healy, KE, Stile, RA & Sumner, DR в Biomimetic Materials and Design (eds Dillow, A. & Lowman, A.) 55–90 (Marcel Dekker, Нью-Йорк, 2002).
Google Scholar
- 18
Годдарда, Дж.М. и Хотчкисс, Дж. Х. Модификация поверхности полимера для прикрепления биоактивных соединений.
 Прог. Поли. Sci. 32 , 698–725 (2007).
Прог. Поли. Sci. 32 , 698–725 (2007).Артикул CAS Google Scholar
- 19
Йошимото, К., Ичино, М. и Нагасаки, Ю. Формирование инвертированного рисунка клеточных микрочипов на поверхности с рисунком геля полиэтиленгликоля (ПЭГ) и построение сфероидов гепатоцитов на немодифицированных микродоменах геля ПЭГ. Лаборатория на чипе 9 , 1286–1289 (2009).
CAS PubMed Статья Google Scholar
- 20
Кодзима, Р., Йошимото, К., Миёси, Х. и Нагасаки, Ю. Сфероидный массив эмбриональных клеток печени мыши, сконструированный на поверхности с микропроцессором из ПЭГ-геля: усиление функций печени путем совместного культивирования с непаренхиматозными клетками. клетки печени. Лаборатория на чипе 9 , 1991–1993 (2009).
CAS PubMed Статья Google Scholar
- 21
Лекбанд, Д.
 , Sheth, S. & Halperin, A. Кисти из привитого поли (этиленоксида) в качестве необрастающих покрытий поверхности. J. Biomater. Sci. Поли. Эд. 10 , 1125–1147 (1999).
, Sheth, S. & Halperin, A. Кисти из привитого поли (этиленоксида) в качестве необрастающих покрытий поверхности. J. Biomater. Sci. Поли. Эд. 10 , 1125–1147 (1999).CAS Статья Google Scholar
- 22
Пашалис Александридис, Т. А. Х. Блок-сополимерные поверхностно-активные вещества поли (этиленоксид) -поли (пропиленоксид) -поли (этиленоксид) в водных растворах и на границах раздела: термодинамика, структура, динамика и моделирование. Colloids Surf. A: Physicochem. Англ. Аспекты 96 , 1–46 (1995).
Артикул Google Scholar
- 23
Оцука, Х., Нагасаки, Ю. и Катаока, К. Характеристика связанных поверхностей альдегид-ПЭГ: влияние длины цепи ПЭГ на специфическое биопознавание. Langmuir 20 , 11285–11287 (2004).
CAS PubMed Статья Google Scholar
- 24
Янгблад, Дж.
 P., Andruzzi, A., Ober, CK, Hexemer, A., Kramer, EJ, Callow, JA, Finlay, JA & Callow, ME Покрытия на основе полиэтиленгликоля с боковыми цепями и фторуглеродных полимеров для контроль морского биообрастания. Биообрастание 19 (Дополнение), 91–98 (2003).
P., Andruzzi, A., Ober, CK, Hexemer, A., Kramer, EJ, Callow, JA, Finlay, JA & Callow, ME Покрытия на основе полиэтиленгликоля с боковыми цепями и фторуглеродных полимеров для контроль морского биообрастания. Биообрастание 19 (Дополнение), 91–98 (2003).CAS PubMed Статья Google Scholar
- 25
Элберт Д. и Хаббелл Дж. А. Самосборка и стерическая стабилизация на гетерогенных биологических поверхностях с использованием адсорбирующихся блок-сополимеров. Chem. Биол. 5 , 177–183 (1998).
CAS PubMed Статья Google Scholar
- 26
Миямото, Д., Оиси, М., Кодзима, К., Йошимото, К. и Нгасаки, Ю. Полностью диспергируемые ПЭГилированные наночастицы золота в физиологических условиях: модификация наночастиц золота с помощью точно контролируемого ПЭГ-b-полиамина . Langmuir 24 , 5010–5017 (2008).
CAS PubMed Статья Google Scholar
- 27
Ёсимото, К.
 , Nishio, M., Sugasawa, H. & Nagasaki, Y. Прямое наблюдение индуцированной адсорбцией инактивации фрагментов антител, окруженных слоем смешанных штифтов на поверхности золота. J. Am. Chem. Soc. 132 , 7982–7989 (2010).
, Nishio, M., Sugasawa, H. & Nagasaki, Y. Прямое наблюдение индуцированной адсорбцией инактивации фрагментов антител, окруженных слоем смешанных штифтов на поверхности золота. J. Am. Chem. Soc. 132 , 7982–7989 (2010).CAS PubMed PubMed Central Статья Google Scholar
- 28
Ning-Ping Huang, JV, De Paul, SM, Textor, M. & Spencer, ND Биотин-производное поли (L-лизин) -g-поли (этиленгликоль): новый полимерный интерфейс для определения биоаффинности . Langmuir 18 , 220–230 (2002).
Артикул CAS Google Scholar
- 29
Бейли, Ф. Е. Дж. В. К. Оксиды алкилена и их полимеры (Marcel Dekker Inc., Нью-Йорк, 1990).
Google Scholar
- 30
Гибсон, М. Фармацевтический преформулировка и рецептура: Практическое руководство от выбора лекарственного средства-кандидата до коммерческой лекарственной формы (лекарства и фармацевтические науки) (Informa Healthcare, Лондон, 2009).

Google Scholar
- 31
Хустедт, Х., Йоханссон, Г. и Тьернелд, Ф. Системы двухфазного разделения на водной основе (Kluwer Academic Publishers, Дордрехт, Нидерланды, 1990).
Google Scholar
- 32
E Glass, J. Hydrophilic Polymers: Performance with Environmental Acceptance (Американское химическое общество, Вашингтон, округ Колумбия, 1996).
Книга Google Scholar
- 33
Дойчер, М.П. Руководство по очистке белков. Метэнзимол 182 , 646–659 (1990).
Артикул Google Scholar
- 34
Сауэрс, A.E. Cell Fusion (Plenum Press, New York, NY, 1987).
Книга Google Scholar
- 35
Шалаби, С. В., Маккормик, К. Л. и Батлер, Г. Б. (ред.). Водорастворимые, полимеры, синтез, свойства растворов и приложения , Серия симпозиумов ACS, Vol.
 467 (Американское химическое общество, 1991).
467 (Американское химическое общество, 1991).Книга Google Scholar
- 36
Сони, А. С., Чандрашекхар, П. П. и Хаббелл, Дж. А. Межфазная фотополимеризация гидрогелей на основе полиэтиленгликоля на альгинат-поли (L-лизин) микрокапсулах для повышения биосовместимости. Биоматериалы 14 , 1008–1016 (1993).
CAS PubMed Статья Google Scholar
- 37
Ефремова Н.В., Хунг Ю., Пеппас Н. А. и Лекбанд Д. Э. Прямое измерение взаимодействий между связанными цепями полиэтиленгликоля и адсорбированными слоями муцина. Langmuir 18 , 836–845 (2002).
CAS Статья Google Scholar
- 38
Мартин Мальмстен, Д. М. Межфазное поведение «новых» сополимеров, содержащих поли (этиленоксид). J. Biomater. Sci. Polym. Эд. 10 , 1075–1087 (1999).
Артикул Google Scholar
- 39
Blaettler, TM, Marcus Textor, SP & Griesser, HJ Высокая солевая стабильность и устойчивость к белку сополимеров поли (L-лизин) -g-поли (этиленгликоль), ковалентно иммобилизованных через полимерные прослойки альдегидной плазмы на неорганических и полимерных подложки.
 Langmuir 22 , 5760–5769 (2006).
Langmuir 22 , 5760–5769 (2006).CAS Статья Google Scholar
- 40
Чен, Ю., Канг, Э. Т., Неох, К. Г., Ван, П. и Тан, П. К. Модификация поверхности полианилиновой пленки путем прививки полиэтиленгликоля для снижения адсорбции белка и адгезии тромбоцитов. Synthetic Met. 110 , 47–55 (2000).
CAS Статья Google Scholar
- 41
Цудзи, Ю., Эджаз, М., Ямамото, С., Оно, К., Ураяма, К. и Фукуда, Т. в статье Структура и свойства щеток для полимеров высокой плотности (ред. Advincula, Р.К., Бриттен, В. Дж., Кастер, К. К. и Рюэ, Дж.) (Полимерные кисти, Wiley-VCH, Weinheim, 2004).
Книга Google Scholar
- 42
София, С. Дж., Премнат, В. и Меррилл, Э. У. Поли (этиленоксид), привитый к кремниевым поверхностям: плотность прививки и адсорбция белка. Макромолекулы 31 , 5059–5070 (1998).

CAS PubMed Статья Google Scholar
- 43
Раджу Фрэнсис, А.МС, Карино, С.Р., Логан, Д.Л., Андерхилл, Р.С., Ангот, С., Татон, Д., Гнано, Ю. и Дюран, Р.С. Агрегация и морфология поверхности трехлепесткового блока из поли (этиленоксида) -полистирола звездчатый полимер на границе раздела воздух / вода, изученный методом АСМ. Макромолекулы 35 , 6483–6485 (2002).
Артикул CAS Google Scholar
- 44
Эмото, К., Мичихиро, И., Нагасаки, Ю. и Катаока, К. Функциональность полимерных мицелл-гидрогелей с организованной трехмерной архитектурой на поверхностях. J. Am. Chem. Soc. 122 , 2653–2654 (2000).
CAS Статья Google Scholar
- 45
Учида, К., Хосино, Ю., Тамура, А., Ёсимото, К., Кодзима, С., Ямасита, К., Яманака, И., Оцука, Х., Катаока, К., Нагасаки, Ю. Создание смешанной поверхности с привязанной цепью из полиэтиленгликоля для предотвращения неспецифической адсорбции белков и пептидов.
 Биоинтерфазы 2 , 126 (2007).
Биоинтерфазы 2 , 126 (2007).CAS PubMed Статья Google Scholar
- 46
Оцука, Х., Акияма, Ю., Нагасаки, Ю. и Катаока, К. Количественная и обратимая ассоциация наночастиц золота, модифицированных α-лактозил-ω-меркаптополом (этиленгликолем), индуцированная лектином. J. Am. Chem. Soc. 123 , 8226–8230 (2001).
CAS PubMed Статья Google Scholar
- 47
Вуэльфинг, W.П., Гросс, С. М., Майлз, Д. Т. и Мюррей, Р. В. Нанометрические кластеры золота, защищенные монослоями тиолированного поли (этиленгликоля) полимерного электролита, связанными с поверхностью. J. Am. Chem. Soc. 120 , 12696–12697 (1998).
CAS Статья Google Scholar
- 48
Берингер, Дж. П., Терреттаз, С., Мишель, Р., Тирелли, Н., Фогель, Х., Текстор, М. и Хаббелл, Дж. А. Хемосорбированные сополимеры на основе полипропиленсульфида сопротивляются биомолекулярным взаимодействиям.
 Нат. Матер. 2 , 259 (2003).
Нат. Матер. 2 , 259 (2003).CAS PubMed Статья Google Scholar
- 49
Купер, Э. и Леггетт, Дж. Дж. Статические вторичные ионные масс-спектрометрические исследования самосборных монослоев: влияние длины цепи адсорбата и концевой функциональной группы на скорость фотоокисления алкантиолов на золото. Ленгмюр 14 , 4795 (1998).
CAS Статья Google Scholar
- 50
Кастнер, Д.Г., Хиндс, К. и Грейнджер, Д. В. Рентгеновская фотоэлектронная спектроскопия серы 2p исследование взаимодействия органических тиоловых и дисульфидных связывающих взаимодействий с поверхностями золота. Langmuir 12 , 5083 (1996).
CAS Статья Google Scholar
- 51
Понг, Б.-К., Ли, Дж.-Й. и Траут, Б.Л. Вычислительное исследование первых принципов для понимания взаимодействий между оцДНК и наночастицами золота: адсорбция метиламина на поверхностях наночастиц золота.
 Ленгмюр 21 , 11599 (2005).
Ленгмюр 21 , 11599 (2005).CAS PubMed Статья Google Scholar
- 52
Феличе Р. Д. и Селлони А. Вычислительное исследование первых принципов для понимания взаимодействий между оцДНК и наночастицами золота: адсорбция метиламина на поверхностях наночастиц золота. J. Chem. Phys. 120 , 4906–4914 (2004).
PubMed Статья CAS Google Scholar
- 53
Исии, Т., Otsuka, H., Kataoka, K. & Nagasaki, Y. Получение функционально ПЭГилированных наночастиц золота с узким распределением за счет самовосстановления аурического катиона -биотинил-ПЭГ-блоком — [поли (2- (N, N- диметиламино) этилметакрилат)]. Langmuir 20 , 561–564 (2004).
CAS PubMed Статья Google Scholar
- 54
Фурушо, Х., Китано, К., Хамагучи, С. и Нагасаки, Ю. Получение стабильных вододисперсных пегилированных наночастиц золота с помощью струй неравновесной плазмы атмосферного давления.
 Chem. Матер. 21 , 3526–3535 (2009).
Chem. Матер. 21 , 3526–3535 (2009).CAS Статья Google Scholar
- 55
Нагасаки, Ю., Кобаяши, Х., Кацуяма, Ю., Джомура, Т. и Сакура, Т. Усиление иммобилизации поверхности антитела / смешанного ПЭГ в конструкции высокоэффективной иммуномагнитной системы ELISA. J. Colloid Interface Sci. 309 , 524–530 (2007).
CAS PubMed Статья Google Scholar
- 56
Сяофэй, Ю., Yoshimoto, K. & Nagasaki, Y. Высокоэффективный иммунолатекс, обладающий поверхностью, коиммобилизованной смешанным пегом / антителом: высокочувствительная иммунодиагностика ферритина. Анал. Chem. 81 , 1549–1556 (2009).
Артикул CAS Google Scholar
- 57
Soukka, T., Paukkunen, J., Harma, H., Lonnberg, S., Lindroos, H. & Lovgren, T. Сверхчувствительный иммунофлуорометрический анализ с временным разрешением свободного простатспецифического антигена с использованием технологии метки наночастиц .
 Clin. Chem. 47 , 1269 (2001).
Clin. Chem. 47 , 1269 (2001).CAS PubMed Google Scholar
- 58
Лангер, Р. и Тиррелл, Д. А. Разработка материалов для биологии и медицины. Природа 428 , 487–492 (2004).
CAS PubMed PubMed Central Статья Google Scholar
- 59
Купер М. и Синглтон В. Т. Обзор литературы по биосенсорам для кварцевых микровесов с 2001 по 2005 годы: приложения акустической физики к анализу биомолекулярных взаимодействий. J. Mol. Признать. 20 , 154–184 (2007).
CAS PubMed Статья Google Scholar
- 60
Белослудцев, Ю., Иверсон, Б., Лемешко, С., Эггерс, Р., Визе, Р., Ли, С., Паудрил, Т., Хоган, М. ДНК-микрочипы на основе нековалентного олигонуклеотида прикрепление и гибридизация в двух измерениях. Анал. Биохим. 292 , 250–256 (2001).

CAS PubMed Статья Google Scholar
- 61
Петровых, Д.Ю., Кимура-Суда, Х., Тарлов, М. Дж. И Уитмен, Л. Дж. Количественная характеристика пленок ДНК с помощью рентгеновской фотоэлектронной спектроскопии. Langmuir 20 , 429–440 (2004).
CAS PubMed Статья Google Scholar
- 62
Höök, F., Ray, A., Nordén, B. & Kasemo, B. Характеристика ПНК и иммобилизации ДНК и последующей гибридизации с ДНК с использованием измерений затухания акустической поперечной волны. Langmuir 17 , 8305–8312 (2001).
Артикул CAS Google Scholar
- 63
Лав, Дж. К., Эстрофф, Л. А., Крибель, Дж. К., Нуццо, Р. Г. и Уайтсайдс, Г. М. Самосборные монослои тиолатов на металлах как форма нанотехнологии. Chem. Ред. 105 , 1103–1169 (2005).
CAS Статья PubMed PubMed Central Google Scholar
- 64
Ульман, А.
 Формирование и структура самоорганизующихся монослоев. Chem. Ред. 96 , 1533–1554 (1996).
Формирование и структура самоорганизующихся монослоев. Chem. Ред. 96 , 1533–1554 (1996).CAS PubMed Статья PubMed Central Google Scholar
- 65
Прайм, К. Л. и Уайтсайдс, Г. М. Самособирающиеся органические монослои: модельные системы для изучения адсорбции белков на поверхностях. Наука 252 , 1164–1167 (1991).
CAS PubMed Статья PubMed Central Google Scholar
- 66
Гонг, П., Ли, С.-Й., Гэмбл, Л.Дж., Кастнер, Д.Г. и Грейнджер, Д.В. Поведение гибридизации смешанных монослоев ДНК / алкилтиол на золоте: характеристика с помощью поверхностного плазмонного резонанса и радиометрического анализа 32p. Анал. Chem. 78 , 3326–3334 (2006).
CAS PubMed PubMed Central Статья Google Scholar
- 67
Ли, К.-Й., Гонг, П., Харберс, Г.
 М., Грейнджер, Д. В., Кастнер, Д. Г. и Гэмбл, Л.J. Покрытие поверхности и структура смешанных монослоев ДНК / алкилтиола на золоте: характеристика с помощью XPS, NEXAFS и измерений интенсивности флуоресценции. Анал. Chem. 78 , 3316–3325 (2006).
М., Грейнджер, Д. В., Кастнер, Д. Г. и Гэмбл, Л.J. Покрытие поверхности и структура смешанных монослоев ДНК / алкилтиола на золоте: характеристика с помощью XPS, NEXAFS и измерений интенсивности флуоресценции. Анал. Chem. 78 , 3316–3325 (2006).CAS PubMed Статья Google Scholar
- 68
Левицки Р., Херн Т. М., Тарлов М. Дж. И Сатия С. К. Использование самосборки для управления структурой монослоев ДНК на золоте: исследование отражательной способности нейтронов. J. Am. Chem. Soc. 120 , 9787–9792 (1998).
CAS Статья Google Scholar
- 69
Бузер, К., Чен, С. и Цзян, С. Контроль ориентации ДНК на смешанных оцДНК / OEG SAM. Langmuir 22 , 4694–4698 (2006).
CAS PubMed Статья Google Scholar
- 70
Херн, Т. М., Тарлов, М. Дж. Дж.Характеристика ДНК-зондов, иммобилизованных на золотых поверхностях. г. Chem. Soc. 119 , 8916–8920 (1997).
CAS Статья Google Scholar
- 71
Петерлинц, К. А., Георгиадис, Р. М., Херн, Т. М. и Тарлов, М. Дж. Наблюдение за гибридизацией и дегибридизацией ДНК, связанной с тиолами, с использованием двухцветной спектроскопии поверхностного плазмонного резонанса. J. Am. Chem. Soc. 119 , 3401–3402 (1997).
CAS Статья Google Scholar
- 72
Нагасаки Ю. Бионаночастицы, стабилизированные полиэтиленгликолем-b-полиамином, для нанодиагностики и нанотерапии. Chem. Lett. 37 , 564–569 (2008).
CAS Статья Google Scholar
- 73
Йошимото, К., Мацумото, С., Асакава, Р., Утида, К. и Нагасаки, Ю. Поведение ДНК при иммобилизации и гибридизации на поли (этиленгликоль) -блок-поли [2- (N , N-диметиламино) этилметакрилат] -модифицированные поверхности золота. Chem. Lett. 36 , 1444–1445 (2007).
CAS Статья Google Scholar
- 74
Оиси, М., Накаогами, Дж., Исии, Т. и Нагасаки, Ю. Смарт-ПЭГилированные наночастицы золота для цитоплазматической доставки миРНК, чтобы вызвать усиленное молчание генов. Chem. Lett. 35 , 1046–1047 (2006).
CAS Статья Google Scholar
- 75
Сяофэй, Ю., Fabregat, D., Yoshimoto, K. & Nagasaki, Y. Эффективное ингибирование межфазного неспецифического взаимодействия для создания практически применимого иммунолатекса с высоким ферритиновым ответом. Анал. Chem. 81 , 10097–10105 (2009).
Артикул CAS Google Scholar
- 76
Kubota, M., Yoshimoto, K., Xiaofei, Y. & Nagasaki, Y. Повышение термостабильности стрептавидина, иммобилизованного на магнитных шариках, путем создания слоя из смешанного полиэтиленгликоля с привязанными цепями. . Polymer J. 43 , 493–496 (2011).
CAS Статья Google Scholar
- 77
Саката, Т., Маруяма, С., Уеда, А., Оцука, Х. и Мияхара, Ю. Стабильная иммобилизация олигонуклеотидного зонда на золотом субстрате с использованием триподных тиоловых производных. Langmuir 23 , 2269–2272 (2007).
CAS PubMed Статья Google Scholar
- 78
Берингер, Дж.П., Терреттаз, С., Мишель, Р., Тирелли, Н., Фогель, Х., Текстор, М., Хаббелл, Дж. А. Хемосорбированные сополимеры на основе полипропиленсульфида сопротивляются биомолекулярным взаимодействиям. Нат. Матер. 2 , 259–264 (2003).
CAS PubMed Статья Google Scholar
- 79
Feller, LM, Cerritelli, S., Textor, M., Hubbell, JA & Tosatti, SGP Влияние архитектуры ди- и триблочного сополимера полипропиленсульфида и блок-этиленгликоля на образование молекулярных адслоев на поверхности золота и их влияние на устойчивость к белкам: кандидат на модификацию поверхности в биосенсорных исследованиях. Макромолекулы 38 , 10503–10510 (2005).
CAS Статья Google Scholar
- 80
Ёсимото, К., Нозава, М., Мацумото, С., Этиго, Т., Немото, С., Хатта, Т., Нагасаки, Ю. Исследования адсорбционных свойств и структуры полиаминовой группы производные поли (этиленгликоля) на поверхности золота методами поверхностного плазмонного резонанса и рентгеновской фотоэлектронной спектроскопии с угловым разрешением. Langmuir 25 , 12243–12249 (2009).
CAS PubMed Статья Google Scholar
- 81
Конради, Р., Пидхатика, Б., Мхлебах, А. и Текстор, М. Поли-2-метил-2-оксазолин: пептидоподобный полимер для белковотталкивающих поверхностей. Langmuir 24 , 613–616 (2008).
CAS PubMed Статья Google Scholar
- 82
Ли, С. и Спенсер, Н.Д. Адсорбционные свойства поли (L-лизин)-трансплант-поли (этиленгликоль) (PLL-g-PEG) на гидрофобной поверхности раздела: влияние трибологического стресса, pH, соли концентрация и молекулярная масса полимера. Langmuir 24 , 9479–9488 (2008).
CAS PubMed Статья Google Scholar
- 83
Нагасаки Ю., Ясуги К., Курокава К. и Иидзима М. Термо- и дисперсионно-стабильная липаза, установленная коллоидом золота: пегилирование коллоида золота с установленным ферментом. Colloid Polymer Sci. 285 , 563–567 (2007).
CAS Статья Google Scholar
- 84
Сяофэй, Ю., Иидзима, М., Оиши, М. и Нагасаки, Ю. Анализ структуры и активности нанозимов, полученных совместной иммобилизацией практически полезных ферментов и гидрофильных блок-сополимеров на наночастицах золота. Langmuir 24 , 6903–6909 (2008).
Артикул CAS Google Scholar
- 85
Йошимото, К., Хирасе, Т., Немото, С., Хатта, Т. и Нагасаки, Ю. Простое построение слоя с концевыми сульфанилами, нанесенного щеткой из полиэтиленгликоля, на поверхности золота для иммобилизации белков. за счет комбинированного использования телехелических и полутелехелических полиэтиленгликолей с концевыми сульфанилами. Langmuir 24 , 9623–9629 (2008).
CAS PubMed PubMed Central Статья Google Scholar
Этиленгликоль | Подкаст | Chemistry World
Мира Сентилингам
На этой неделе мы сразимся со снегом — все благодаря этому комплексу. Вот Филлип Бродвит:
Филип Бродвит
Молекула, которая будет хорошо знакома каждому, кто пытался соскрести толстый слой льда с лобового стекла автомобиля, — это этиленгликоль — основной ингредиент антифризов и спреев для защиты от обледенения.
Распыление раствора этой простой молекулы на ледяную поверхность может растопить лед и позволить вам продолжить путешествие. А смешивание его с водой в форсунках омывателя лобового стекла предотвращает его замерзание — так что лобовое стекло будет таким же чистым, как если бы вы отправились в путь.
а как это работает? Этиленгликоль или 1,2-этандиол [NB. Это ошибка звуковой дорожки], чтобы дать ей более систематическое название — это можно сделать, потому что она структурно очень похожа на воду.Он состоит из двух связанных атомов углерода, каждый из которых несет гидроксильную или ОН-группу. Из-за этих гидроксильных групп он может образовывать водородные связи между молекулами так же, как это делает вода. Это делает его смешиваемым с водой во всех пропорциях.
Температура замерзания чистой воды, как мы все знаем, составляет 0 ° C. А температура замерзания чистого этиленгликоля составляет -12 ° C. Но когда они смешиваются вместе, они мешают попыткам друг друга организовать упорядоченные твердые структуры. На самом деле это довольно общее явление — растворение растворенного вещества обычно снижает точку замерзания растворителя, и это точно так же, как рассыпание соли на поверхности дороги предотвращает их обледенение.
Так почему бы нам просто не использовать соль для удаления льда с наших машин? Что ж, соль может снизить температуру замерзания воды примерно до -10 ° C, чего может быть недостаточно в разгар зимы, чтобы фактически растопить лед. С другой стороны, 70-процентный этиленгликоль в воде не замерзнет до температуры около -50 ° C. Соль также вызывает коррозию металлических деталей автомобилей, в отличие от этиленгликоля.
Однако у популярности этиленгликоля в качестве антифриза есть обратная сторона, а именно его токсичность.Чистый этиленгликоль на вкус и запах довольно сладкий, а это означает, что домашние животные, такие как кошки или собаки, довольно часто слизывают пролитую жидкость и сильно заболевают. По этой причине большинство коммерческих антифризов теперь содержат очень горькие добавки, которые удерживают людей и животных от их употребления.
Эта сладость также является корнем распространенного заблуждения о том, что недобросовестные виноделы добавляют антифриз в вино, чтобы сделать его слаще. Фактически, эти злодеи с большей вероятностью добавят диэтиленгликоль — две молекулы этиленгликоля, соединенные эфирной (или C-O-C) связью, — который сохраняет сладость, но гораздо менее токсичен.
Если вам или вашему питомцу не повезло, что вы случайно выпили антифриз, важно как можно скорее обратиться за медицинской помощью. Из-за того, что по структуре он похож на этанол (или алкоголь), он сначала очень быстро вызывает сильное опьянение, но также вызывает тошноту и вероятность того, что вы заболеете. Когда организм пытается метаболизировать токсин, его гидроксильные группы окисляются до карбоновых кислот. Это распространяется на нервную систему и может вызвать учащенное сердцебиение, высокое кровяное давление и даже сердечную недостаточность.Примерно через 24 часа почки начнут отказывать под воздействием нагрузки.
К счастью, лечение отравления этиленгликолем относительно несложно, если его обнаружить на ранней стадии. Фермент, который отвечает за превращение этиленгликоля в его токсичные метабилиты, тот же, что метаболизирует алкоголь, но его сродство к алкоголю в 100 раз выше. Следовательно, большая доза алкоголя — обычно вводимая внутривенно, а не в виде хорошей порции виски — может насытить фермент, не давая ему превратить гликоль в более токсичные соединения.Это может остановить отравление, но я предполагаю, что на следующее утро ты станешь матерью всех похмелья.
Но антифриз составляет лишь небольшой процент из 20 миллионов или около того тонн этиленгликоля, производимого ежегодно. Подавляющее большинство этого простого диола используется для изготовления полиэфирных пластиков, особенно полиэтилентерефталата или ПЭТ — прозрачного, блестящего и легко обрабатываемого пластика, из которого производятся бутылки для напитков и волокна для одежды и текстиля.
Так что в следующий раз, когда вы будете тепло укутываться в ворсистый джемпер из полиэфирных волокон, чтобы сбрызнуть и соскрести лед с лобового стекла вашего автомобиля, подумайте о маленькой молекуле, которая делает все это возможным.
Мира Сентилингам
Действительно, маленькая молекула, которая делает вещи более терпимыми зимой. Это был Филипп Бродвит из Chemistry World, обладающий сладкой, но токсичной химией этиленгликоля. Теперь, на следующей неделе, новый год будет удачным.
Брайан Клегг
Трииодид азота является взрывчатым веществом, чувствительным к прикосновениям. Легчайшее давление — и он исчезает. В чем-то большем, чем щепотка, это опасное вещество, но при тонком покрытии оно вызывает забавные трещины и взрывы.
Это было чудо-субстанцией для типичного подростка. Очень тонкий слой плитки на полу создавал очень приятную ловушку в комнате, которую нельзя было пересечь без танца шока, когда пол взорвался серией мелких взрывов.Мира Сентилингам
А чтобы узнать больше о взрывоопасной химии трииодида азота, присоединяйтесь к Брайану Клеггу на следующей неделе в программе Chemistry in its element. А пока спасибо за внимание. Я Мира Сентилингам.
Токсичность этиленгликоля и пропиленгликоля: что такое пропиленгликоль | ATSDR — Экологическая медицина и санитарное просвещение в области окружающей среды
Цели обучения
По завершении этого раздела вы сможете:
- описывает свойства и применение пропиленгликоля
Введение
В отличие от этиленгликоля, мощной причины острой токсичности у людей, пропиленгликоль является «общепризнанной безопасной» (GRAS) добавкой для пищевых продуктов и лекарств.Пропиленгликоль редко вызывает токсические эффекты, и то только при очень необычных обстоятельствах.
Использует
Пропиленгликоль — это общепризнанная безопасная пищевая добавка (GRAS), которая широко используется в
- пищевые и табачные изделия,
- фармацевтических препаратов и
- косметика.
В некоторых лекарствах, косметике и пищевых продуктах пропиленгликоль действует как
- эмульгатор,
- промышленный осушитель, Поверхностно-активное вещество
- и Растворитель
- .
Концентрации в продуктах питания
Концентрации в пищевых продуктах варьируются от <0,001% в яйцах и супах до примерно 15% в некоторых приправах и ароматизаторах. Пропиленгликоль - это одобренная FDA добавка к диетическим пайкам военнослужащих (Агентство по токсическим веществам и реестру заболеваний, 1997 г.).
Использование в текстиле
Наибольшее количество пропиленгликоля используется в текстильной промышленности, где он является промежуточным звеном при производстве полиэфирного волокна.
Синонимы
Синонимы пропиленгликоля включают
- 1,2-пропандиол,
- 1,2-дигидроксипропан,
- метилгликоль и
- триметилгликоль (Агентство регистрации токсичных веществ и заболеваний, 1997 г.).
Особое применение
Пропиленгликоль в виде аэрозоля может дать густой «дым» без пламени. Используется
- военными как дымовая завеса, чтобы скрыть движение войск на поле боя и
- как имитатор дыма в различных видах огневой подготовки и театральных постановках
Обледенение
- Пропиленгликоль иногда используется в качестве антиобледенителя; однако этиленгликоль используется чаще, потому что он дешевле.
Источники воздействия
У населения в целом воздействие пропиленгликоля происходит в основном при приеме пищи и лекарств, а также через кожный контакт с косметикой или лекарствами местного действия. Пропиленгликоль используется в качестве растворителя в косметике и фармацевтике в различных форматах
Например, он составляет 40% внутривенного фенитоина (дилантина) и других инъекционных препаратов (Meditext 2004).
При нормальном использовании этих продуктов не ожидается вредного воздействия на здоровье.Однако интенсивное употребление инъекционных препаратов с пропиленгликолем (Louis, Kutt et al. 1967; Seay, Graves et al. 1997; Yorgin, Theodorou et al. 1997; Wilson, Reardon et al. 2000) ) или длительное и обширное местное нанесение на поврежденную кожу, такую как ожоги (Peleg, Bar-Oz et al. 1998), вызывало повышенный уровень пропиленгликоля в организме.
Кто в опасности?
О токсичности пропиленгликоля сообщалось редко и при необычных обстоятельствах.Например, токсичность может быть вызвана
- чрезмерно большие или быстро вводимые внутривенные инъекции пропиленгликольсодержащих препаратов, чрезмерно большие или быстро вводимые внутривенные инъекции пропиленгликольсодержащих препаратов (Louis, Kutt et al. 1967; Seay, Graves et al. 1997; Йоргин, Теодору и др. 1997; Уилсон, Рирдон и др. 2000)
- Длительный контакт с кожей во время лечения ожогов
В группу особого риска входят
- новорожденных
- младенцы
- пожилых людей (Мартин и Финберг 1970; Макдональд, Гетсон и др. 1987; Гловер и Рид 1996; Пелег, Бар-Оз и др. 1998).
Повышенная чувствительность (Reprotext 2004) может наблюдаться у людей с уже существующим
- кожные заболевания
- Заболевания глаз
- (возможно) аллергические состояния
Биологическая судьба
Абсорбция пропиленгликоля из желудочно-кишечного тракта происходит быстро: максимальные концентрации в плазме крови человека достигаются в течение 1 часа после приема внутрь.
МетаболитыПропиленгликоль метаболизируется в печени алкогольдегидрогеназой до
- молочная кислота, а затем
- пировиноградная кислота
Оба этих метаболита являются нормальными составляющими цикла лимонной кислоты и далее метаболизируются до
Около 45% абсорбированной дозы пропиленгликоля выводится почками в неизмененном виде или в виде глюкуронидного конъюгата.
Период полураспадаПериод полувыведения пропиленгликоля составляет около 4 часов.
Физиологические эффекты
Местное нанесение на поврежденную кожу (как компонент кремов от ожогов) или внутривенное введение (в качестве вспомогательного вещества в некоторых противосудорожных, антиангинальных, антибиотических или других лекарствах) иногда ассоциировалось с
- Гиперосмоляльность,
- лактоацидоз,
- внутрисосудистый гемолиз,
- осложнения депрессии ЦНС,
- изъятий,
- кома,
- гипогликемия и
- Почечная недостаточность
Воздействие на центральную нервную систему
Угнетение ЦНС — первичное проявление острого отравления пропиленгликолем.
Метаболические эффекты
Метаболический ацидоз Метаболическое превращение пропиленгликоля в молочную и пировиноградную кислоты может способствовать метаболическому ацидозу и аномальной анионной щели.
ГиперосмоляльностьНеизмененный пропиленгликоль, циркулирующий в организме, вызывает гиперосмоляльность.
Примеры отравления пропиленгликолем
Хотя пропиленгликоль нетоксичен при нормальных условиях, он может вызвать отравление в редких и необычных обстоятельствах.
В одном случае 8-месячного младенца с ожогами второй и третьей степени большой площади поверхности лечили в течение многих дней местным сульфадиазином серебра, содержащим большое количество пропиленгликоля. У ребенка развился острый метаболический ацидоз и остановка сердца и дыхания. Суточная доза пропиленгликоля составляла 9000 мг / кг. Уровни пропиленгликоля в сыворотке были самыми высокими на 14-й день (1059 мг / дл), когда осмолярный промежуток составлял 75 мОсм / л (нормальный: <10 мОсм / л) (Fligner, Jack et al. 1985).
Фенитоин и пропиленгликоль
Пропиленгликоль — распространенный разбавитель для инъекционных препаратов. Он составляет 40% внутривенной формы фенитоина. Такая высокая концентрация необходима для
- поддерживают кристаллы фенитоина в стабильном препарате и
- предотвращает их преципитацию
Сообщалось, что у некоторых пациентов, получавших фенитоин внутривенно, пропиленгликоль вызывает
- гипотония,
- нарушения сердечной проводимости и
- Нарушения ритма сердца
Сообщалось также о смертельных случаях остановки сердца и дыхания, но эти эффекты могли быть вызваны кардиоактивным фенитоином.(Донован и Клайн, 1991).
Отсутствие почечного эффекта
Пропиленгликоль не связан с нефротоксичностью, вызываемой оксалатом кальция у людей. В отличие от этиленгликоля, пропиленгликоль не метаболизируется до щавелевой кислоты, поэтому оксалат кальция не откладывается в почках (Агентство по токсическим веществам и реестру заболеваний, 1997).
Контактный дерматит
Пропиленгликоль может быть сенсибилизатором кожи, что приводит к аллергическому контактному дерматиту у некоторых людей (Reprotext 2004).
Сравнение с этиленгликолем
При сравнении токсичности этиленгликоля и пропиленгликоля LaKind et al. (1999) заявил, что «С точки зрения летальности, острых эффектов, репродуктивной токсичности, токсичности для развития и почек, токсичность этиленгликоля превышает токсичность пропиленгликоля (LaKind, McKenna et al. 1999). Кроме того, локализованные кожные эффекты этиленгликоля и пропиленгликоля незначительны, и данные свидетельствуют о том, что пропиленгликоль может иметь потенциал сенсибилизации при контакте с кожей.Наконец, воздействие пропиленгликоля на лабораторных животных было связано с обратимыми гематологическими изменениями; не было обнаружено данных по этиленгликолю, на основе которых можно было бы провести токсикологическое сравнение ».
Клиническая презентация
Хотя токсичность пропиленгликоля низкая, при абсорбции чрезмерно больших количеств могут наблюдаться следующие последствия для здоровья
- повышенный осмолярный зазор,
- тяжелый метаболический ацидоз (вызванный метаболизмом пропиленгликоля до молочной кислоты) и
- кома, судороги и гипогликемия (редко у пациентов, принимавших большое количество пропиленгликоля в течение нескольких дней).
Лечение
Метаболический ацидоз, вызванный большим количеством пропиленгликоля в инъекционных препаратах, следует лечить бикарбонатом натрия. В тяжелых случаях гемодиализ эффективен для коррекции гиперосмоляльности путем удаления пропиленгликоля из крови (Demey, Daelemans et al. 1988; Parker, Fraser et al. 2002). Терапия этанолом, описанная для пациентов, отравленных этиленгликолем, не нужна пациентам, страдающим отравлением пропиленгликолем.
Стандарты и правила
Для пропиленгликоля не существует стандартов рабочего места или экологических стандартов. FDA считает, что среднесуточное потребление с пищей 23 мг / кг веса тела является безопасным для людей в возрасте от 2 до 65 лет (Agency for Toxic Substances and Disease Registry 1997).
Ключевые точки
- Пропиленгликоль используется в различных пищевых, косметических и фармацевтических продуктах.
- Токсичность пропиленгликоля не ожидается при нормальном воздействии на окружающую среду или на рабочем месте.
- Токсичность пропиленгликоля метаболизируется до соединений, которые являются нормальными составляющими цикла лимонной кислоты.
- Большие дозы и необычные обстоятельства необходимы для развития токсичности пропиленгликоля.
- Отравление пропиленгликолем сначала характеризуется угнетением ЦНС и повышенным осмоляльным зазором, а затем увеличенным анионным зазором.
- В отличие от этиленгликоля, пропиленгликоль не вызывает нефротоксичности у человека.
- Лечение отравления пропиленгликолем — поддерживающее. Это может включать коррекцию метаболического ацидоза с помощью терапии бикарбонатом натрия и, в тяжелых случаях, гемодиализа.
Проверка выполнения
(PDF) Взаимодействие поли (этиленгликоля) с белками
618 European Powder Diffraction Conference, EPDIC 9
Координационное встраивание катиона, захваченного из раствора, с образованием преимущественно гидрофобных контактов внешнего катиона комплексного катиона. конверт с поверхностью белка (рис.3-4).
Таким образом, типичные способы взаимодействия полиэтиленгликоля с поверхностью белка
можно разделить на четыре группы:
• множественные координационные контакты с положительно заряженными остатками лизина, аргинина и гистидина
dues
• водородные связи с боковыми цепями аминокислотных остатков,
• водородные связи с NH-группами основной цепи,
• координационное встраивание катиона из раствора и образование гидрофобных контактов
внешней оболочки сложного катиона с преимущественно гидрофобными участками при поверхность pro
tein.
Молекула поли (этиленгликоля) очень гибкая и обладает множеством взаимодействий с
белками. Его гибкость в подгонке поверхности белка, включая склонность к проникновению во внутри- и межмолекулярные щели
, и его способность временно изменять соответствующие части поверхности белка
, делают его универсальным агентом для кристаллизации белка.

 Е. Рудзитис. Химия – 10. М., 1998 г.
Е. Рудзитис. Химия – 10. М., 1998 г. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором. Природа. 2003. 425: 27–28. pmid: 12955122
Природа. 2003. 425: 27–28. pmid: 12955122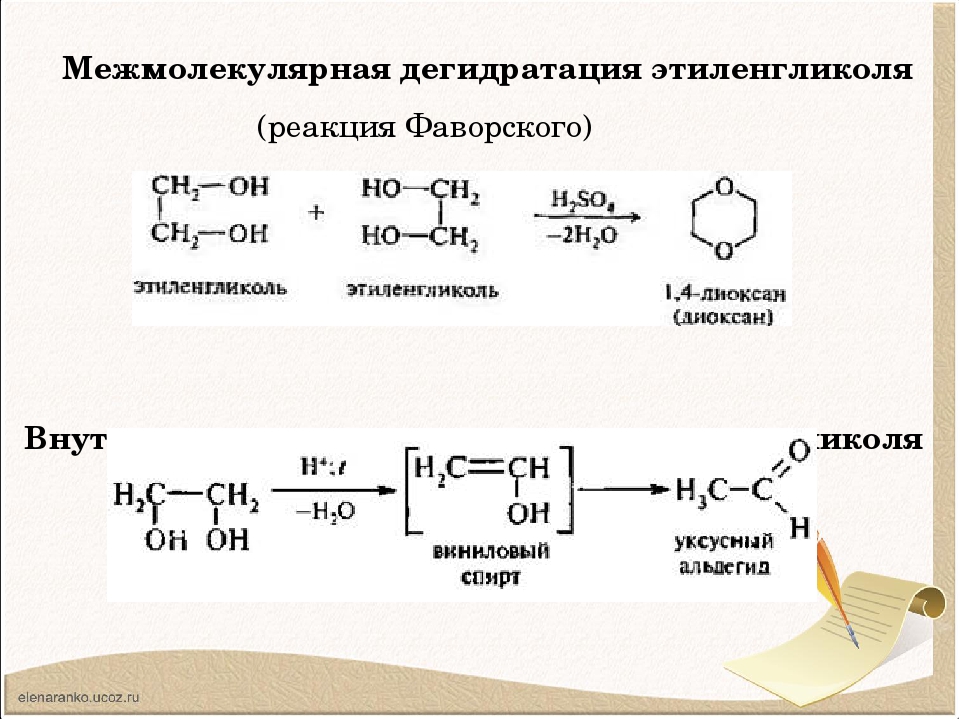 Корнберг А. Десять заповедей: Уроки энзимологии репликации ДНК. Журнал бактериологии. 2000. С. 3613–3618. pmid: 10850972
Корнберг А. Десять заповедей: Уроки энзимологии репликации ДНК. Журнал бактериологии. 2000. С. 3613–3618. pmid: 10850972 Curr Opin Struct Biol. Elsevier Current Trends; 2010. 20: 196–206. pmid: 20167475
Curr Opin Struct Biol. Elsevier Current Trends; 2010. 20: 196–206. pmid: 20167475 Арчелла А., Портелла Дж., Коллепардо-Гевара Р., Чакраборти Д., Уэльс Д. Д., Ороско М. Структура и свойства ДНК в аполярных растворителях. J. Phys Chem B. Американское химическое общество; 2014; 118: 8540–8548.pmid: 24968001
Арчелла А., Портелла Дж., Коллепардо-Гевара Р., Чакраборти Д., Уэльс Д. Д., Ороско М. Структура и свойства ДНК в аполярных растворителях. J. Phys Chem B. Американское химическое общество; 2014; 118: 8540–8548.pmid: 24968001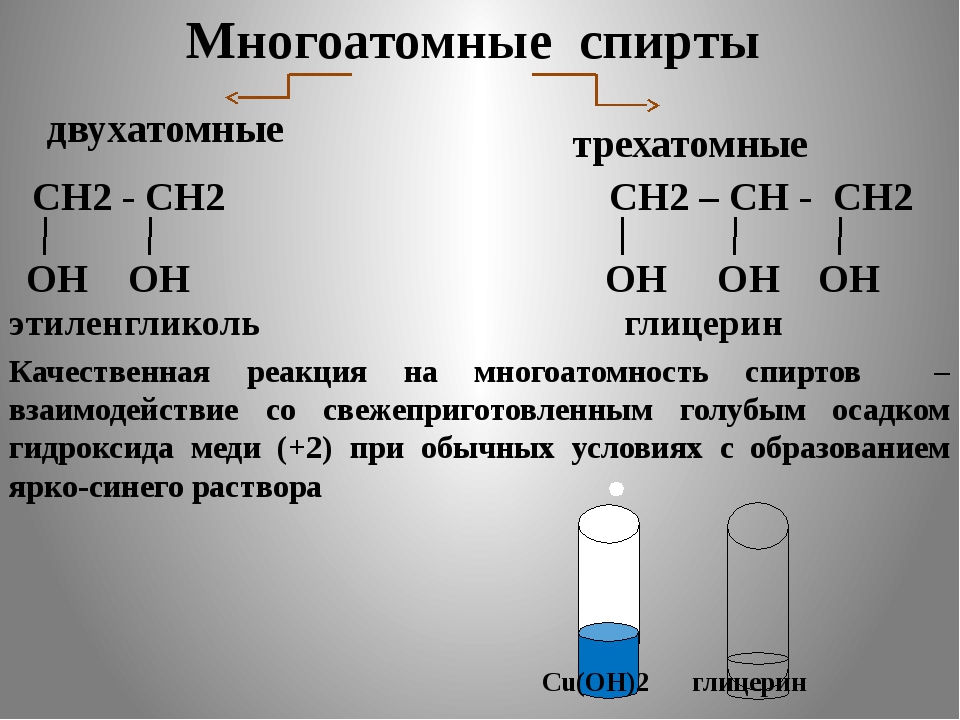 Может ли денатурант стабилизировать ДНК? Пиридин обращает денатурацию ДНК в кислый pH. Angew Chemie Int Ed. Вили-Блэквелл; 2015; 54: 10488–10491. pmid: 26224143
Может ли денатурант стабилизировать ДНК? Пиридин обращает денатурацию ДНК в кислый pH. Angew Chemie Int Ed. Вили-Блэквелл; 2015; 54: 10488–10491. pmid: 26224143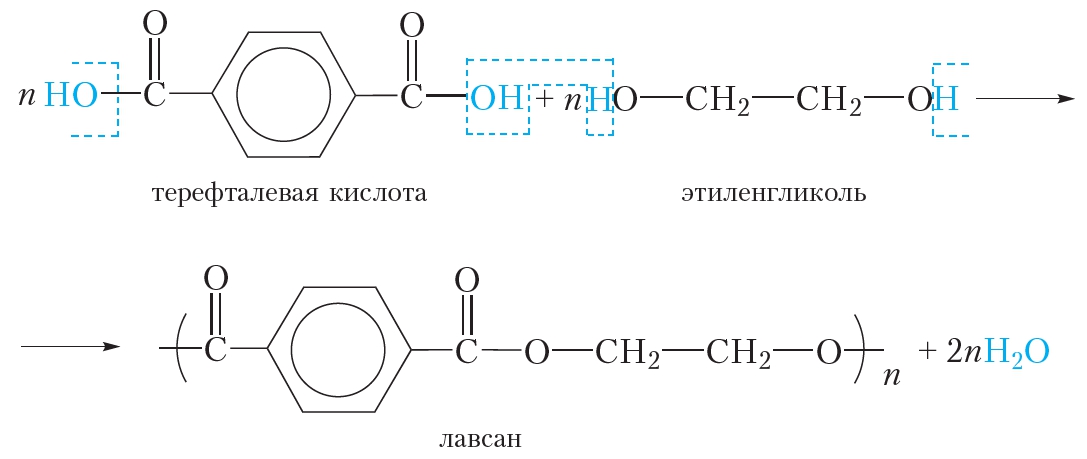 2009. 38: 172–181. pmid: 19854935
2009. 38: 172–181. pmid: 19854935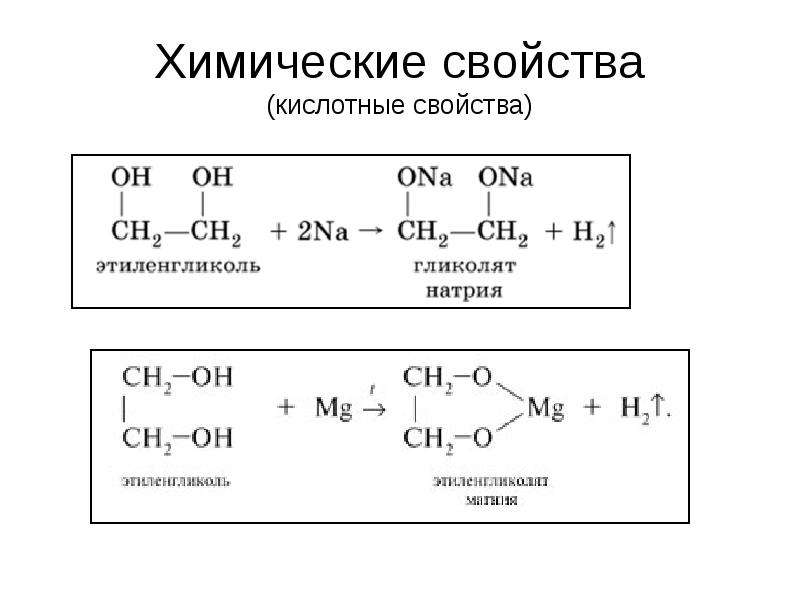 Nguyen CN, Kurtzman Young T., Gilson MK.Теория сеточной неоднородной сольватации: структура гидратации и термодинамика миниатюрного рецептора кукурбита [7] урила. J Chem Phys. 2012; 137: 044101. pmid: 22852591
Nguyen CN, Kurtzman Young T., Gilson MK.Теория сеточной неоднородной сольватации: структура гидратации и термодинамика миниатюрного рецептора кукурбита [7] урила. J Chem Phys. 2012; 137: 044101. pmid: 22852591 Дело Том Дарден Томас Э. Читхэм III Карлос Симмерлинг Адриан Ройтберг Джунмей Ван Д.А., Гётц SDSC AW, Иштван Колоссвари Будапешт U, Шоу Франческо Паесани Цзянь Лю Сюнгу Ву Томас Штайнбрехер Д.Справочное руководство Amber 14. https://www.researchgate.net/profile/Tai-Sung_Lee/publication/270588529_Amber_2014/links/5501add20cf2d60c0e5fd2b6/Amber-2014.pdf
Дело Том Дарден Томас Э. Читхэм III Карлос Симмерлинг Адриан Ройтберг Джунмей Ван Д.А., Гётц SDSC AW, Иштван Колоссвари Будапешт U, Шоу Франческо Паесани Цзянь Лю Сюнгу Ву Томас Штайнбрехер Д.Справочное руководство Amber 14. https://www.researchgate.net/profile/Tai-Sung_Lee/publication/270588529_Amber_2014/links/5501add20cf2d60c0e5fd2b6/Amber-2014.pdf , Савино С., Лелонг Р., Гривель Н. и др. Красный. инструменты: достижения в области расчета зарядов RESP и ESP и создания библиотеки силовых полей. Phys Chem Chem Phys. 2010; 12: 7821. pmid: 20574571
, Савино С., Лелонг Р., Гривель Н. и др. Красный. инструменты: достижения в области расчета зарядов RESP и ESP и создания библиотеки силовых полей. Phys Chem Chem Phys. 2010; 12: 7821. pmid: 20574571 Е. Определение параметров щелочных и галогенидных одновалентных ионов для использования в симуляциях биомолекул с явной сольватом. J. Phys Chem B. Американское химическое общество; 2008; 112: 9020–9041. pmid: 185
Е. Определение параметров щелочных и галогенидных одновалентных ионов для использования в симуляциях биомолекул с явной сольватом. J. Phys Chem B. Американское химическое общество; 2008; 112: 9020–9041. pmid: 185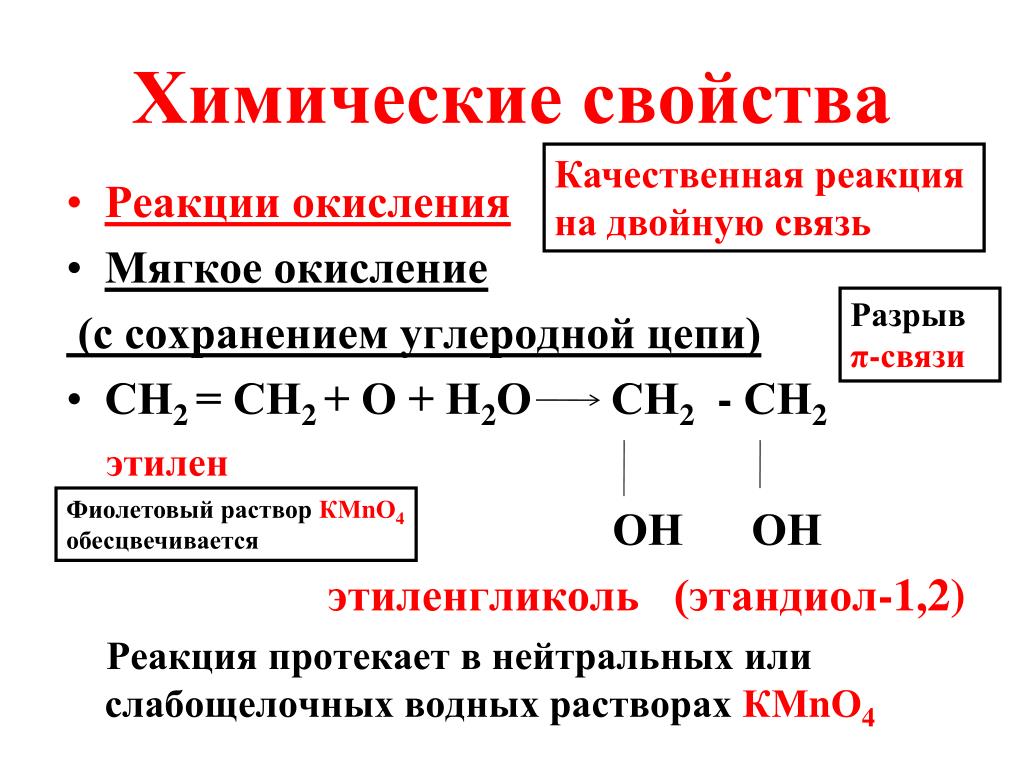 Уточнение работы Cornell et al. Силовое поле нуклеиновых кислот на основе справочных квантово-химических расчетов гликозидных торсионных профилей. J Chem Theory Comput. 2011; 7: 2886–2902. pmid: 21
Уточнение работы Cornell et al. Силовое поле нуклеиновых кислот на основе справочных квантово-химических расчетов гликозидных торсионных профилей. J Chem Theory Comput. 2011; 7: 2886–2902. pmid: 21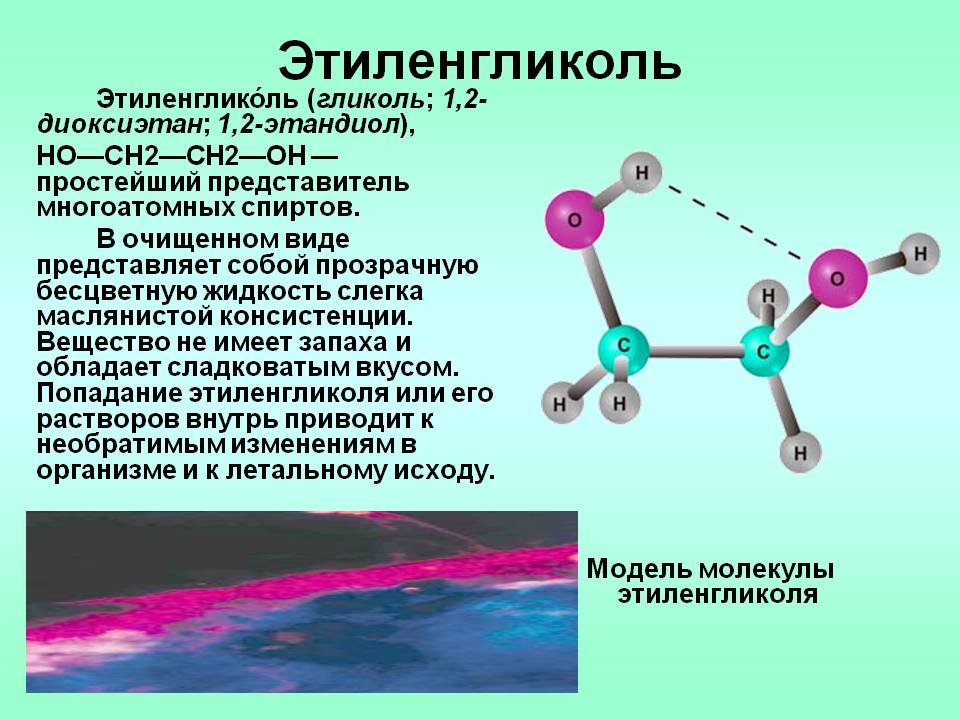 Ивани I, Данс П.Д., Ной А., Перес А., Фаустино I, больница А и др. Parmbsc1: усовершенствованное силовое поле для моделирования ДНК.Нат методы. Издательская группа «Природа»; 2016; 13: 55–58. pmid: 26569599
Ивани I, Данс П.Д., Ной А., Перес А., Фаустино I, больница А и др. Parmbsc1: усовершенствованное силовое поле для моделирования ДНК.Нат методы. Издательская группа «Природа»; 2016; 13: 55–58. pmid: 26569599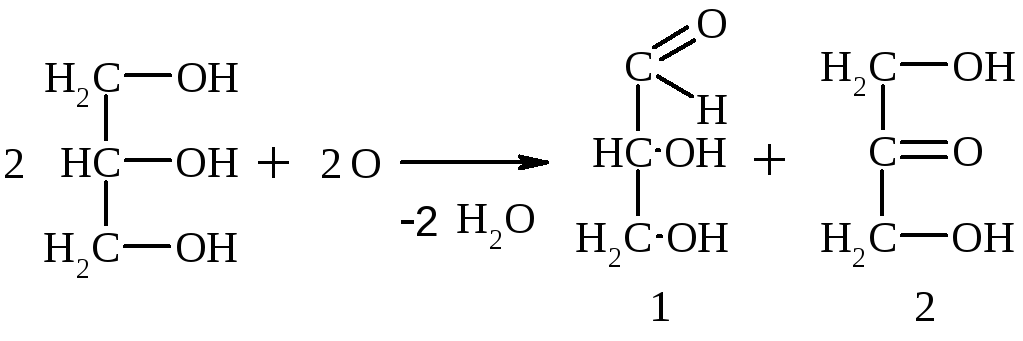 pmid: 12
pmid: 12 Nucleic Acids Res. Издательство Оксфордского университета; 2014; 42: 11304–11320. pmid: 25223784
Nucleic Acids Res. Издательство Оксфордского университета; 2014; 42: 11304–11320. pmid: 25223784 П., Карлстрём Г., Вену К., Галле Б. Кинетика гидратации ДНК. J Mol Biol. 1997. 268: 118–136. pmid:46
П., Карлстрём Г., Вену К., Галле Б. Кинетика гидратации ДНК. J Mol Biol. 1997. 268: 118–136. pmid:46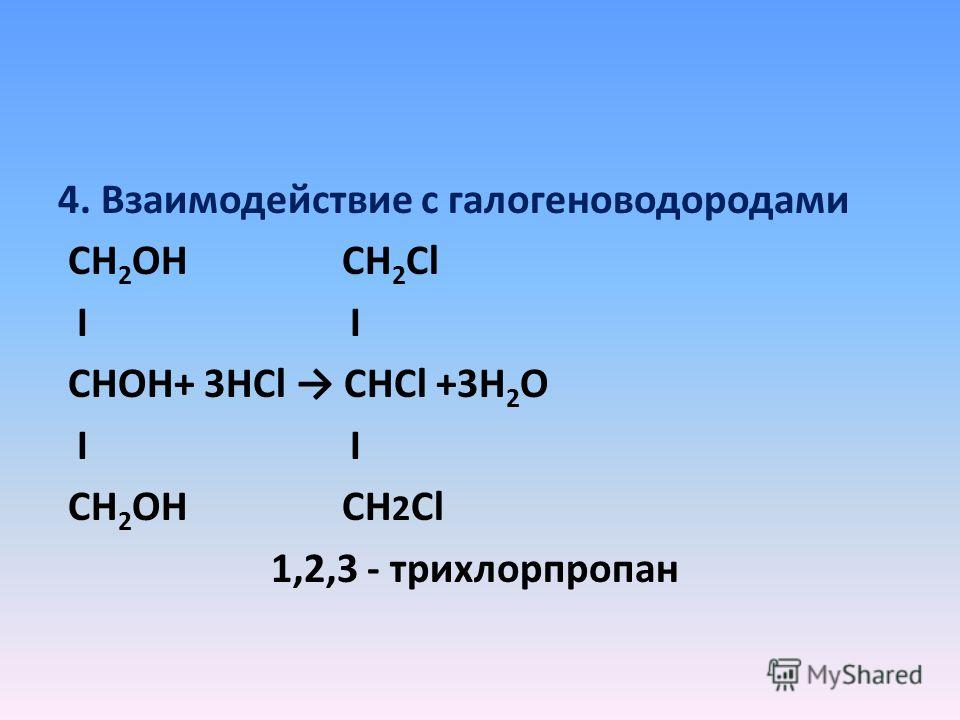 ACS Cent Sci. Американское химическое общество; 2017; 3: 708–714. pmid: 28776012
ACS Cent Sci. Американское химическое общество; 2017; 3: 708–714. pmid: 28776012 J. Phys Chem. 1989; 93: 479–484. Доступно: https://pubs.acs.org/doi/pdf/10.1021/j100338a092
J. Phys Chem. 1989; 93: 479–484. Доступно: https://pubs.acs.org/doi/pdf/10.1021/j100338a092 Накано С., Ямагути Д., Татейши-Каримата Х., Миёси Д., Сугимото Н. Изменения гидратации при свертывании ДНК, изученные в экспериментах с осмотическим стрессом. Биофиз Дж. Биофизическое общество; 2012; 102: 2808–17. pmid: 22735531
Накано С., Ямагути Д., Татейши-Каримата Х., Миёси Д., Сугимото Н. Изменения гидратации при свертывании ДНК, изученные в экспериментах с осмотическим стрессом. Биофиз Дж. Биофизическое общество; 2012; 102: 2808–17. pmid: 22735531 Биохимия. 2002; 41: 15017–15024. pmid: 12475251
Биохимия. 2002; 41: 15017–15024. pmid: 12475251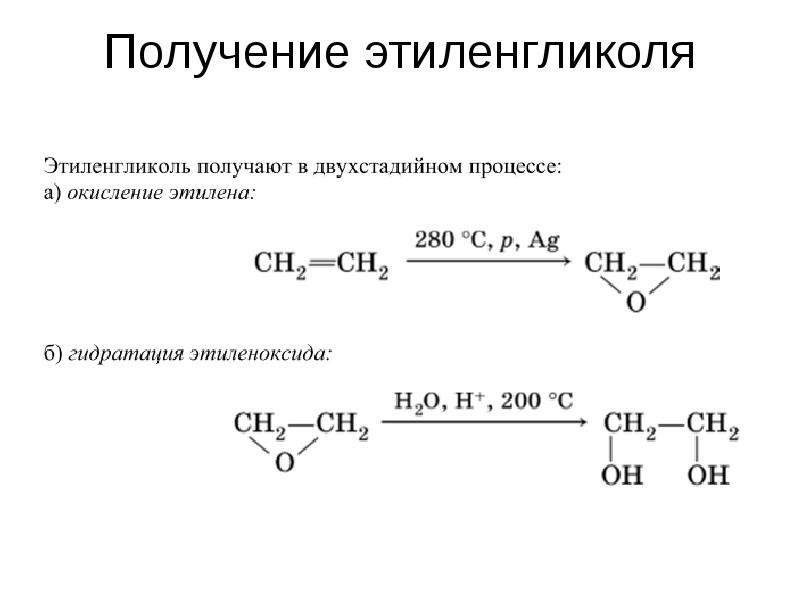
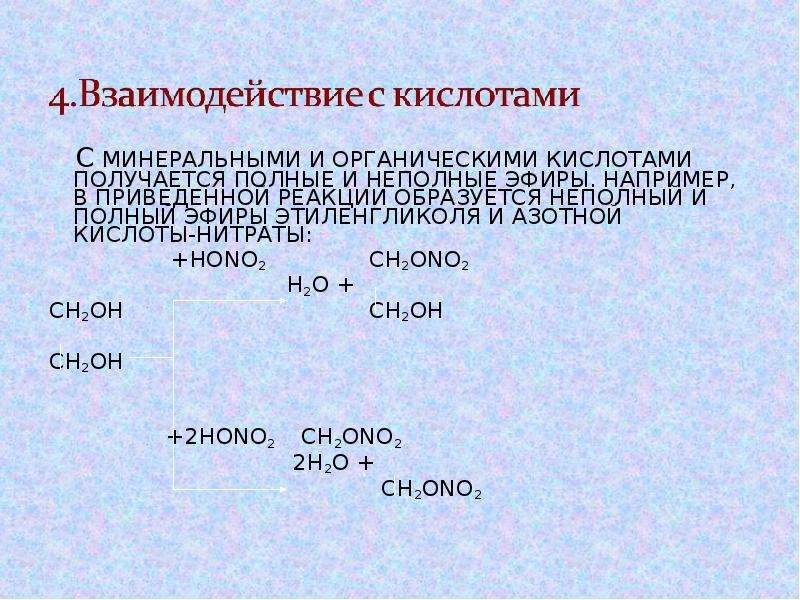
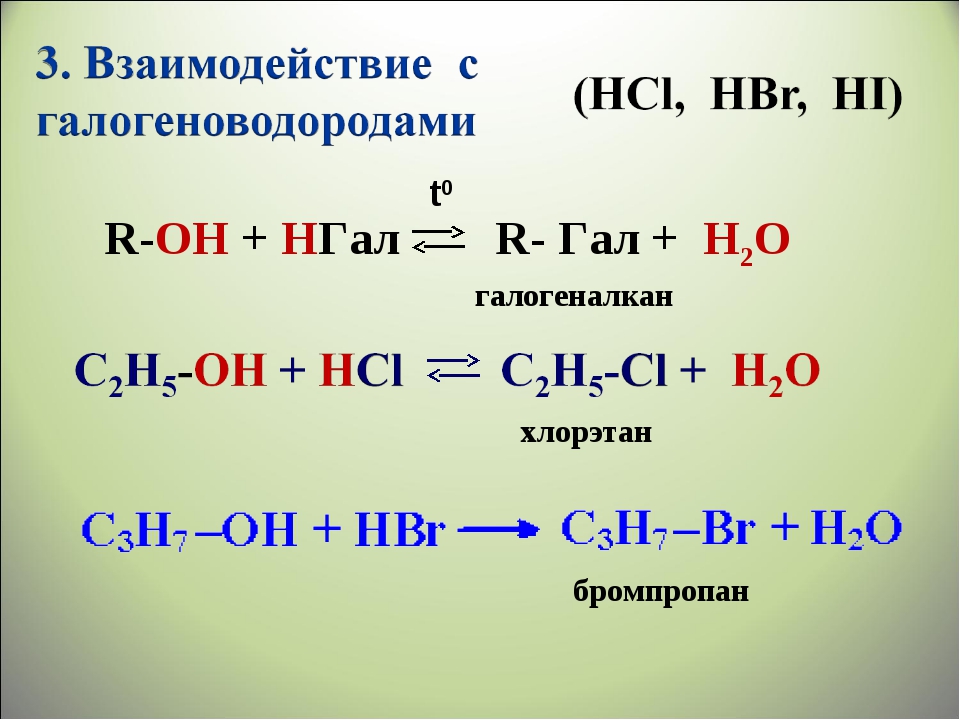
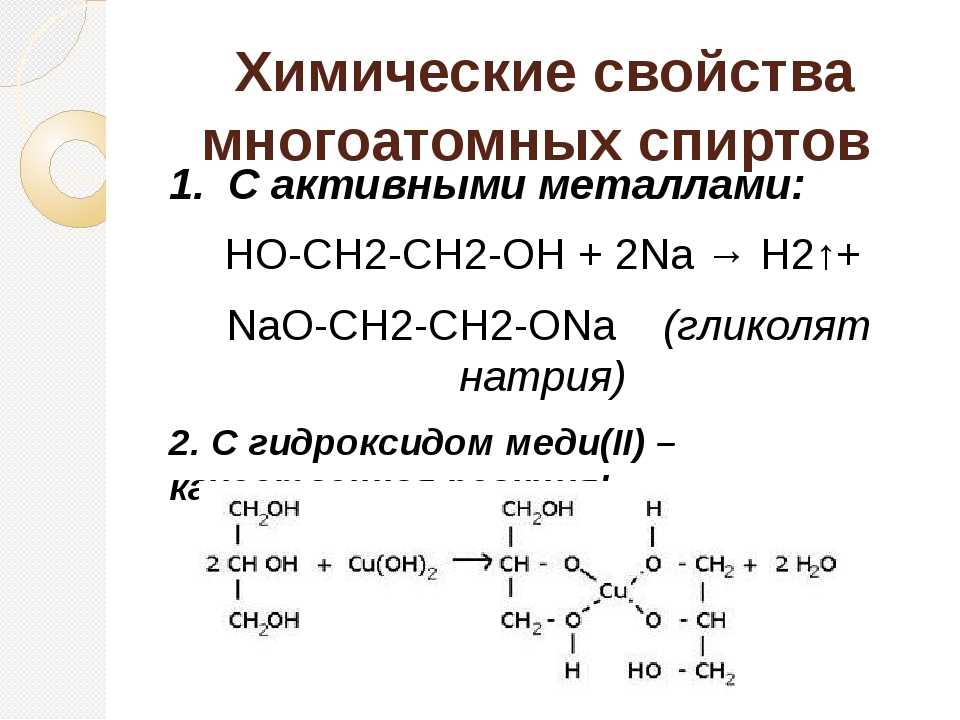 J. Phys. Chem. B 109 , 17545–17552 (2005).
J. Phys. Chem. B 109 , 17545–17552 (2005). Разработка поверхностей из полиэтиленгликоля, связанных цепями, для получения высокоэффективных бионаночастиц. Sci. Technol. Adv. Матер. 11 , 054505 (2010).
Разработка поверхностей из полиэтиленгликоля, связанных цепями, для получения высокоэффективных бионаночастиц. Sci. Technol. Adv. Матер. 11 , 054505 (2010). Прог. Поли. Sci. 32 , 698–725 (2007).
Прог. Поли. Sci. 32 , 698–725 (2007). , Sheth, S. & Halperin, A. Кисти из привитого поли (этиленоксида) в качестве необрастающих покрытий поверхности. J. Biomater. Sci. Поли. Эд. 10 , 1125–1147 (1999).
, Sheth, S. & Halperin, A. Кисти из привитого поли (этиленоксида) в качестве необрастающих покрытий поверхности. J. Biomater. Sci. Поли. Эд. 10 , 1125–1147 (1999). P., Andruzzi, A., Ober, CK, Hexemer, A., Kramer, EJ, Callow, JA, Finlay, JA & Callow, ME Покрытия на основе полиэтиленгликоля с боковыми цепями и фторуглеродных полимеров для контроль морского биообрастания. Биообрастание 19 (Дополнение), 91–98 (2003).
P., Andruzzi, A., Ober, CK, Hexemer, A., Kramer, EJ, Callow, JA, Finlay, JA & Callow, ME Покрытия на основе полиэтиленгликоля с боковыми цепями и фторуглеродных полимеров для контроль морского биообрастания. Биообрастание 19 (Дополнение), 91–98 (2003). , Nishio, M., Sugasawa, H. & Nagasaki, Y. Прямое наблюдение индуцированной адсорбцией инактивации фрагментов антител, окруженных слоем смешанных штифтов на поверхности золота. J. Am. Chem. Soc. 132 , 7982–7989 (2010).
, Nishio, M., Sugasawa, H. & Nagasaki, Y. Прямое наблюдение индуцированной адсорбцией инактивации фрагментов антител, окруженных слоем смешанных штифтов на поверхности золота. J. Am. Chem. Soc. 132 , 7982–7989 (2010).
 467 (Американское химическое общество, 1991).
467 (Американское химическое общество, 1991).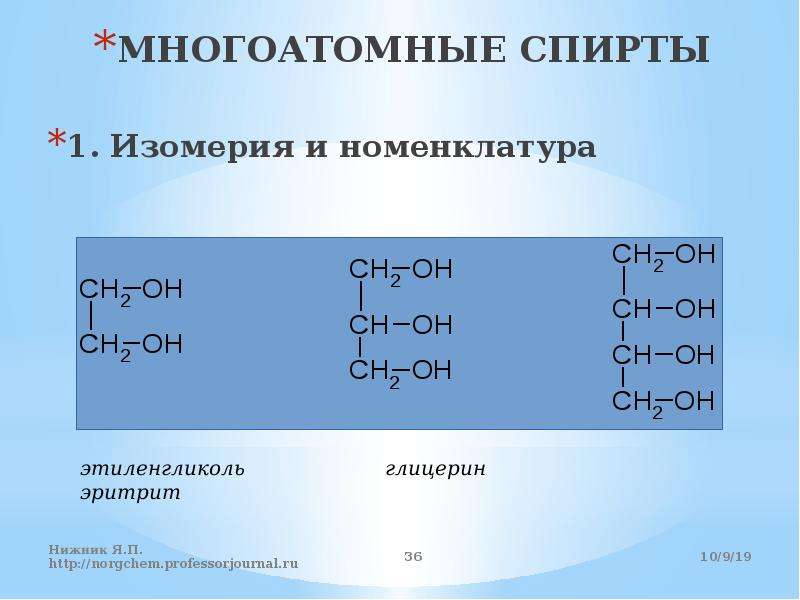 Langmuir 22 , 5760–5769 (2006).
Langmuir 22 , 5760–5769 (2006).
 Биоинтерфазы 2 , 126 (2007).
Биоинтерфазы 2 , 126 (2007). Нат. Матер. 2 , 259 (2003).
Нат. Матер. 2 , 259 (2003). Ленгмюр 21 , 11599 (2005).
Ленгмюр 21 , 11599 (2005). Chem. Матер. 21 , 3526–3535 (2009).
Chem. Матер. 21 , 3526–3535 (2009). Clin. Chem. 47 , 1269 (2001).
Clin. Chem. 47 , 1269 (2001).
 Формирование и структура самоорганизующихся монослоев. Chem. Ред. 96 , 1533–1554 (1996).
Формирование и структура самоорганизующихся монослоев. Chem. Ред. 96 , 1533–1554 (1996). М., Грейнджер, Д. В., Кастнер, Д. Г. и Гэмбл, Л.J. Покрытие поверхности и структура смешанных монослоев ДНК / алкилтиола на золоте: характеристика с помощью XPS, NEXAFS и измерений интенсивности флуоресценции. Анал. Chem. 78 , 3316–3325 (2006).
М., Грейнджер, Д. В., Кастнер, Д. Г. и Гэмбл, Л.J. Покрытие поверхности и структура смешанных монослоев ДНК / алкилтиола на золоте: характеристика с помощью XPS, NEXAFS и измерений интенсивности флуоресценции. Анал. Chem. 78 , 3316–3325 (2006).