Температура кипения этиленгликоль: Этиленгликоль – основные характеристики и сферы применения + Видео » АвтоНоватор
Этиленгликоль
Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра ТООНС
Контрольная работа по курсу:
«Основы технологии органического синтеза»
на тему:
Этиленгликоль
Казань
2007
Содержание:
Введение
Физические свойства
Химические свойства
Способы получения этиленгликол
Технологическая схема получения этиленгликоля гидратацией окиси этилена
Технологическая схема совместного получения этиленгликоля и окиси этилена в стационарном слое катализатора
Список литературы
Введение
Этиленгликоль простейший двухатомный спирт ряда гликолей, впервые синтезированный Вюрцем в 1859 г. В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) вырабатывают в очень больших количествах и используют в различных отраслях народного хозяйства.
В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) вырабатывают в очень больших количествах и используют в различных отраслях народного хозяйства.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, растворителей, взрывчатых веществ и пр.
Состав этиленгликоля: С2Н6О2.
Структурная формула:
Н Н
׀ ׀
Н С С — Н
׀ ׀
ОН НО
Физические свойства
Этиленгликоль СН2ОНСН2ОН вязкая бесцветная жидкость со слабым запахом и сладким вкусом. Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления 11,5° С. Плотность 1,11г/см3; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с водой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, ксилолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метилового спирта.
Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления 11,5° С. Плотность 1,11г/см3; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с водой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, ксилолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метилового спирта.
Этиленгликоль сравнительно устойчив при высокой температуре не разлагается при пропускании над пемзой, нагретой до 400°С. Разложение гликоля начинается при 500 — 520°С, а при 550°С происходит уже со значительной скоростью; но даже при этой температуре до 36% этиленгликоля не подвергается разложению.
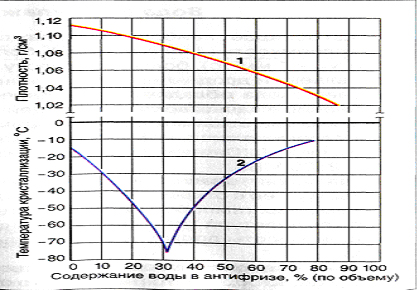
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при 25°С, а 60%-ный водный раствор при 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при 25°С, а 60%-ный водный раствор при 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Химические свойства
Химические свойства этиленгликоля, как и других гликолей аналогичны свойствам одноатомных спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполный гликоляты: Ch3ONa Ch3ONa, Ch3OH Ch3ONa.
Гликоляты образуются не только со щелочными металлами, но и с оксидами некоторых других металлов, например с гидроксидом меди. При действии щелочи на сульфат меди (II) образуется голубой осадок гидроксида меди (II). Этот осадок не растворяется в спирте, но очень легко на холоде растворяется в гликоле вследствие образования комплексного гликолята меди:
Н
׀
СН2ОН СН2 — О О СН2
2 ׀+ Cu (OH)2→׀ Cu ׀+ 2 h3O
СН2ОН СН2 — О О СН2
׀
Н
2. С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются неполный и полный эфиры этиленгликоля и азотной кислоты нитраты:
С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются неполный и полный эфиры этиленгликоля и азотной кислоты нитраты:
СН2ONO2
СН2ОН +НОNO2 Н2О + ׀
_ СН2OH
+2HONO2 СН2ONO2
СН2ОН 2Н2О + ׀
СН2ONO2
Соответственно можно получить полные и неполные простые эфиры, например диэтиловый эфир этилен гликоля C2Н5ОСН2 СН2ОС2Н5 и моноэтиловый эфир СН2ОН СН2ОС2Н5 . Последний под названием этилцеллозольв применяется как растворитель в производстве нитролаков, бездымного пороха (пироксилина), ацетатного шелка и других производных целлюлозы.
С двуосновными кислотами этиленгликоль ступает реакцию поликонденсации, образуя высокомолекулярные полиэфиры
HO C = O O O
Н2С ОН ׀׀׀ ׀׀
n ׀ + n R → OCh3 Ch3 O C R C + 2nh3O
Н2С ОН ׀
HO C = O n
3. Окисление гликолей проходит сложно, ступенчато:
Окисление гликолей проходит сложно, ступенчато:
О
׀׀
О СН2OH СООН → НООС С — Н
СН2ОН ׀׀ ↓
׀ → С О О СООН
СН2ОН ׀Н ׀׀ ׀׀ ׀
СН2OH С — С СООН
׀ ׀
Н Н
4. Отщепление воды от этиленгликоля может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции.
СН2ОН — СН2ОН → [СН2 = СНОН] → СН3 СНО
Межмолекулярное выделение воды приводит к образованию оксиэфиров (спиртоэфиров) или циклических простых эфиров:
СН2 СН2
СН2ОН НО СН2 СН2 О СН2 ׀ ׀
׀+׀→ ׀׀→ О О
СН2ОН СН2ОН СН2ОН СН2ОН ׀ ׀
СН2 СН2
При межмолекулярной дегидратации этиленгликоля могут быть получены зависимости от условий диэтиленгликоль или диоксан:
СН2 СН2
׀ ׀
2НОСН2 СН2ОН → НОСН2 СН2О-СН2 СН2ОН → О О
׀ ׀
СН2 СН2
Способы получения этиленгликоля
В промышленном масштабе этиленгликоль получают главным образом гидратацией окиси этилена:
Н2С СН2 +Н2ОСН2ОН СН2ОН
О
При гидратации окиси этилена, кроме этиленгликоля, образуются ди-, три-, тетра- и полиэтиленгликоли.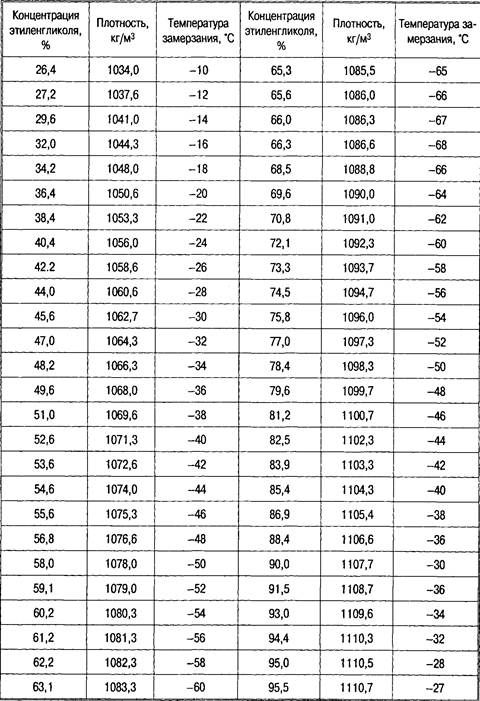 Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль окиси этилена берут от 10 до 22 моль воды) и добавляют к водному раствору окиси этилена 0,10,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль окиси этилена берут от 10 до 22 моль воды) и добавляют к водному раствору окиси этилена 0,10,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Процесс проводят в жидкой фазе в присутствии катализаторов (небольшое количество кислоты серной, фосфорной или щавелевой) при 50100°С и атмосферном давлении или без катализатора при 10 ат и 190200° С.
Гидратацию окиси этилена при атмосферном давлении можно проводить, обрабатывая раствором кислоты контактные газы процесса прямого окисления этилена. Получаемый разбавленный раствор этиленгликоля нейтрализуют, отгоняют большую часть воды и далее фракционной перегонкой удаляют остатки воды и высшие гликоли.
В отсутствие катализаторов гидратацию окиси этилена проводят обычно под давлением 10 ат. при мольном соотношении окиси этилена и воды примерно 1 : 16; продолжительность контакта 30 мин.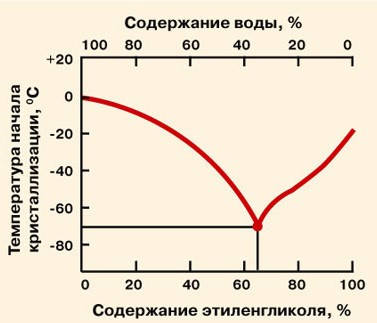 Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания вод
Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания вод
Пропиленгликоль и его свойства. Статьи компании «ТОВ «МIКС»»
Пропиленгликоль (монопропиленгликоль -1,2-пропандиол, 1,2-дигидроксипропан) – органическое соединение, двухатомный спирт алифатического ряда, химическая формула СН3СН(ОН)СН2ОН. Название образуется от углеводородного радикала – пропилена и слова гликоль, означающего двухатомный спирт. Характеристики пропиленгликоля: плотность — 1,0363 г/см³, температура кипения 189°С, температура воспламенения — 111°С
Пропиленгликоль – вязкая жидкость без цвета и запаха, сладковатая на вкус, с хорошими гигроскопическими свойствами (легко впитывает воду), хороший растворитель для гидрофильных (хорошо растворимых в воде веществ – это соли, сахара, аминокислоты) и гидрофобных (в воде практически не растворимые — это жиры), поэтому широко используется для получения растворов химических веществ, не растворимые друг в друге.
ПРИМЕНЕНИЕ ПРОПИЛЕНГЛИКОЛЯ
Пропиленгликоль не токсичен, не вызывает отравление при попадании внутрь организма, не опасен даже при длительном вдыхании, взрыво-, пожаро- и экологически безопасен. Пропиленгликоль нашел широкое применение во многих странах мира в пищевой и фармацевтической отраслях промышленности в качестве пищевой добавки Е1520.
Пропиленгликоль высокой чистоты используется для придания продуктам питания желаемых свойств, например определенного цвета (красители), длительности хранения (консерванты), аромата (ароматизаторы), а также для получения нужного качества, консистенции и вкуса пищевых продуктов, а также в качестве растворителя для экстракции многих природных ароматизирующих веществ, а также используется в качестве носителя, смягчителя и увлажнителя во многих видах косметической продукции для смягчения и увлажнения кожи: при приготовлении шампуней, эмульсий, лосьонов, эликсиров, паст, кремов, помад и других препаратов.
Пропиленгликоль широко применяется для получения экологически чистых, взрыво- и пожаробезопасных водных растворов — теплоносителей (антифризов, хладагентов, незамерзающих жидкостей) для систем отопления и кондиционирования жилых помещений, производственных помещений для пищевой, фармацевтической, косметической промышленности, а также для использования в системах промышленного кондиционирования при производстве и хранении пищевых продуктов. В зависимости от климатических условий эксплуатации изготавливаются и применяются теплоносители на пропиленгликоле в виде водных растворов ( антифризов, хладагентов, незамерзающих жидкостей) с содержанием основного вещества 31%, 37%, 42%, 45%, 50% и 55% и с рабочим диапазоном температур до -15°C, -20°C, -25°C, -30°C, -35°C и -40°C соответственно.
Важнейшим теплофизическим параметром водного раствора пропиленгликоля является зависимость температуры замерзания (кристаллизации) раствора от его концентрации.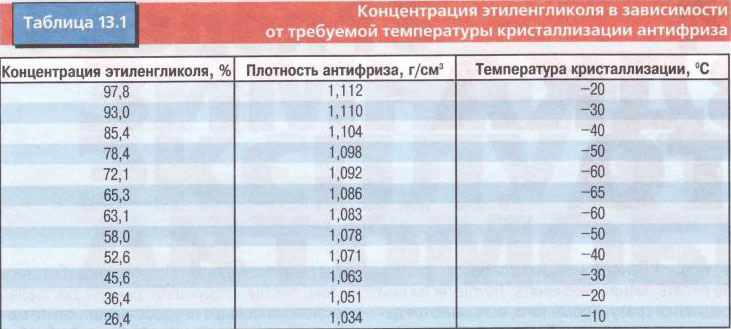 Эта зависимость носит нелинейный характер и температура замерзания водного раствора достигает своего минимума в -60°C при концентрации 70%, затем при дальнейшем повышении концентрации до 98% температура замерзания остается практически постоянной в -60°C. Концентрация, количество пропиленгликоля, содержащегося в теплоносителе, формирует в основном и цену самого теплоносителя. В связи с этим не целесообразно и экономически не выгодно применение водных растворов с концентрацией выше 70%.
Эта зависимость носит нелинейный характер и температура замерзания водного раствора достигает своего минимума в -60°C при концентрации 70%, затем при дальнейшем повышении концентрации до 98% температура замерзания остается практически постоянной в -60°C. Концентрация, количество пропиленгликоля, содержащегося в теплоносителе, формирует в основном и цену самого теплоносителя. В связи с этим не целесообразно и экономически не выгодно применение водных растворов с концентрацией выше 70%.
Нелинейный характер зависимости температуры кристаллизации водного раствора пропиленгликоля от его концентрации представлены в табл. №1 в виде двух функциональных зависимостей: 1) зависимость температуры кристаллизации водного раствора от его концентрациии и 2) значения величины плотности раствора при температуре 20°C в зависимости от концентрации пропиленгликоля.
Табл. №1. Влияние концентрации пропиленгликоля на температуру кристаллизацию водного раствора пропиленгликоля.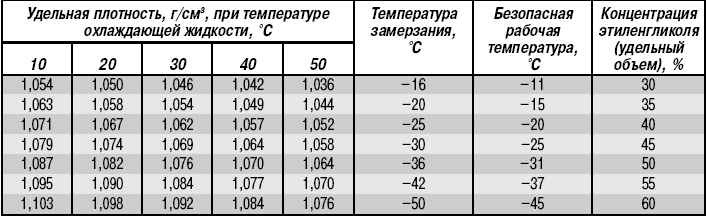 Значения (величина) плотности раствора при температуре 20°C.
Значения (величина) плотности раствора при температуре 20°C.
| Концентрация пропиленгликоля, % | Температура замерзания, °C | Плотность при 20 °C |
| 31% | -15 °C | 1,023 |
| 36% | -20 °C | 1,028 |
| 42% | -25 °C | 1,032 |
| 45% | -30 °C | 1,035 |
| 50% | -35 °C | 1,038 |
| 55% | -45 °C | 1,040 |
| 60% | -55 °C | 1,042 |
| 65% | -57 °C | 1,043 |
| 70% | -58 °C | 1,044 |
УСЛОВИЯ ХРАНЕНИЯ ПРОПИЛЕНГЛИКОЛЯ
Гарантийный срок хранения пропиленгликоля составляет 5 лет со дня изготовления. Пропиленгликоль при условии соответствия показателей качества норме может быть признан годным к использованию. При транспортировке и для его непродолжительного хранения могут быть использованы емкости из обычной стали, покрытых внутри толстым слоем фенольного лака, однако при длительном хранении необходимо использовать емкости из нержавеющей стали или алюминия.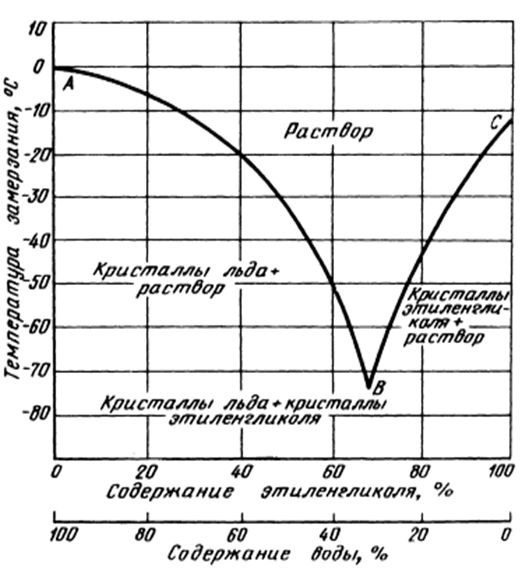
Концентрированный пропиленгликоль относится к горючим пожаро- и взрывоопасным веществам, при возгорании рекомендуется тушить пенными или порошковыми средствами, а также тонкораспыленной водой. Водные растворы пропиленгликоля – теплоносители ( антифриз, незамерзающая жидкость, хладагент) негорючие вещества.
ХИМСЕРВИС. Этиленгликоль
Этиленгликоль: описание, применениеЭтиленгликоль
— многоатомный спирт, имеющий вид сиропообразной жидкости, которая не имеет запаха, но обладает сладковатым привкусом. Этиленгликоль ядовит! Как химическое вещество используется во многих направлениях, в том числе и в химической промышленности, например, для получения бытовых и автомобильных антифризов. Для большинства современных автомобильных жидкостей, например, тосола, базовым сырьём является именно этиленгликоль; цена отечественного материала невысока, однако качество — на уровне ведущих мировых производителей. В этом легко убедиться, приобретая у нас этиленгликоль по ценам, привлекательнее которых нет, или производные продукты для него.
В этом легко убедиться, приобретая у нас этиленгликоль по ценам, привлекательнее которых нет, или производные продукты для него.Характеристики этиленгликоля
Этиленгликолю, как и любому другому химическому веществу, присущи некоторые особенные свойства, наделяющие его важными для производственных целей техническими характеристиками. К их числу, например, относятся:
Смешиваемость с водой, ацетоном и спиртом,
Массовая доля воды: до 0,1%,
Плотностью при 20°С: 1,112-1,113 г/см3,
Температура кипения: 197,9°C,
Температура плавления: 12,6°C,
Температурой начала замерзания: минус 12-13°С.
Другими словами, этиленгликоль (цена оптовой партии может быть снижена) обладает способностью не замерзать при низких температурах и понижать температуру замерзания других жидкостей, в состав которых входит. Таким образом, при помощи этиленгликоля можно получить растворы, которые не будут замерзать даже при минус 70°С.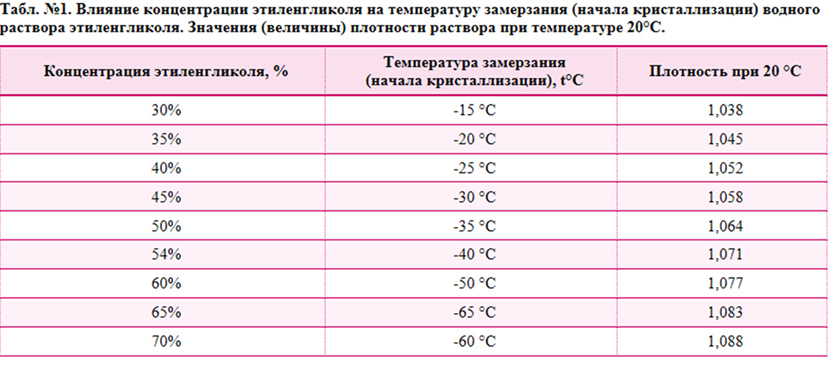
Применение и хранение этиленгликоля
Этиленгликоль в силу своих уникальных технических характеристик нашел широкое применение в самых разных сферах. Так, это вещество используют как теплоноситель в отопительных и нагревательных системах, а в системах охлаждения — как хладоноситель.
В автомобильной химии с использованием этиленгликоля производят тосолы, антифризы, гидравлические и тормозные жидкости. Кроме того, применяют этиленгликоль для производства смол, волокон, полиуретанов, растворителей, душистых веществ, взрывчатых веществ. На его основе создают разные материалы для кожевенной и фармакологической промышленности.
Важная информация!
При работе с этиленгликолем всегда важно помнить, что это ядовитое вещество, попадание которого внутрь организма недопустимо во избежание летального исхода! Максимальная концентрация этого вещества в воздухе во время применения не должна превышать 5 миллиграммов на метр кубический.
Этиленгликоль продаётся только в алюминиевой или стальной таре, которая стойка к коррозии. В этой же таре этиленгликоль должен храниться и транспортироваться в дальнейшем. Исключение составляют железнодорожные цистерны. Перевозят этиленгликоль в крытом транспорте любого вида. Хранят в не отапливаемых помещениях в плотно закрытой таре. Гарантийный срок хранения: 1-3 года по рекомендациям производителя.
Точки кипения обычных жидкостей и газов
Точка кипения вещества — это температура, при которой оно меняет состояние с жидкого на газообразное во всем объеме жидкости. При температуре кипения молекулы в любом месте жидкости могут испаряться.
Точка кипения определяется как температура, при которой давление насыщенного пара жидкости равно окружающему атмосферному давлению.
Температура кипения при атмосферном давлении (14.7 фунтов на квадратный дюйм, 1 бар (абс.)) для некоторых распространенных жидкостей и газов можно найти в таблице ниже:
| Продукт | Точка кипения при атмосферном давлении ( o C) | ||
|---|---|---|---|
| Ацетальдегид CH 3 CHO | 20,8 | ||
| Ангидрид уксусной кислоты (CH 3 COO) 2 O | 139 | ||
| Ацетон CH 3 COCH 3 | 56. 08 08 | ||
| Ацентонитрил | 81,6 | ||
| Ацетилен | -84 | ||
| Акролеин | 52,3 | ||
| Акрилонитрил | 77,2 | ||
| Спирт — этил (зерно, этанол) C H 5 OH | 79 | ||
| Спирт — аллил | 97,2 | ||
| Спирт — бутил-н | 117 | ||
| Спирт — изобутил | 107.8 | ||
| Спирт — метил (метиловый спирт, древесный спирт, древесная нафта или древесные спирты) CH 3 OH | 64,7 | ||
| Спирт — пропил | 97,5 | ||
| Аллиламин | 54 | ||
| Аммиак | -35,5 | ||
| Анилин | 184,1 | ||
| Анизол | 153,6 | ||
| Аргон | -186 | ||
| Бензальдегид | 178.7 | ||
| Бензол (бензол) C 6 H 6 | 80,4 | ||
| Бензонитрил | 191,1 | ||
| Тормозная жидкость, точка 3 (сухая — влажная точки кипения) (влажная включает гигроскопическую влагу) | 205 — 140 | ||
| Тормозная жидкость Dot 4 (сухая — влажная точки кипения) | 230 — 155 | ||
| Тормозная жидкость Dot 5 (сухая — влажная точки кипения) | 260 — 180 | ||
Тормозная жидкость Точка 5.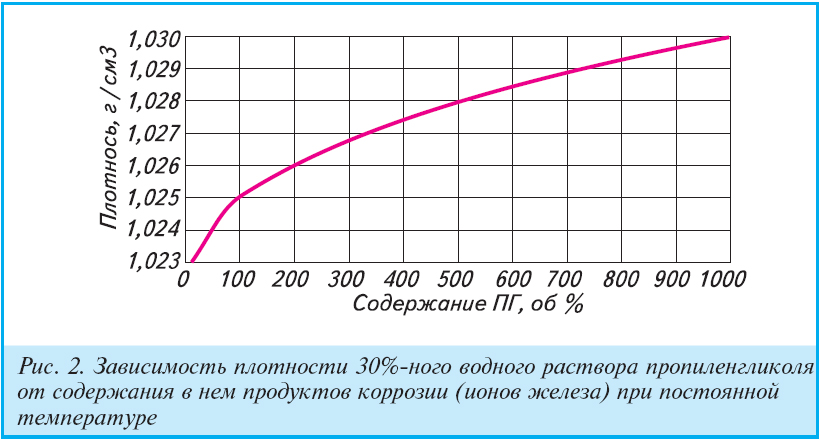 1 (сухой — влажный, точки кипения) 1 (сухой — влажный, точки кипения) | 270-190 | ||
| Бром | 58,8 | ||
| Бромбензол | 156,0 | ||
| 1,2-Бутадиен | 10,9 | ||
| н-бутан | -0,5 | ||
| 1-бутан | -6,25 | ||
| Бутанал | 74,8 | ||
| 1-бутанол | 117,6 | ||
| 2-бутанон | 79.6 | ||
| Масляная кислота n | 162,5 | ||
| Камфора | 204,0 | ||
| Карболовая кислота (фенол) | 182,2 | ||
| Бисульфид углерода | 47,8 | ||
| Двуокись углерода CO 2 (сублимирует) | -78,5 | ||
| Дисульфид углерода CS 2 | 46,2 | ||
| Окись углерода | -192 | ||
| Тетрахлорид углерода (тетрахлорэтан) CCl 4 | 76.7 | ||
| Хлор | -34,4 | ||
| Хлорбензол | 131,7 | ||
| Хлороформ (трихлорметан) | 62,2 | ||
| Циклогексан | 80,7 | ||
| Циклогексан | 2529Циклогексан | 252949,3 | |
| n — Декан | 174 | ||
Дихлорметан — см. Метиленхлорид Метиленхлорид | |||
| Диэтиловый эфир | 34.4 | ||
| Диметилсульфат | 186 | ||
| Диметилсульфид | 37,3 | ||
| Диизопропиловый эфир | 68,4 | ||
| 2,2 — Диметилпентан | 79,2 | ||
| 1,4-Диоксан 900 | 101,2 | ||
| Даутерм | 258 | ||
| Этан | -88,78 | ||
| Эфир | 34,6 | ||
| Глицерин | 290 | ||
| Этан C 2 H 6 900 -88 | |||
| Этанол | 78.24 | ||
| Этиламин | 16,6 | ||
| Этилацетат CH 3 COOC 2 H 3 | 77,2 | ||
| Этилбензол | 136 | ||
| Этилбромид C 2 H 3 Br | 38,4 | ||
| Этилен | -103,7 | ||
| Бромистый этилен | 131,7 | ||
| Этиленгликоль | 197 | ||
| 3 — Этилпентан | 93. 5 5 | ||
| Фтор | -187 | ||
| Формальдегид | -19,1 | ||
| Муравьиная кислота | 101,0 | ||
| Трихлорфторметановый хладагент R-11 | 23,8 | ||
| Дихлордифтор 32 Дихлордифтор | -29,8 | ||
| Хлордифторметановый хладагент R-22 | -41,2 | ||
| 2,3 — Диметилбутан | 58 | ||
| Диизобутил | 109 | ||
| Фурфурол | 161.5 | ||
| Спирт фторфуриловый | 168 | ||
| Бензин | 38-204 | ||
| Глицерин | 290 | ||
| Гликоль | 197 | ||
| Гелий | -149 | 98,4 | |
| н-гексан | 68,7 | ||
| Гексиламин | 132 | ||
| Водород | -253 | ||
| Соляная кислота | -81.7 | ||
| Плавиковая кислота | 18,9 | ||
| Хлористый водород | -81,7 | ||
| Сероводород | -60 | ||
| Йод | 184,3 | 80||
| Изопропиловый спирт | |||
| Гидропероксид изопропилбензола | 153 | ||
| Изобутан | -11,72 | ||
| Изобутен | -6.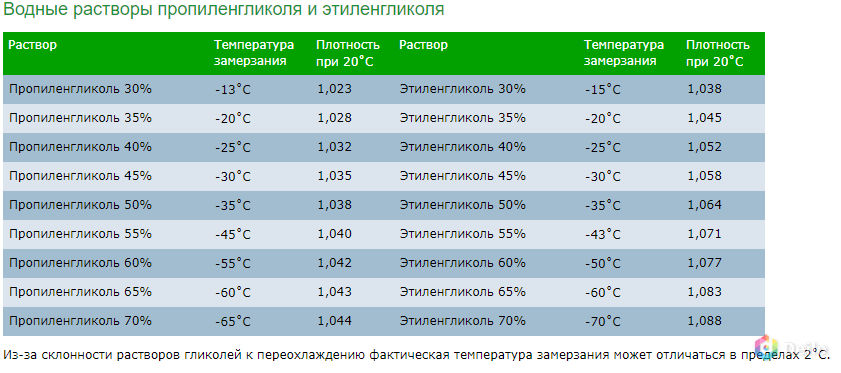 9 9 | ||
| Изооктан | 99,2 | ||
| Изопентан | 27,8 | ||
| Изопрен | 34,1 | ||
| Изопропилбензол | 152 | ||
| Реактивное топливо | 163 | 150-300 | |
| Льняное масло | 287 | ||
| Ртуть | 356,9 | ||
| Метан | -161.5 | ||
| Метанол (метиловый спирт, древесный спирт) | 64,5 | ||
| Метилацетат | 57,2 | ||
| Метилбромид | 3,3 | ||
| Метилхлорид | -23,9 | ||
| Метиленхлорид (CH 2 Cl 2 , дихлорметан) | 39,8 | ||
| Метиламин | -6,4 | ||
| Метиловый эфир (C 2 H 6 O) | -25 | ||
| Метилциклогексан | 101 | ||
| Метилциклопентан | 71.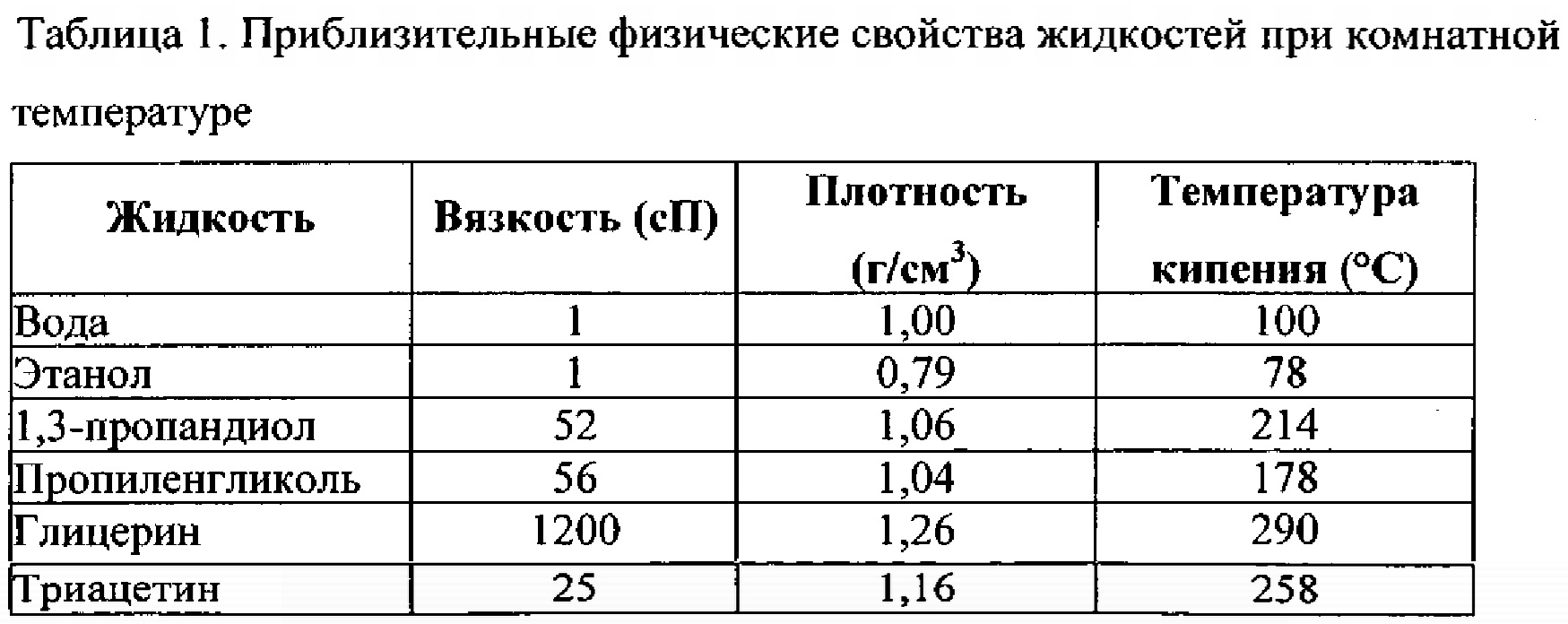 8 8 | ||
| Метилиодид | 42,6 | ||
| 2 — Метилгексан | 90,1 | ||
| 3 — Метилгексан | 91,8 | ||
| 2 — Метилпентан | 60,3 | ||
| 60,3 | |||
| Нафта | 100 — 160 | ||
| Нафталин (нафталин) | 217,9 | ||
| Неогексан | 49.7 | ||
| Неопентан | 9,5 | ||
| Азотная кислота | 120 | ||
| Нитробензол | 210,9 | ||
| n — Нонан | 150,7 | ||
| Азотная кислота | |||
| Азотная кислота | |||
| -196 | |||
| n — Октан | 125,6 | ||
| Оливковое масло | 300 | ||
| Кислород | -183 | ||
| Паральдегид | 124 | ||
| n — Пентан | 36 | ||
| 1 — Пентен | 30 | ||
| Пероксиуксусная кислота | 110 | ||
| Бензин | 95 | ||
| Нефть | 210 | ||
| Петролейный эфир | 35-60 | ||
| Фенол | 182 | Фосген | 8. 3 3 |
| Фосфорная кислота | 213 | ||
| Пропанал | 48 | ||
| Пропан | -42,04 | ||
| Пропен | -47,72 | ||
| 2-пропанол | 82,2 | 141 | |
| Пропиламин | 47,2 | ||
| Пропилен | -47,7 | ||
| Пропиленгликоль | 187 | ||
| Насыщенный рассол | 108 145 | ||
| Стирол | 25|||
| Сера | 444.6 | ||
| Серная кислота | 330 | ||
| Дихлорид серы | 59,6 | ||
| Диоксид серы | -10 | ||
| Сульфурилхлорид | 69,4 | ||
| Смола | |||
| Толуол | 110,6 | ||
| Триптан | 80,9 | ||
| Триэтаноламин | 350 | ||
| Скипидар | 160 | ||
| Вода | 100 | ||
| Вода | , морская вода | . 7 7 | |
| о-ксилол | 144,4 | ||
| м-ксилол | 139,1 | ||
| пара-ксилол | 138,3 |
Что такое полиэтиленгликоль, ингредиент, содержащийся во многих продуктах с шипучими электролитами?
Полиэтиленгликоль (ПЭГ) представляет собой производное нефти, которое производится из этиленгликоля (этан-1,2-диола), основного ингредиента антифриза. ПЭГ можно найти в ряде других продуктов, включая кремы для кожи и личные лубриканты, а также в качестве пищевой добавки для предотвращения пенообразования.Кроме того, ПЭГ является активным ингредиентом ряда лекарств, назначаемых для лечения запоров. В случае шипучего электролита он используется в качестве смазывающего агента.
Хотя токсичность ПЭГ считается низкой, вы должны задать себе следующие вопросы:
- «Действительно ли я хочу проглотить соединение, аналогичное тому, что содержится в антифризах?»
- «Неужели я действительно хочу проглотить что-нибудь, что используется для лечения запора и потенциально может вызвать некоторые неприятные проблемы с желудком во время тренировки или гонки?»
Вашим ответом на оба вопроса должно быть твердое «Нет!» Зачем вкладывать в свое тело что-то, что не пойдет на пользу вашему здоровью или вашим спортивным результатам, особенно когда существует более здоровая и безопасная альтернатива?
В Endurolytes Fizz вы не найдете PEG. Вместо этого мы используем масло авокадо в качестве смазывающего вещества, что, несомненно, является более здоровым выбором.
Вместо этого мы используем масло авокадо в качестве смазывающего вещества, что, несомненно, является более здоровым выбором.
Есть два других вещества, которые содержатся во многих продуктах с шипучими электролитами, но не в Endurolytes. Как и PEG, вы также захотите избежать этого!
Ацесульфам K — Этот искусственный подсластитель, который в 200 раз слаще столового сахара, существует уже давно; это подсластитель, одобренный FDA с 1988 года. Как и другие искусственные подсластители, ведутся споры о том, безопасно ли это употреблять.Хотя FDA установило приемлемую суточную дозу (ADI) до 15 мг / кг массы тела в день — для спортсмена весом 165 фунтов, что соответствует чуть более грамму в день, — мы в Hammer Nutrition принимаем » позиция нулевой терпимости »в отношении потребления искусственных подсластителей. Как и в случае с ПЭГ, если он не пойдет на пользу вашему здоровью или спортивным результатам, а на самом деле может навредить им обоим, зачем вам вообще его принимать?
Что мы знаем об ацесульфаме К? Мы знаем, что несколько тестов на безопасность этого искусственного подсластителя были проведены в 70-х годах (довольно давно), и что многие организации, включая Центр науки в общественных интересах (CSPI), считают эти исследования слишком краткими. и качество их посредственное.Необходимость дальнейшего тестирования ацесульфама К представляется совершенно очевидной; однако в настоящее время FDA этого не требует.
и качество их посредственное.Необходимость дальнейшего тестирования ацесульфама К представляется совершенно очевидной; однако в настоящее время FDA этого не требует.
Мы также знаем, что ацесульфам K («K» — химический символ калия) содержит канцероген, известный как хлористый метилен (он же дихлорметан). Это химическое вещество является пропеллентом, используемым во многих аэрозольных продуктах, а также при производстве средств для снятия краски, средств для удаления краски, клеев и многого другого. Считается, что длительное воздействие хлористого метилена связано с рядом нарушений здоровья, включая головные боли, депрессию, тошноту, спутанность сознания и другие.Этот канцероген может негативно повлиять на печень и почки, а также вызвать рак.
Из-за отсутствия тестов мы не знаем со 100% уверенностью, какова токсичность ацесульфама К. Зачем рисковать, особенно с учетом того факта, что он содержит известный канцероген и что существует вполне определенная вероятность того, что этот искусственный подсластитель имеет ряд потенциально негативных последствий для здоровья? Для подслащивания продукта есть гораздо более безопасные альтернативы, такие как сорбитол и стевия, которые мы используем в Endurolytes Fizz.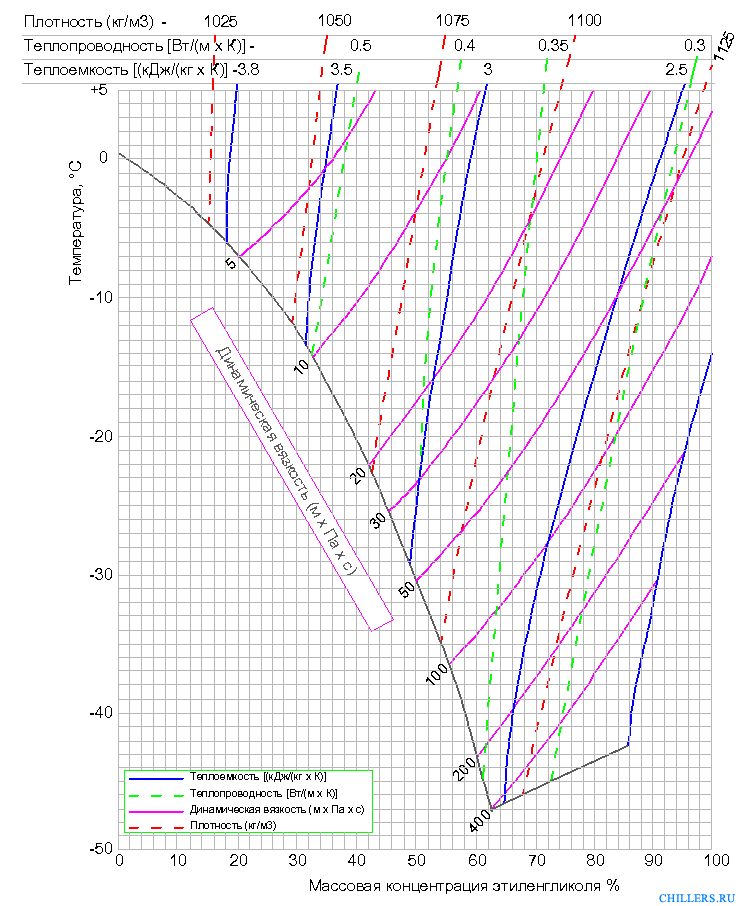
Сукралоза — Не дайте себя одурачить этим, казалось бы, безвредным веществом. Хотя сукралоза может начинаться с молекулы сахара, конечный продукт представляет собой синтетическое химическое вещество с хлорированным ядром. Производство сукралозы включает пятиэтапный процесс, в котором к молекуле сахара добавляются три молекулы хлора. Этот химический процесс настолько изменяет и преобразует химический состав сахара, что в конечном итоге он превращается в молекулу, не встречающуюся в природе.
Д-р Билл Миснер отвечает на вопрос «Следует ли мне употреблять сукралозу?» довольно легко заявить: «Этот искусственный подслащивающий ингредиент, возможно, хуже, чем обработанные простые сахара, которые он заменяет.Трудно представить себе, что синтетический хлорированный дисахарид является улучшением ».
Примечание: Для получения дополнительной информации о сорбите см. FAQ« Почему вы используете сорбит в Endurolytes Fizz? »
Резюме
Всегда помните, что то, что вы вкладываете в свое тело, играет огромную роль в определении ваших спортивных результатов и, что более важно, вашего здоровья.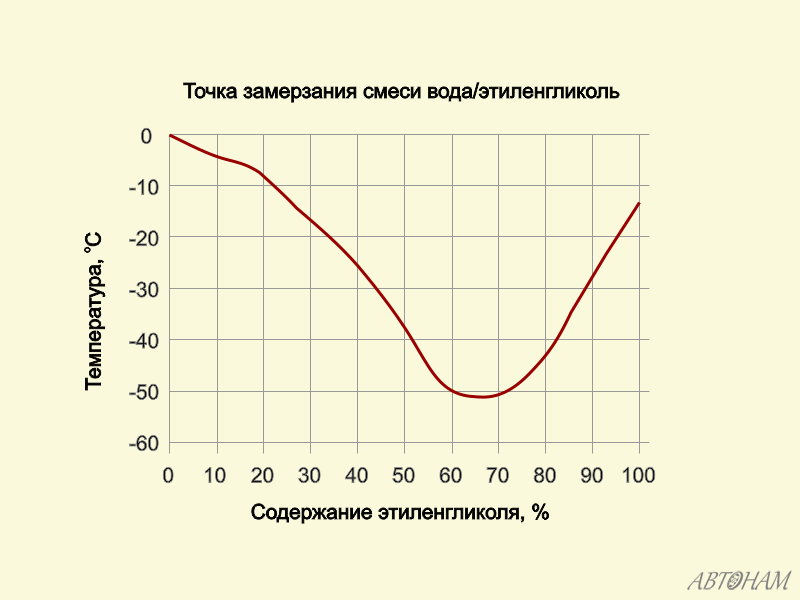 За 30 с лишним лет, и их количество постоянно растет, мы ни разу не отклонились от этой позиции.Вы тоже не должны! ПЭГ? Ацесульфам К? Сукралоза? Мы убеждены, что эти вещества не имеют никакого отношения к вашему организму, поэтому вы НИКОГДА не найдете их ни в одном продукте Hammer Nutrition, включая Endurolytes Fizz.
За 30 с лишним лет, и их количество постоянно растет, мы ни разу не отклонились от этой позиции.Вы тоже не должны! ПЭГ? Ацесульфам К? Сукралоза? Мы убеждены, что эти вещества не имеют никакого отношения к вашему организму, поэтому вы НИКОГДА не найдете их ни в одном продукте Hammer Nutrition, включая Endurolytes Fizz.
Таблица точек кипения растворителя —
(все точки кипения при стандартном давлении)
| Растворитель | Температура кипения (° C) | Растворитель | Температура кипения (° C) |
| уксусная кислота | 118.0 | Этилацетат | 77,1 |
| Ангидрид уксусной кислоты | 139,0 | Этиловый эфир | 34,6 |
| ацетон | 56,3 | Этилен дихлорид | 83,5 |
| Ацетонитрил | 81,6 | Этиленгликоль | 197,5 |
| Бензол | 80,1 | Гептан | 98,4 |
| изобутанол | 107. 7 7 | н-гексан | 68,7 |
| н-бутанол | 117,7 | соляная кислота | 84,8 |
| трет-бутанол | 82,5 | Метанол | 64,7 |
| Тетрахлорид углерода | 76,5 | Метиленхлорид | 39,8 |
| хлорбензол | 131,7 | МТБЭ | 55,2 |
| Хлороформ | 61.2 | Пентан | 36,1 |
| Циклогексан | 80,7 | Петролейный эфир | 35,0-60,0 |
| Циклопентан | 49,3 | изо-пропанол | 82,3 |
| Дихлорметан | 39,8 | н-пропанол | 97,2 |
| Диэтиловый эфир | 34,6 | Пиридин | 115,3 |
| Диметилацетамид | 166.1 | Тетрагидрофуран | 66,0 |
| Диметилформамид | 153,0 | Толуол | 110,6 |
| Диметилсульфоксид | 189,0 | Трифторуксусная кислота | 71,8 |
| Диоксан | 101,0 | Вода | 100,0 |
| этанол | 78,3 | Ксилол | 140,0 |
Примечание. Температуры кипения растворителя получены из материалов, опубликованных в Интернете компанией Honeywell Burdick and Jackson, Оксфордским университетом, Университетом Луисвилля, Университетом штата Мичиган и IPS INCHEM, и предназначены для использования только с Руководством по выбору вакуумных насосов BrandTech Scientific.Перечень растворителей не обязательно подразумевает химическую или физическую совместимость с вакуумными насосами и системами VACUUBRAND.
Температуры кипения растворителя получены из материалов, опубликованных в Интернете компанией Honeywell Burdick and Jackson, Оксфордским университетом, Университетом Луисвилля, Университетом штата Мичиган и IPS INCHEM, и предназначены для использования только с Руководством по выбору вакуумных насосов BrandTech Scientific.Перечень растворителей не обязательно подразумевает химическую или физическую совместимость с вакуумными насосами и системами VACUUBRAND.
Пожалуйста, посетите наше Руководство по выбору вакуумного насоса, чтобы получить помощь в выборе правильного вакуумного насоса для вашего применения, включая аспирацию, центробежное концентрирование, роторное испарение и многое другое.
.
