Этиленгликоль cuo – Составить четыре уравнения химической реакции. — Учеба и наука
§ 21. ЭТИЛЕНГЛИКОЛЬ. Токсикологическая химия. В.Ф. Крамаренко
Этиленгликоль (НО—СН 2 —СН 2 —ОН) является одним из представителей двухатомных спиртов, имеющих токсикологическое значение. Это бесцветная маслянистая жидкость (т. кип. 197 °С) сладковатого вкуса. Этиленгликоль смешивается с водой во всех соотношениях, плохо растворяется в диэтиловом эфире, хорошо—в этиловом спирте. Этиленгликоль перегоняется с водяным паром.
Применение. Действие на организм. Этиленгликоль используется в технике в качестве смазки для шарикоподшипников и особенно в качестве антифриза (смеси жидкостей, применяемой для предотвращения замерзания воды, охлаждающей моторы автомобилей). Технический этиленгликоль иногда подкрашивают в винно-красный или другой цвет. Этиленгликоль может поступать в организм через пищевой канал и кожу. В связи с малой летучестью этиленгликоля только незначительные количества его могут поступать в организм с вдыхаемым воздухом. После поступления этиленгликоля в организм он действует как сосудистый и протоплазматический яд, подавляющий окислительные процессы и вызывающий дегенеративные изменения сосудов.
Метаболизм. Метаболизм этиленгликоля является сложным. Основной путь метаболизма этого препарата состоит в том, что он окисляется до альдегида гликолевой кислоты НО—СН 2 —СНО, который дальше окисляется до гликолевой кислоты НО—СН 2 — СООН, разлагающейся на оксид углерода (IV) и муравьиную кислоту. Часть этиленгликоля в организме превращается в щавелевую кислоту, которая может быть причиной повреждения почек в результате отложения оксалатов в почечных канальцах. Оксид углерода (IV), как метаболит этиленгликоля, выделяется из организма с выдыхаемым воздухом. Остальные метаболиты и часть неизмененного этиленгликоля выделяется из организма с мочой.
Выделение этиленгликоля из биологического материала.
Метод выделения этиленгликоля из объектов химико-токсикологического анализа предложен Н. Б. Лапкиной и В. А. Назаренко. Этот метод основан на использовании бензола как селективного переносчика этиленгликоля из объектов в дистиллят. Бензол совместно с парами этиленгликоля и небольшим количеством водяного пара переносится в дистиллят. Вода, которая перегоняется при этом, практически содержит весь этиленгликоль.На исследование берут печень трупа, в которой после отравления содержится больше этиленгликоля, чем в других органах. При острых отравлениях этиленгликолем исследованию подвергают и желудок с содержимым. Методика изолирования этиленгликоля из биологического материала описана ниже. Для изолирования этиленгликоля пользуются аппаратом, представленным на рис. 5.
К 10 г печени или содержимого желудка прибавляют 5 г кристаллической щавелевой кислоты, смесь растирают до получения тонкой кашицы, переносят в круглодонную колбу 1 вместимостью 100 мл и прибавляют 50 мл бензола. Колбу закрывают вертикально поставленным холодильником 3, снабженным приспособлением 2 для улавливания воды. Затем колбу устанавливают на водяную баню и нагревают. Пары бензола и увлекаемые им вода и этиленгликоль конденсируются в холодильнике и попадают в специальное приспособление. Поскольку в этом приспособлении (насадке) бензол (плотностью 0,879) находится сверху воды, он стекает в колбу. Вода и находящийся в ней этиленгликоль остаются в насадке. После окончания отгонки разбирают прибор и пипеткой из насадки отбирают необходимое для анализа количество жидкости.
Обнаружение этиленгликоля.
Для обнаружения этиленгликоля применяют цветные и микрокристаллоскопические реакции. Реакция окисления этиленгликоля периодатом и обнаружение образовавшегося формальдегида. Эта реакция основана на окислении этиленгликоля периодатом натрия или калия. В результате указанной реакции образуется формальдегид, который можно обнаружить при помощи фуксинсернистой кислоты:
При выполнении этой реакции избыток ионов иодата и перио-дата связывают раствором сернистой кислоты, а затем прибавляют фуксинсернистую кислоту. Реакция формальдегида с фуксинсернистой кислотой описана выше (см. гл. IV, § 7).
Выполнение реакции. К 3—5 мл дистиллята прибавляют 5 капель 12 %-го раствора серной кислоты, 5 капель 5 %-го раствора периодата калия в 5 %-м растворе серной кислоты и взбалтывают. Через 5 мин прибавляют 3—5 капель раствора сернистой кислоты, а затем 4 капли раствора фуксинсернистой кислоты.
При наличии этиленгликоля через 3—20 мин появляется красно-фиолетовая или розовая окраска.
Раствор сернистой кислоты (см. Приложение 1, реактив 50).
Раствор фуксинсернистой кислоты (см. Приложение 1, реактив 56).
Окисление этиленгликоля азотной кислотой и обнаружение щавелевой кислоты. При многократном выпаривании этиленгликоля с азотной кислотой образуется щавелевая кислота, которая с солями кальция образует кристаллы оксалата кальция, имеющие характерную форму. Эти кристаллы в ряде случаев появляются через 2—3 суток.
Реакция с сульфатом меди. От прибавления сульфата меди и щелочи к этиленгликолю образуется соединение, имеющее синюю окраску:
Выполнение реакции. К 2—3 мл исследуемого раствора прибавляют 1—2 мл 10 %-го раствора гидроксида натрия и несколько капель 10 %-го раствора сульфата меди. Появление голубой окраски указывает на наличие этиленгликоля в растворе.
Эту реакцию применяют для исследования этиленгликоля в технических жидкостях.
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
Еще по теме:www.xumuk.ru
Практическое пособие по химии
РАБОЧИЕ ТЕТРАДИ |
Продолжение. Начало см. в № 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 26, 28/2004
Многоатомные спирты – это органические
соединения, в молекулах которых содержатся две
или более гидроксильных групп, соединенных с
углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у
разных атомов углерода:
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
Получение
Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:
Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
На производстве глицерин получают по схеме:
Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. – сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
Химические свойства
Этиленгликоль и глицерин подобны одноатомным
спиртам.
Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
Качественная
реакция многоатомных спиртов, позволяющая
отличить соединения этого класса, –
взаимодействие со свежеприготовленным
гидроксидом меди(II). В щелочной среде при
достаточной концентрации глицерина голубой
осадок Cu(OH)
Применение многоатомных спиртов |
УПРАЖНЕНИЯ.
1. Подчеркните структурные формулы многоатомных спиртов:
СlСН2СН2Сl, НОС3Н7, НОСН2СН2ОН, С2Н6О2,
НОСН2СООН, НОСН2СН2СН2ОН, СН3ОСН2СН2ОН.
2. По названиям веществ составьте их структурные формулы:
а) этандиол-1,2; б) этиленгликоль; в) пропандиол-1,2,
г) пропандиол-1,3;
д) глицерин; е) бутантриол-1,2,4.
3. Составьте уравнения реакций
получения этиленгликоля из:
а) этилена; б) 1,2-дибромэтана.
4. Укажите пять областей применения многоатомных спиртов (этиленгликоля и глицерина).
5. Напишите уравнения реакций для цепочки химических превращений, назовите органические вещества:
6. Составьте цепочку химических
превращений получения двухатомного спирта
СН3СНОНСН
предельный углеводород
моногалогенуглеводород
непредельный углеводород дигалогенуглеводород двухатомный спирт.
1. Подчеркнуты структурные формулы многоатомных спиртов:
2. Структурные формулы, составленные по названиям веществ:
3. Реакции получения этиленгликоля:
4. Пять областей применения многоатомных спиртов.
Этиленгликоль (ЭГ) – в антифризах, 66%-й ЭГ
замерзает при –60 °C;
в синтезе лавсана [–СН2СН2О(О)СС(О)O–]n;
растворитель (tкип = 198 °С).
Глицерин – в парфюмерии, косметике,
медицине – растворитель, компонент мазей;
для производства тринитроглицерина –
взрывчатого вещества и лекарства, расширяющего
сосуды.
5. Реакции для цепочки химических превращений:
6. Цепочка химических превращений алкана С3Н8 в пропиленгликоль СН3СНОНСН2ОН через промежуточные вещества заданных классов:
him.1sept.ru
13.8.3. Химические свойства гликолей
Также как и одноатомные спирты, гликоли могут иметь первичные, вторичные и третичные гидроксилы и все, что было сказано о свойствах одноатомных спиртов, относится и к соответствующим гликолям.
Внутримолекулярная дегидратация до сопряженных диенов. Этот тип реакции легко реализуется для гликолей с гидроксильными группами у третичных и вторичных атомов углерода.
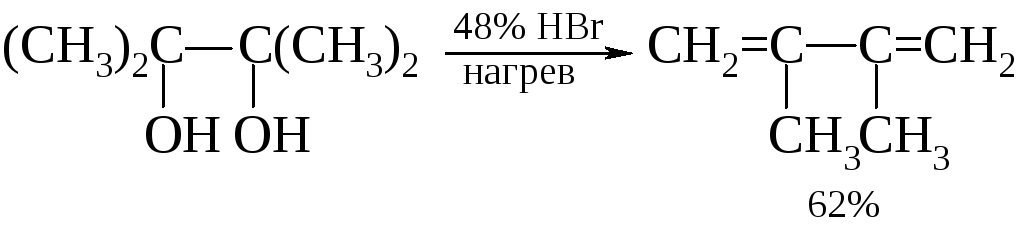
Более эффективно дегидратация идет на оксиде алюминия. Выход составляет от 70 до 85%.
При нагревании этиленгликоля с хлоридом цинка происходит дегидратация с образованием ацетальдегида.
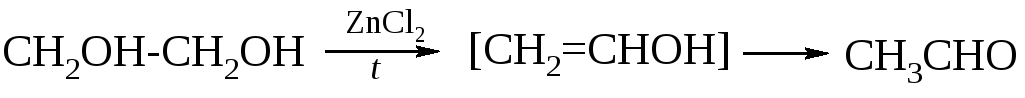
Внутримолекулярная дегидратация, сопровождаемая пинаколиновой перегруппировкой. При действии минеральных кислот 2,3-диметилбутандиол-2,3 (пинакон) претерпевает пинаколиновую перегруппировку и превращается в метил-трет-бутилкетон (пинаколин).
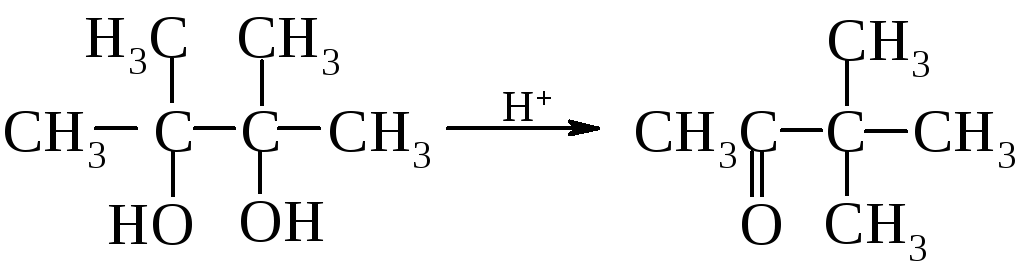
пинакон пинаколин
Предполагается, что пинаколиновая перегруппировка включает две важные стадии. Сначала происходит отщепление воды от протонированного гликоля с образованием карбкатиона (1), а затем протекает перегруппировка карбкатиона с 1,2-метильным сдвигом с образованием протонированного кетона (2).

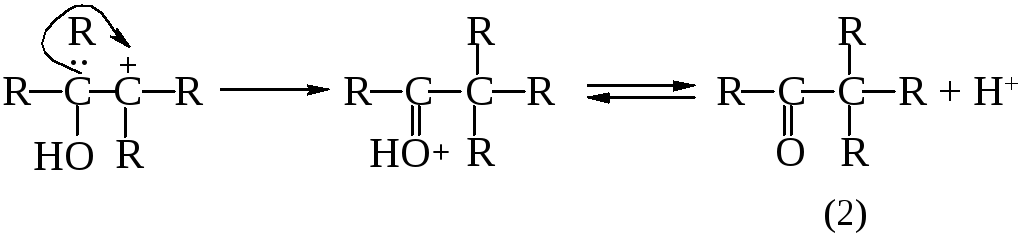
Как и в большинстве случаев 1,2-сдвигов к электронодефицитным атомам углерода, мигрирующая группа ни в какой момент не бывает совершенно «свободной»: она до тех пор не отрывается от «покидаемого» ею атома углерода, пока не образует связи с электронодефицитным центром (3).
 (3)
(3)
Дегидратация с образованием циклических эфиров и эпоксидов. Этиленгликоль и ряд других 1,2-гликолей способны при нагревании с концентрированной серной кислотой или 80%-ной фосфорной кислотой превращаться в 1,4-диоксаны.
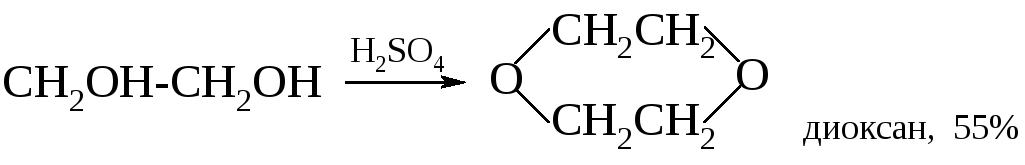
1,4-Диолы и 1,5-диолы превращаются в присутствии каталитических количеств минеральных кислот в тетрагидрофуран и тетрагидропиран. Эти реакции впервые были реализованы А. Фаворским.
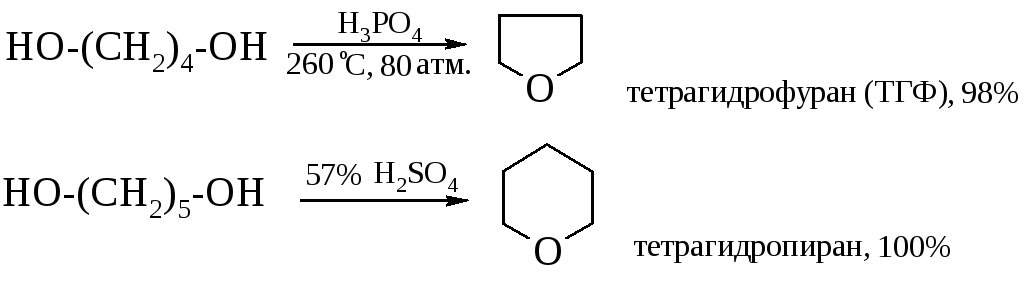
В последние годы ТГФ предпочитают получать гидрированием фурана при 80-140С, а катализаторами служат никель и осьмий или палладий.
Межмолекулярная дегидратация позволяет получить линейные олигомерные эфиры. Как правило, получается смесь эфиров.
7
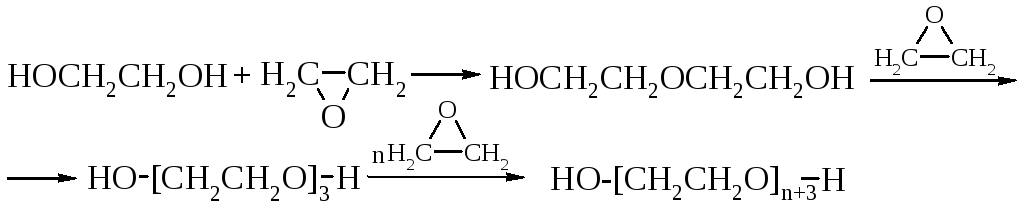
Однако в промышленности ди- и триэтиленгликоль получаются в качестве побочного продукта при синтезе этиленгликоля из оксида этилена.
Кислотные свойства гликолей. Благодаря наличию второй гидроксильной группы, проявляющей –I-эффект, кислотность гликолей, особенно α-гликолей, выше по сравнению с одноатомными спиртами. Поэтому гликоли способны реагировать не только со щелочами, но и с гидроксидами тяжелых металлов с образованием комплексных соединений. В этих соединениях кроме ковалентных связей участвуют и донорно-акцепторные связи.
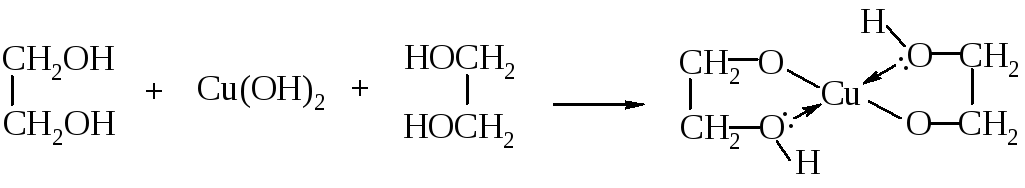
Образование простых и сложных эфиров. Гликоли образуют со спиртами в присутствии минеральных кислот полные и неполные простые эфиры. Они могут быть синтезированы также действием галогеналканов на гликоляты.
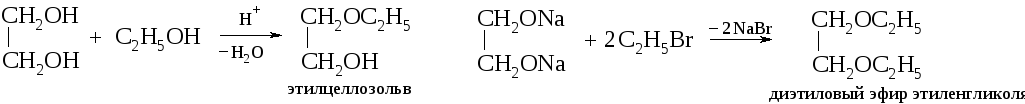
Аналогично спиртам гликоли или гликоляты реагируют с органическими одноосновными кислотами или их производными, образуя сложные эфиры:
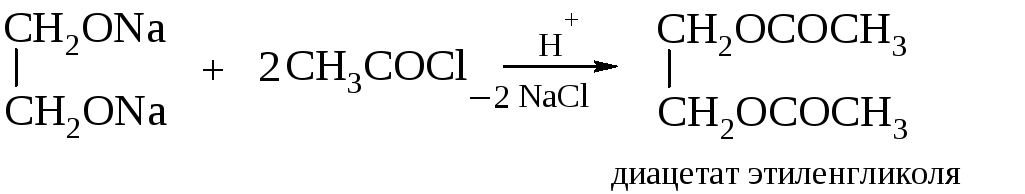
С двухосновными кислотами этиленгликоль образует сложные линейные полимеры.
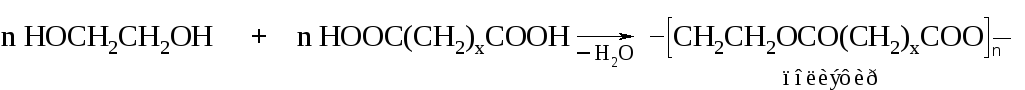
С минеральными кислородсодержащими кислотами гликоли образуют сложные эфиры по одной или обеим гидроксильным группам, например, моно- и динитрогликоли: НОСН2СН2ОNО2 и О2NОСН2СН2ОNО2.
При действии щелочных катализаторов гликоли взаимодействуют с ацетиленом, образуя виниловые и дивиниловые эфиры:
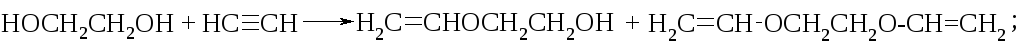
с акрилонитрилом ‑ моно— и бис-цианэтиловые эфиры:
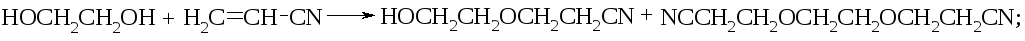 с
эпоксидами при 140-180 С
– ди, три- и полигликоли:
с
эпоксидами при 140-180 С
– ди, три- и полигликоли:
Образование галогенгидринов. При действии галогенводородных кислот гликоли легко превращаются в галогенгидрины. Например, при нагревании пропиленгликоля с хлороводородом образуется смесь хлоргидринов.
HOCH2CH(OH)CH3 + HCl → ClCH2CH(OH)CH3 + HOCH2CH2ClCH3 + H2O
Следует отметить, что вторая гидроксильная группа замещается труднее. Для этой цели хлоргидрины необходимо обрабатывать хлоридом фосфора PCl5 или тионилхлоридом SOCl2.
studfile.net
Формула этиленгликоля в химии
Определение и формула этиленгликоля
ОПРЕДЕЛЕНИЕЭтиленгликоль (этан-1,2-диол ) – сложное кислородсодержащее органическое соединение, двухатомный спирт.
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это сиропообразная структура без цвета и запаха, сладкая на вкус.
По мнению большинства исторических источников, французский химик Вюрц первоначально получил этиленгликоль в 1856. Он обрабатывал йодистый этилен ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
Химические свойства этиленгликоля
- Этиленгликоль реагирует с различными щелочными и щелочно-земельными металлами:
- В реакции с обменивают одну или несколько гидроксильных групп на атомы галогена:
Получение
Этиленгликоль производят из этилена через промежуточное образование этиленоксида. Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
Качественная реакция
Качественной реакцией является взаимодействие спирта со свежеосажденным . Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
Применение
Этиленгликоль в основном используется в составе антифризов , а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ) .
Примеры решения задач
ПРИМЕР 1| Задание | Сколько щавелевой кислоты можно получить из 6,2 г этиленгликоля? |
| Решение | Рассмотрим химическую реакцию получения щавелевой кислоты из двухатомного спирта этиленгликоля:
Из стехиометрии следует, что г |
| Ответ | г |
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Этиленгликоль
Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра ТООНС
Контрольная работа по курсу:
«Основы технологии органического синтеза»
на тему:
Этиленгликоль
Казань
2007
Содержание:
Введение
Физические свойства
Химические свойства
Способы получения этиленгликол
Технологическая схема получения этиленгликоля гидратацией окиси этилена
Технологическая схема совместного получения этиленгликоля и окиси этилена в стационарном слое катализатора
Применение этиленгликоля
Список литературы
Введение
Этиленгликоль — простейший двухатомный спирт ряда гликолей, впервые синтезированный Вюрцем в 1859 г. В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) вырабатывают в очень больших количествах и используют в различных отраслях народного хозяйства.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, растворителей, взрывчатых веществ и пр.
Состав этиленгликоля: С2 Н6 О2 .
Структурная формула:
Н Н
׀ ׀
Н – С – С — Н
׀ ׀
ОН НО
Физические свойства
Этиленгликоль СН2 ОН—СН2 ОН — вязкая бесцветная жидкость со слабым запахом и сладким вкусом. Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления —11,5° С. Плотность 1,11г/см3 ; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с водой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, ксилолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метилового спирта.
Этиленгликоль сравнительно устойчив при высокой температуре — не разлагается при пропускании над пемзой, нагретой до 400°С. Разложение гликоля начинается при 500 — 520°С, а при 550°С происходит уже со значительной скоростью; но даже при этой температуре до 36% этиленгликоля не подвергается разложению.
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при —25°С, а 60%-ный водный раствор при — 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Химические свойства
Химические свойства этиленгликоля, как и других гликолей аналогичны свойствам одноатомных спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполный гликоляты: CH2 ONa — CH2 ONa, CH2 OH — CH2 ONa.
Гликоляты образуются не только со щелочными металлами, но и с оксидами некоторых других металлов, например с гидроксидом меди. При действии щелочи на сульфат меди (II) образуется голубой осадок гидроксида меди (II). Этот осадок не растворяется в спирте, но очень легко на холоде растворяется в гликоле вследствие образования комплексного гликолята меди:
Н
׀

 СН2 ОН СН2 — О О – СН2
СН2 ОН СН2 — О О – СН2 2 ׀ + Cu (OH)2 →׀Cu׀ + 2 H2 O
2 ׀ + Cu (OH)2 →׀Cu׀ + 2 H2 O  СН2 ОН СН2 — О О – СН2
СН2 ОН СН2 — О О – СН2 ׀
Н
2. С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются неполный и полный эфиры этиленгликоля и азотной кислоты — нитраты:
СН2 ONO2

 СН2 ОН +НОNO2 Н2 О + ׀
СН2 ОН +НОNO2 Н2 О + ׀  _ СН2 OH
_ СН2 OH+2HONO2 СН2 ONO2
 СН2 ОН 2Н2 О + ׀
СН2 ОН 2Н2 О + ׀СН2 ONO2
Соответственно можно получить полные и неполные простые эфиры, например диэтиловый эфир этилен гликоля C2 Н5 ОСН2 – СН2 ОС2 Н5 и моноэтиловый эфир СН2 ОН — СН2 ОС2 Н5 . Последний под названием этилцеллозольв применяется как растворитель в производстве нитролаков, бездымного пороха (пироксилина), ацетатного шелка и других производных целлюлозы.
С двуосновными кислотами этиленгликоль ступает реакцию поликонденсации, образуя высокомолекулярные полиэфиры



 HO – C = OOO
HO – C = OOOН2 С – ОН ׀ ׀׀ ׀׀
n ׀ + n R → – OCH2 – CH2 – O – C – R – C – + 2n H2 O
Н2 С – ОН ׀

 HO – C = On
HO – C = On3. Окисление гликолей проходит сложно, ступенчато:
О
׀׀
О СН2 OH – СООН → НООС – С — Н

 СН2 ОН ׀׀ ↓
СН2 ОН ׀׀ ↓ 
 ׀ → С О О СООН
׀ → С О О СООНСН2 ОН ׀ Н ׀׀ ׀׀ ׀
 СН2 OH С — С СООН
СН2 OH С — С СООН׀׀
ֽ ֽ
4. Отщепление воды от этиленгликоля может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции. Пример внутримолекулярного выделения воды:
СН2 ОН — СН2 ОН → [СН2 = СНОН] → СН3 – СНО
Межмолекулярное выделение воды приводит к образованию оксиэфиров (спиртоэфиров) или циклических простых эфиров:
СН2 – СН2
СН2 ОН НО – СН2 СН2 – О – СН2 ׀ ׀
׀ + ׀ → ׀ ׀ → О О
СН2 ОН СН2 ОН СН2 ОН СН2 ОН ׀׀
СН2 – СН2
При межмолекулярной дегидратации этиленгликоля могут быть получены зависимости от условий диэтиленгликоль или диоксан:
СН2 – СН2
׀ ׀
2НОСН2 – СН2 ОН → НОСН2 – СН2 –О-СН2 – СН2 ОН → О О
׀ ׀
СН2 – СН2
Способы получения этиленгликоля
В промышленном масштабе этиленгликоль получают главным образом гидратацией окиси этилена:


 Н2 С – СН2+Н2О СН2 ОН – СН2 ОН
Н2 С – СН2+Н2О СН2 ОН – СН2 ОНО
При гидратации окиси этилена, кроме этиленгликоля, образуются ди-, три-, тетра- и полиэтиленгликоли. Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль окиси этилена берут от 10 до 22 моль воды) и добавляют к водному раствору окиси этилена 0,1—0,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Процесс проводят в жидкой фазе в присутствии катализаторов (небольшое количество кислоты — серной, фосфорной или щавелевой) при 50—100°С и атмосферном давлении или без катализатора — при 10 ат и 190—200° С.
Гидратацию окиси этилена при атмосферном давлении можно проводить, обрабатывая раствором кислоты контактные газы процесса прямого окисления этилена. Получаемый разбавленный раствор этиленгликоля нейтрализуют, отгоняют большую часть воды и далее фракционной перегонкой удаляют остатки воды и высшие гликоли.
В отсутствие катализаторов гидратацию окиси этилена проводят обычно под давлением 10 ат. при мольном соотношении окиси этилена и воды примерно 1 : 16; продолжительность контакта 30 мин. Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания воды около 15% и далее подвергают ректификации. Соковый пар из последнего аппарата конденсируют и конденсат, содержащий 0,5—1,0% этиленгликоля, возвращают на гидратацию свежей окиси этилена. На 1 т этиленгликоля получается примерно 120 кг диэтиленгликоля и 30 кг триэтилен- гликоля.
Общий выход гликолей (считая на окись этилена) при получении их методом гидратации превышает 90%.
mirznanii.com
