Этиленгликоль hcl: Al4C3+HCl=X2+Cl2=CH3Cl+Na=X2=C2H4+KMnO4=этиленгликоль — Химия » OBRAZOVALKA.COM
Теория горения и взрыва (контрольная работа)
Задание № 1
Рассчитать объём воздуха и продуктов горения (в об. %), образующихся при сгорании 10 кг вещества (таблица 2), если горение происходит при заданных условиях (таблица 2) и коэффициенте избытка воздуха a (табл. 2). Объём продуктов горения считать приведённым к заданным условиям.
Табл.2
Номер варианта
Название вещества
Химическая формула
Температура t °С
Давление P, кПа
a
7
Этиленгликоль
С2Н4 (ОН)2
40
110,0
1,7
Решение.
1. Составляем уравнение реакции горения этиленгликоля в воздухе:
С2Н4 (ОН)2 + 2,5 (О2 + 3,76 N2) = 2CО2 + 3Н2О + 2,5×3,76 N2
. Объём воздуха, необходимый для сгорания 1 кг этиленгликоля рассчитываем по формуле:
,
учитывая при этом, что масса одного киломоля этиленгликоля составляет 62 кг/кмоль. Так как горение происходит при заданных условиях, для определения объема, который занимает 1 кмоль воспользуемся уравнением идеальных газов:
,
откуда
, =101,3 кПа,To=273K
(м3/кг)
(м3/кг)
4.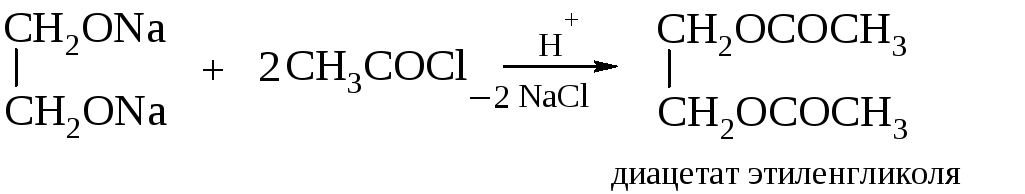 Действительный объём воздуха, пошедшего на сгорание 1 кг этиленгликоля рассчитывается с учётом коэффициента избытка воздуха a:
Действительный объём воздуха, пошедшего на сгорание 1 кг этиленгликоля рассчитывается с учётом коэффициента избытка воздуха a:
(м3/кг)
. Избыток воздуха составит:
(м3/кг)
5. Теоретический объём продуктов горения рассчитываем по формуле:
(м3/кг)
6. Действительный объём продуктов горения составит:
(м3/кг)
7. Объём воздуха практически необходимого для сгорания 10 кг этиленгликоля составит соответственно 77,4 м3 (7,74 × 10), при этом выделится 86,9 м3 продуктов сгорания.
8. Рассчитаем состав продуктов горения.
Учитывая, что горение протекает с избытком воздуха, то при расчёте количества молей продуктов горения учитывается избыточное число молей кислорода и азота ( и ):
nобщ = =
=
.
Ответ: на сгорание 10 кг этиленгликоля необходимо 77,4 м3 воздуха, при этом образуется 86,9 м3 продуктов горения, из которых СО2 — 8,8 %, Н2О — 13,2 %, N2 — 70,3 %.
Задание №2
Определить объём и состав продуктов горения (в об. %) смеси газов (табл. 4), если горение происходит при коэффициенте избытка воздуха.
%) смеси газов (табл. 4), если горение происходит при коэффициенте избытка воздуха.
Табл.4
Состав смеси, %
Номер варианта
7
Оксид углерода
—
Водород
—
Метан
—
Этан
24
Пропан
—
Бутан
—
Этилен
16
Пропен
—
Ацетилен
10
Углекислый газ
10
Азот
15
Кислород
25
a
1,2
Решение.
1. Составляем уравнения реакций горения смеси горючих газов в воздухе:
C2H5Cl + 3(O2 + 3,76 N2) = 2 CO2 + 2 h3O + HCl + 3 × 3,76 N2h5S + 6(O2 + 3,76 N2) = 4 CO2 + 2 h3O + SO2 + 6 × 3,76 N2Nh3 + 2,25 (O2 + 3,76 N2) = CO2 + 2,5 h3O + 0,5 N2 + 2,25 × 3,76 N2
2. Рассчитаем теоретические объёмы воздуха и продуктов горения при полном сгорании 1 м3 газовой смеси по формуле:
(м3/м3)
3. Рассчитаем действительные объёмы воздуха и продуктов горения с учётом 20 % — ного избытка воздуха (a = 1,2).
(м3/м3)
(м3/м3)
4. Рассчитаем состав продуктов горения.
Учитывая, что горение протекает с избытком воздуха, то при расчёте количества молей продуктов горения учитывается избыточное число молей кислорода и азота ( и ):
nобщ = =
=
.
Ответ: На сгорание 1м3 смеси газов заданного в условии состава требуется 7,55 м3 воздуха, при этом образуется 12,91м3 продуктов горения, из которых углекислый газ и пары воды составляют по 11,03%, а азот 74,64 % от общего объема.
Задание №3
горение воздух этиленгликоль пропанол
Методом последовательных приближений рассчитать адиабатическую температуру горения для стехиометрической смеси горючего вещества с воздухом (табл. 6)
Табл. 6
Номер варианта
Горючее вещество
Химическая формула
7
Пропилацетат
С5Н10О2
Решение.
1. Составляем уравнение реакции горения пропилацетата в воздухе:
С5Н10 О2 + 6,5 (О2 + 3,76 N2) = 5CО2 + 5Н2О + 6,5×3,76 N2
2. Объём продуктов горения составляет:
Объём продуктов горения составляет:
Таким образом, общий объём продуктов горения
.
. Теплота образования пропилацетата в справочниках отсутствует, поэтому ее рассчитаем. По закону Гесса, теплота реакции равна сумме теплот образования продуктов реакции за вычетом теплот образования исходных веществ.
Поэтому записываем реакцию образования пропилацетата:
COOH + C3H7OH = Ch4COOC3H7 + h3O
Далее по справочнику определяем теплоту образования уксусной кислоты, пропилового спирта, воды (жидк.):
ΔQобр(Ch4COOH) = 484.2 кДж/моль ΔQобр(C3H7OH) = 307.19 кДж/моль ΔQобр(h3O) = 286.3 кДж/моль Теплота реакции этерификации ΔQ(реакц) = 8.9 кДж/моль.
ΔQ(реакц) = ΔQобр(h3O) + ΔQобр(Ch4COOС3Н7) — ΔQобр(Ch4COOH) — ΔQобр(C3H7OH) ,
откуда теплота образования пропилацетата:
ΔQобр(Ch4COOС3Н7) = ΔQобр(Ch4COOH) + ΔQобр(C3H7OH) — Qобр(h3O) + ΔQ(реакц)=484.2+307.19-286.3-8.9=496,19 кДж/моль.
Так как |ΔQ|=|-ΔH|, следовательно ΔH = -496,19кДж/моль
. Подставляя полученные данные, рассчитаем низшую теплоту сгорания пропилацетата по следствию из закона Гесса:
Подставляя полученные данные, рассчитаем низшую теплоту сгорания пропилацетата по следствию из закона Гесса:
5. Так как теплопотери отсутствуют, то всё выделившееся тепло идёт на нагрев продуктов горения. Среднее теплосодержание 1 моля продуктов горения Нср будет составлять:
(кДж/моль)
6. Воспользовавшись зависимостью теплосодержания газов от температуры (табл. IX приложения к методическим рекомендациям), можно установить какой температуре соответствует такое теплосодержание. Лучше всего это сделать , ориентируясь на азот, так как его больше всего в продуктах горения. Из табл. IX видно, что при температуре 1900°С теплосодержание азота 63,1 кДж/моль. Уточним, сколько потребовалось бы тепла, чтобы нагреть продукты горения до такой температуры. При Т1 = 1900 °С
(кДж/моль)
Но это больше, чем выделилось тепла в результате реакции горения , поэтому можно сказать, что температура горения меньше, чем 1900 °С. Определим, сколько потребуется тепла для нагревания продуктов горения до 1700 °С.
Но и , значит Тг < 1700°С
При температуре 1600°С
уже меньше, чем , из этого можно сделать вывод, что температура горения этанола имеет значение между 1700 и 1600°С. Уточним эту температуру линейной интерполяцией между двумя этими ближайшими значениями:
или 1934,3 К
Ответ: адиабатическая температура горения пропилацетата составила 1934,3 К
Задание №4
Рассчитать, какое минимальное количество горючей жидкости (табл. 8) должно испариться в закрытом помещении объёмом Vп при нормальных условиях, чтобы создалась взрывоопасная концентрация горючих паров. Условно принять, что пары горючей жидкости равномерно распределены в объёме помещения. Нижний концентрационный предел распространения пламени рассчитать по предельной теплоте сгорания.
Табл.8
Номер варианта
Название горючей жидкости
Химическая формула
Объём помещения, м3
7
Пропанол
С3Н7ОН
800
Решение.
. Составляем уравнение реакции горения пропанола в воздухе:
Составляем уравнение реакции горения пропанола в воздухе:
С3Н7ОH + 4,5 (О2 + 3,76 N2) = 3 СО2 +4 Н2О + 4,5 *3,76 N2
2. Рассчитываем низшую теплоту сгорания пропанола по закону Геса ( теплоты образования веществ взяты из приложения к методическим рекомендациям):
Qн = 396,9×7 + 242,2×7 — 307,19 = 1853,1 кДж/моль (справочные данные 1852 кДж/моль).
3. Поскольку предельная теплота сгорания выражена в кДж/м3 и составляет 1830 кДж/м3, то и низшую теплоту сгорания выражаем в кДж/м3, учитывая что объём одного моля пропанола при нормальных условиях составляет 0,0224 м3:
. Рассчитываем НКПРП пропанола, учитывая что предельная теплота сгорания для большинства горючих веществ одинакова и равна 1830 кДж/м3:
. Рассчитываем объём паров пропанола, необходимого для создания НКПРП в ёмкости объёмом 800м3:
. Рассчитываем количество пропанола, при испарении которого в ёмкости объёмом 800 м3 создаётся минимальная взрывоопасная концентрация (т. е. НКПРП), учитывая, что 1 моль пропанола (М = 60 г/моль) при нормальных условиях занимает объём 0,0224 м3:
е. НКПРП), учитывая, что 1 моль пропанола (М = 60 г/моль) при нормальных условиях занимает объём 0,0224 м3:
Ответ: для образования в ёмкости объёмом 800 м3 минимальной взрывоопасной концентрации пропанола в ней должно испариться 46,5 кг вещества.
Задание №5
Рассчитать температуру вспышки или температуру воспламенения горючей жидкости (табл. 12) по формуле В.И. Блинова. Сравнить найденное значение с экспериментальным, взятым из справочника.
Табл. 12
Номер варианта
Название жидкости
Химическая формула
Определяемый параметр
7
Бутанол
С4Н9ОН
Температура воспламенения
Решение.
. Для решения задачи по формуле В.И. Блинова необходимо иметь значение коэффициента n — число молей кислорода, необходимое для полного сгорания одного моля паров бутанола, для чего записываем уравнение реакции горения бутилового спирта:
H9OH + 6(О2+ 3,76N2) = 4СО2 + 2Н2О + 6·3,76N2, откуда n = 6.
2. Из формулы В.И. Блинова
вычислим произведение
,
где D0 определяем по таблице IV приложения к методическим рекомендациям. D0=0.0681(м2/с)
При определении Твосп параметр А = 53,3 (К×Па.м2)/с, поэтому
. Найдем такую температуру, при которой произведение РТ будет равно 1304,5 кПа·К. Тогда найденное значение температуры будет соответствовать температуре воспламенения.
Воспользуемся для этого зависимостью давления насыщенного пара от температуры жидкости, приведенной в таблице XI приложения к методическим рекомендациям. Для бутанола при Т1 = 314,5 К давление паров составляет Р1 = 2,666 кПа, а Р1Т1 =838,46 кПа×K. Это меньше, чем РвоспТнп. При Т2 = 326,4 К давление паров Р2 = 5,332 кПа, а Р2Т2= =1740,37 кПа×К. Это уже больше, чем РвоспТнп. Значит, Твосп имеет значение между Т1 и Т2. Найдём его методом интерполяции:
Сравнение полученного значения с экспериментальным (314 К) показывает, что погрешность расчета по формуле В. И. Блинова для бутанола составляет 6,7 К.
Блинова для бутанола составляет 6,7 К.
Ответ: температура воспламенения бутанола 320,7 К.
Скачать архив (22.9 Kb)
Схожие материалы:
Китай химического производства питания Meg/Моно Этиленгликоль CAS: 107-21-1
Продукты с возможностью горячей замены
| Имя | CAS |
| 1-BOC — 4-(4-FLUORO-PHENYLAMINO)-PIPERIDINE | 288573-56-8 |
| 2-Oxiranecarboxylicacid, 3-(1,3-benzodioxol-5-yl)-2-метил-, этиловый эфир(ПМК масла ) | 28578-16-7 |
| N-БП-4-Piperidone | 79099-07-3 |
| Трет-4-((4)bromophenyl аминокислот)piperidine-1-carboxylate | 443998-65-0 |
| N-Бензил-4-piperidone | 3612-20-2 |
| N-Benzylpropan-2-Амин | 102-97-6 |
| 1-(бензо[d][1,3] dioxol-5-yl)-2-bromopropan-1 — один из | 52190-28-0 |
| Диэтиловый(phenylacetyl)malonate(BMK масла) | 20320-59-6 |
| Спирт этиловый ректификованный 2-Phenylacetoacetate (BMK масла) | 5413-05-8 |
| 2-(2-Chlorophenyl)-2-nitrocyclohexanone | 2079878-75-2 |
| 2-бромо-1-над фенилпропаноламином ограничит воз-PENTAN-1 — один из | 49851-31-2 |
| 2-бромо-4′-Methylpropiophenone | 1451-82-7 |
| 2-Iodo 1-(4-methylphenyl)-1-propanone | 236117-38-7 |
| Procaine базы | 59-46-1 |
| Procaine HCL | 51-05-8 |
| Лидокаина | 137-58-6 |
| Лидокаина HCL | 73-78-9 |
| Benzocaine | 94-09-7 |
| Benzocaine HCL | 23239-88-5 |
| Prilocaine | 721-50-6 |
| Tetracaine HCL | 136-47-0 |
| Красный фосфор | 7723 14 0 |
описание продукта
| Название продукта | Мэг |
| CAS не | 107-21-1 |
| Apperance | Бесцветная жидкость |
| Puirty | 99,5%мин |
| Пункт | Предметный указатель | |||||
| Внешний вид | Внешний вид вязкой жидкости | |||||
| Плотность (20ºC) | 1.020-1.026 | |||||
| Кислотность, % | 0.0075 Max | |||||
| Влажность в % | 0,2 макс | |||||
| Пожнивные остатки, % | 0.008 Max | |||||
| Цвет (Pt-Co) | 10 Max | |||||
| Содержание, % | 99.5мин | |||||
| Раствор хлористого кальция, частей на миллион | 5 Макс. | |||||
| Показатель преломления | 1.436-1.440 | |||||
Этиленгликоль — это ясно, бесцветной густеют жидкости. Главная опасность — опасность для окружающей среды. Незамедлительные меры должны быть приняты для ограничения его распространения в среде. Поскольку этиленгликоля является жидкий этиленгликоль может легко проникать в почву и загрязнению грунтовых вод и близлежащих потоками.
Подробные фотографии
Упаковка и доставка
Профиль компании
Часто задаваемые вопросы
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 производителей и поставщиков.
 — Цена
— ЦенаМоностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4
Китай Этиленгликоль моностеарат (EGMS) или гликоль стеарат CAS 111-60-4 завод, Поставщик, Производитель в Китае.
Синонимы: 2-гидроксиэтилстеарат
Номер CAS: 111-60-4
Характеристики: твердые чешуйки от белого до светло-желтого цвета.
Молекулярная формула: C20h50O3, RCOOCh3Ch3OH
Формула структуры:
Ключевые слова: моностеарат этиленгликоля (EGMS) или стеарат гликоля
Код ТН ВЭД: 3402130000
Описание:
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 представляет собой органическое соединение с молекулярной формулой C20h50O3. Это сложный эфир стеариновой кислоты и этиленгликоля. Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 используется в качестве ингредиента во многих видах товаров личной гигиены и косметики, включая шампуни, кондиционеры для волос и лосьоны для кожи.
Этот продукт является хлопьевидным эмульгатором. Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 может быть перламутровым средством для шампуней, гелей для душа и жидкого мыла. В то же время он также является вторичным эмульгатором и солюбилизатором для косметических составов.
CAS: 111-60-4, 627-83-8
Свойства:
Внешний вид: при 25 ° C этиленгликольмоностеарат (EGMS) или гликолевый стеарат CAS 111-60-4 представляет собой белые чешуйки или шарики.
Кислотность 5 максимум; Значение омыления 180-188;
Йодное значение 2,0 Максимум;
Температура плавления 57-63 ° С;
pH (3% дисперсия) при 25 ° C: 4,0-6,0
Удельный вес при 25 ° C: 0,9600 Прибл.
Хранение: Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 рекомендуется упаковывать в плотно закрытые контейнеры. Держать контейнер плотно закрытым. Хранить в сухом, прохладном месте и защищать от влаги.
Как наиболее известный китайский поставщик в Китае, этиленгликольмоностеарат (EGMS) или гликолевый стеарат CAS 111-60-4, входящий в группу Fengchen, хорошо упакован в новейшую и самую безопасную упаковку.
Функции и преимущества:
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 обладает прекрасным перламутровым эффектом и превосходной загущающей способностью.
Он также имеет хорошую совместимость с другими поверхностно-активными веществами;
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 не вызывает раздражения кожи и не повреждает волосы;
Другое преимущество этого продукта состоит в том, что его легко биодеградировать, скорость разложения составляет 97 процентов в минуту;
Отгрузка и доставка: Fengchen Group является одним из самых известных в Китае производителей этиленгликоля моностеарата (EGMS) или гликоля стеарата CAS 111-60-4, наша доставка профессиональна и относительно быстра.
Использование и применение
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 в основном используется для приготовления жидких моющих средств, таких как шампунь, ванна, лосьон для рук, увлажняющий крем и т.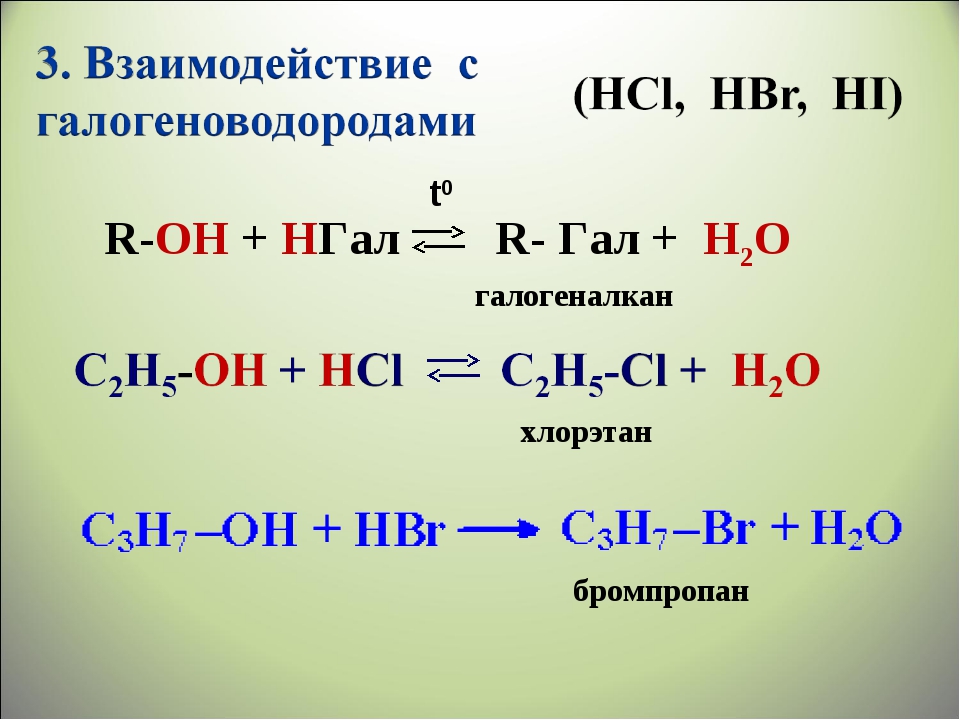 Д .; Применяется в качестве моющих средств для обработки металла. Другое применение — область обработки волокна.
Д .; Применяется в качестве моющих средств для обработки металла. Другое применение — область обработки волокна.
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 используется для лечения, контроля, предотвращения и улучшения следующих заболеваний, состояний и симптомов:
Перламутровый агент для перламутровых шампуней; Очищающие кремы; Жидкое мыло; Гели для ванн.
Моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 можно использовать в других целях.
Fengchen Group является ведущим поставщиком и производителем моностеарата этиленгликоля (EGMS) в Китае или стеарата гликоля CAS 111-60-4. Мы специализируемся на оптовых и оптовых партиях, обеспечивая, чтобы все наши клиенты имели право производителя и поставщика Китай этиленгликоля моностеарата (EGMS) или гликоля стеарата CAS 111-60-4, когда им это необходимо. Если вы собираетесь купить или приобрести моностеарат этиленгликоля (EGMS) или стеарат гликоля CAS 111-60-4 из Китая, обращайтесь в Fengchen Group.
Побочные эффекты:
Раздражение может быть побочной реакцией.
Сертификат анализа (COA, TDS):
Высокое качество этиленгликоль моностеарат (EGMS) или гликоль стеарат CAS 111-60-4 завод, поставщик, производитель в Китае.
Если вы ищете моностеарат этиленгликоля (egms) или стеарат гликоля cas 111-60-4, обращайтесь к нам. Мы являемся одним из ведущих и профессиональных китайских производителей и поставщиков в этой области. Конкурентоспособная цена и хорошее послепродажное обслуживание.Hot Tags: моностеарат этиленгликоля (egms) или стеарат гликоля cas 111-60-4, производители, поставщики, цена
Спирты — химические свойства, формулы и получение
Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
реакции окисления — с отщеплением водорода.

Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
Взаимодействие со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2.Взаимодействие со щелочами: С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
проводят реакцию в кислой среде;
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
применяют кислоты Льюиса.
R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O.Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O.Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
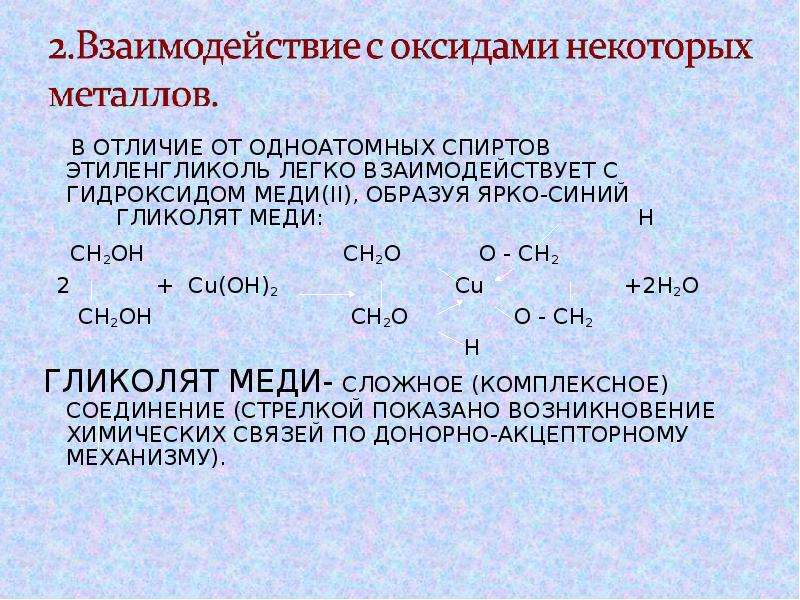
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
Окисление йодной кислотой и ее солями
Образование эфиров с азотной кислотой
Вопросы для самопроверки
Что такое спирты?
Что образуется при межмолекулярной дегидратации спиртов?
Какую качественную реакцию имеют многоатомные спирты?
Какой характерной реакцией можно получить этанол?
Напишите все виды изомерии для пентанола-1.
Как классифицируют спирты?
Лекция № 10. Гидроксилпроизводные углеводородов
Лекция № 10
ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
План
- Методы получения спиртов.
- Химические свойства спиртов.

- Многоатомные спирты.
- Фенолы. Методы получения.
- Фенолы. Химические свойства.
- Простые эфиры.
Лекция № 10
ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
План
- Методы получения спиртов.
- Химические свойства спиртов.
- Многоатомные спирты.
- Фенолы. Методы получения.
- Фенолы. Химические свойства.
- Простые эфиры.
Гидроксилпроизводные содержат в молекуле одну или
несколько групп ОН. Гидроксилпроизводные, содержащие связь , называют спиртами. Соединения,
содержащие группу ОН при двойной связи, называют енолами, в ароматическом
кольце – фенолами.
1. Методы получения
спиртов.
- Гидролиз галогенпроизводных:
- Гидратация алкенов:
- Восстановление карбонильных
соединений:
[H]: H2/кат., кат. – Ni, Pt,
Pd;
LiAlH4; NaBH4 .![]()
2. Химические свойства
спиртов.
Реакции спиртов определяются присутствием группы ОН и протекают по следующим
основным направлениям.
- Замещение водорода ОН группы под действием оснований (кислотные
свойства). - Взаимодействие с электрофильными реагентами по атому кислорода с
неподеленной парой электронов (основные и нуклеофильные свойства). - Взаимодействие с нуклеофильными реагентами
по a -углеродному атому, несущему частичный положительный заряд (реакции
нуклеофильного замещения ОН группы). - Дегидратация (участвуют связь С-Н в b -положении и связь
С-О). - Окисление (участвуют связь С-Н в a -положении и
связь О-Н).
Кислотные свойства
Спирты взаимодействуют с активными металлами (Na, K, Mg, Al и др.) с
образованием алкоголятов:
C2H5OH + Na ® С2H5O—Na+ + 0,5
H2
этилат
натрия
3(СH3)2CHOH + Al ® ((CH3)2CHO)3Al + 1,5 H2
изопропилат
алюминия
Алкоголяты образуются также при
действии на спирты сильных оснований:
При
взаимодействии спиртов со щелочами равновесие сдвинуто в сторону гидролиза
алкоголятов, так как спирты являются более слабыми кислотами, чем вода:
Кислотность спиртов уменьшается в ряду:
CH3OH | первичный | вторичный | третичный | |
pKa | 15,2 | ~16 | ~16,5 | ~17 |
Основные и нуклеофильные свойства
спиртов
Спирты взаимодействуют с протонными кислотами и кислотами Льюиса с
образованием оксониевых соединений:
Образование оксониевых соединений играет важную роль в
процессах замещения гидроксильной группы.
Нуклеофильные свойства спиртов проявляются в их
реакциях с карбоновыми и неорганическими кислотами и их производными с
образованием сложных эфиров:
Спирты – слабые нуклеофилы. Для увеличения
нуклеофильности их превращают в алкоголяты, которые способны взаимодействовать с
галогенпроизводными с образованием простых эфиров:
R-Hal + R/O—Na+® R-OR/ + NaHal
Однако алкоголят-ионы не только сильные нуклеофилы, но и
сильные основания. Поэтому их взаимодействие с алкилгалогенидами может привести
как к замещению, так и к элиминированию в зависимости от температуры и структуры
алкилгалогенида и алкоголята. Например, для получения метилизопропилового эфира
необходимо использовать метилиодид и
изопропилат-анион, а не изопропилиодид и метилат-анион, так как в последнем
случае будет доминировать реакция отщепления:
Реакции нуклеофильного замещения ОН
группы
Протекание реакции по схеме:
невозможно, поскольку
гидроксид-анион – это сильное основание и плохая уходящая группа. Для проведения
Для проведения
SN-реакций в спиртах необходимо
предварительно модифицировать ОН группу, превратив ее в хорошую уходящую группу.
Для этого спирты переводят в оксониевые соединения или эфиры неорганических
кислот:
В биохимических процессах замещение ОН группы
протекает через стадию превращения спиртов в эфиры фосфорной, дифосфорной и
трифосфорной кислот, анионы которых являются чрезвычайно легко уходящими
группами:
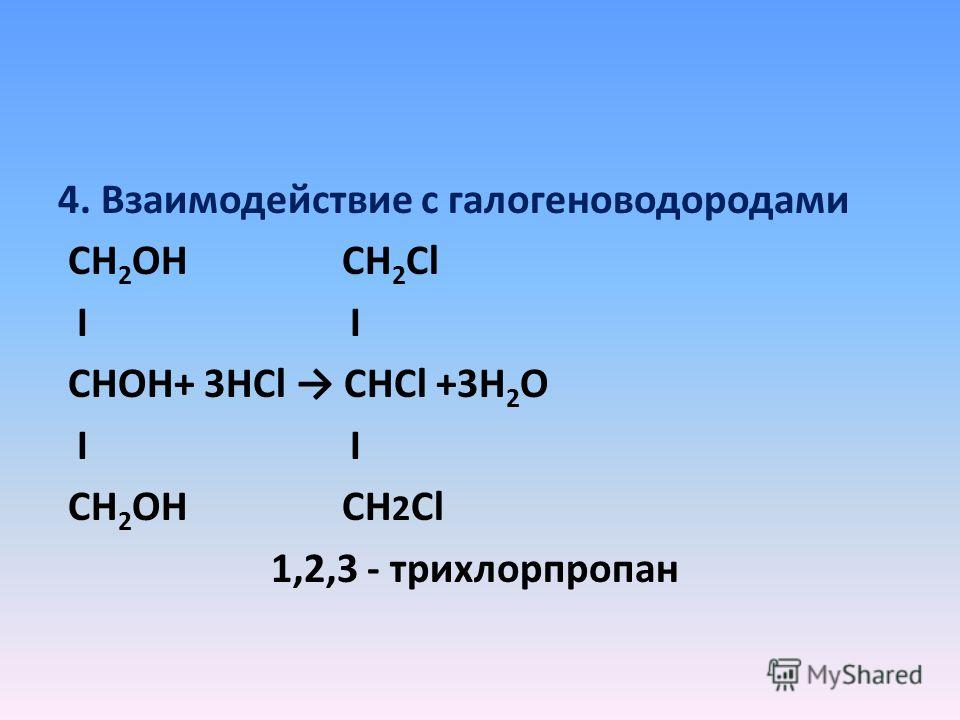
Замещение ОН группы на галоген
Спирты взаимодействуют с галогеноводородами и галогенидами фосфора и серы с
образованием галогенпроизводных.
1. Действие галогеноводородов.
- R-OH + HHal ® R-Hal + H2O
Реакция протекает через стадию протонирования ОН группы с
последующим нуклеофильным замещением по механизму SN1 или SN2.
Первичные
спирты реагируют по механизму SN2. Реакция идет медленно, так как в протонных
Реакция идет медленно, так как в протонных
растворителях (вода, спирты) галогенид-ионы – слабые нуклеофилы. Вторичные и
третичные спирты реагируют по механизму SN1. Таким образом, реакционная способность спиртов
возрастает в ряду:
первичный
Реакционная
способность галогеноводородов увеличивается в ряду:
HCl
параллельно с возрастанием силы кислот и нуклеофильности
галогенид-анионов. Однако HI не может быть использована, так как легко
восстанавливает спирты до углеводородов. HBr реагирует с первичными, вторичными
и третичными спиртами. HCl действует только на третичные спирты.
Для вторичных и первичных спиртов требуется
присутствие катализатора – кислоты Льюиса.
2. Действие галогенидов фосфора и
серы.
Замещение ОН группы
действием PBr3, PCl5, POCl3,
PI3, SOCl2 основано на
предварительном превращении спирта в эфиры кислот фосфора и серы, которые затем
атакуются галогенид-анионом.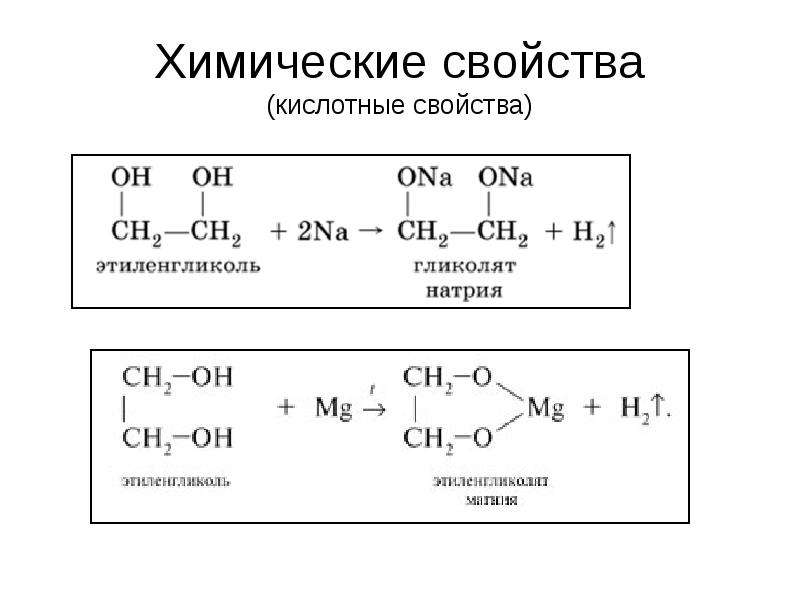
ROH + SOCl2® RCl + SO2 +
HCl
ROH + PCl5® RCl + POCl3 + HCl
3ROH + PBr3® 3RBr +
H3PO3
Образование простых эфиров
При нагревании спиртов в присутствии серной кислоты происходит замещение ОН
группы на группу OR и образуются простые эфиры.
Реакция
протекает через стадию протонирования спирта с последующим нуклеофильным
замещением, в котором одна молекула спирта (протонированная) выполняет роль
субстрата, а вторая – нуклеофила.
Дегидратация спиртов
При нагревании в присутствии кислотных катализаторов спирты отщепляют воду с
образованием алкенов.
Реакции дегидратации (элиминирования) протекают
параллельно с образованием простых эфиров (замещением). Дегидратации
способствует высокая температура. Например:
Склонность спиртов к дегидратации возрастает в
ряду: первичный
При дегидратации спиртов соблюдается правило
Зайцева.
Окисление спиртов
Под окислением в органической химии понимают процессы, приводящие к обеднению
субстрата водородом или к обогащению его кислородом. Окисление спиртов
осуществляют при помощи двух основных приемов – дегидрирования и действия
окислителей.
Дегидрирование
Первичные и вторичные спирты отщепляют водород при
нагревании в присутствии медно-серебряного катализатора с образованием
карбонильных соединений.
Третичные спирты в таких условиях не реагируют,
а в более жестких – разрушаются.
Действие окислителей
Для окисления спиртов используют
KMnO4, Na2Cr2O7,
CrO3.
Первичные спирты окисляются до альдегидов,
которые далее легко окисляются до карбоновых кислот.
Реакцию можно остановить на стадии альдегида, если
использовать кислый раствор дихромата натрия и отгонять образующийся альдегид из
реакционной смеси:
Вторичные спирты окисляются до кетонов под
действием KMnO4 или
Na2Cr2O7.
Окисление третичных спиртов протекает в жестких
условиях и сопровождается деструкцией углеродного скелета.
3. Многоатомные спирты.
Атомность спиртов определяется количеством
гидроксильных групп. Двухатомные спирты содержат две гидроксильные группы и
носят общее название диолы или гликоли. Трехатомные спирты
называют триолами или глицеринами. Простейшие и наиболее важные
представители диолов и триолов – этиленгликоль и глицерин.
Этиленгликоль (этандиол-1,2).
Этиленгликоль получают из этилена по следующим
схемам.
Химические свойства этиленгликоля аналогичны
свойствам одноатомных спиртов. Однако есть ряд специфических свойств,
обусловленных присутствием двух гидроксильных групп.
Этиленгликоль является более сильной кислотой,
чем одноатомные спирты (рКа=15,1) и образует в водных растворах
комплексные алкоголяты с ионами тяжелых металлов.
Появляющееся при этом ярко-синее окрашивание
позволяет использовать реакцию как качественную на диольный фрагмент.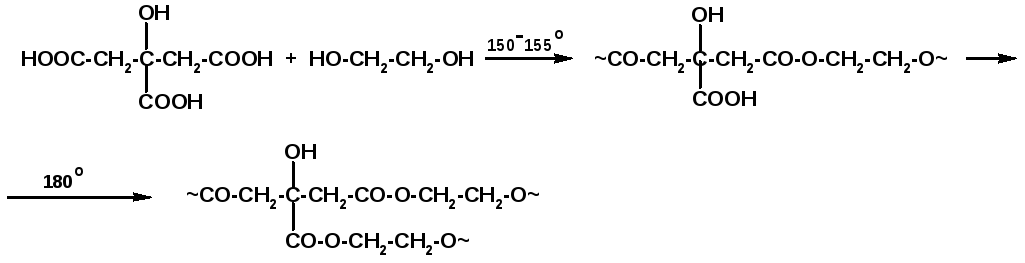
При дегидратации этиленгликоля в зависимости от
условий реакции образуются разные продукты. При нагревании в присутствии серной
кислоты происходит межмолекулярная дегидратация с образованием циклического
простого эфира – диоксана. Нагревание с хлоридом цинка дает продукт
внутримолекулярной дегидратации – ацетальдегид.
Этиленгликоль легко окисляется. В зависимости от
природы окислителя могут образоваться гликолевый альдегид, глиоксаль,
глиоксиловая кислота, щавелевая кислота.
Этиленгликоль используется для приготовления
антифризов; для получения растворителей (простые эфиры этиленгликоля, диоксан) и
полимеров (полиэфиров).
Глицерин (1,2,3-
пропантриол).
Глицерин получают гидролизом жиров (см. лек.
№18), но в основном синтетическим путем из пропилена.
Глицерин дает все реакции, известные для
спиртов. Наличие трех гидроксильных групп обуславливает некоторые специфические
свойства.
Глицерин является более сильной кислотой, чем
одноатомные спирты (рКа=14) и, подобно этиленгликолю, образует
хелатные комплексы с ионами металлов.
При дегидратации глицерина образуется
ненасыщенный альдегид акролеин.
Мягкое окисление глицерина дает смесь
глицеринового альдегида и дигидроксиацетона.
Важное значение имеют сложные эфиры глицерина.
При действии на глицерин азотной кислоты в присутствии серной кислоты образуется
тринитрат глицерина (нитроглицерин).
Нитроглицерин используется в производстве
взрывчатых веществ. В малых концентрациях нитроглицерин применяется как
сосудорасширяющее средство.
При действии на глицерин фосфорной кислоты
образуется смесь a — и b -глицерофосфатов.
Глицерофосфаты являются структурными
компонентами фосфолипидов.
Сложные эфиры глицерина и высших жирных кислот –
основная составная часть природных жиров и масел (см. лек. №18).
Примерами многоатомных спиртов, содержащих
четыре, пять и шесть гидроксильных групп, могут служить соответственно эритриты, пентиты и гекситы (см. лек. №17)
лек. №17)
4. Фенолы. Методы
получения.
1. Сплавление солей сульфоновых кислот со
щелочами.
2. Щелочной гидролиз хлорбензола.
3. Замещение диазогруппы на гидроксил (см.
также лек. №13).
4. Кумольный метод.
5. Фенолы. Химические
свойства.
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, что обусловлено
стабилизацией фенолят аниона за счет делокализации отрицательного заряда по
ароматическому кольцу (см. лек. №4). Для сравнения приведем величины
рКа в воде при 25оС для фенола (10,00), для циклогексанола
(18,00).
Фенолы являются более сильными кислотами, чем
вода, поэтому феноляты, в отличие от алкоголятов, могут быть получены из фенолов
действием водных растворов щелочей.
Карбоновые кислоты и большинство неорганических
кислот, например, угольная, превосходят по кислотности фенол, что используется
для выделения фенола из щелочных растворов.
C6H5O— Na+ + CO2 +
H2O ® C6H5OH +
NaHCO3
Электроноакцепторные
заместители в ароматическом кольце увеличивают, а электронодонорные – уменьшают
кислотность фенолов. Так, 2,4,6-тринитрофенол (пикриновая кислота) по
кислотности (рКа= 0,4) сравним с карбоновыми кислотами.
Нуклеофильные свойства
фенолов
Фенолы являются более слабыми нуклеофилами, чем
спирты, что связано со значительным снижением электронной плотности на атоме
кислорода вследствие сопряжения ОН группы с ароматическим кольцом.
Как слабые нуклеофилы, фенолы очень медленно
реагируют с карбоновыми кислотами. Поэтому сложные эфиры фенолов не могут быть
получены реакцией этерификации. Для их получения необходимы более активные
ацилирующие реагенты – ангидриды и хлорангидриды (см. лек. №12)
ArOH
+ RCOX ® RCOOAr + HX
X=Cl, OCOR
Для увеличения нуклеофильности фенолы переводят в
феноляты, которые легко алкилируются и ацилируются с образованием соответственно
простых и сложных эфиров.
ArO—Na+ + RBr ® ArOR + NaBr
ArO—Na+ + RCOCl ® RCOOAr + NaCl
Реакции электрофильного замещения в
ароматическом кольце фенолов
Гидроксильная группа относится к числу групп, активирующих электрофильное
замещение в ароматическом кольце и направляющих заместитель в орто- и пара-
положения. Активирующее влияние гидроксильной группы настолько сильно, что в
отдельных случаях реакцию трудно остановить на стадии введения только одного
заместителя. Фенолы вступают практически во все типичные реакции электрофильного
замещения как с сильными, так и со слабыми электрофильными агентами.
Фенол легко бромируется бромной водой с образованием трибромфенола.
Нитрование фенолов разбавленной 20-25%-ной
азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов.
Сульфирование фенола серной кислотой дает смесь
орто- и пара-изомеров гидроксибензолсульфоксилоты. При 20оС в
реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при
120оС доля пара-изомера возрастает до 96%.
Изменение в соотношении продуктов сульфирования
обусловлено обратимостью реакций сульфирования, когда в равновесии преобладает
термодинамически более стабильный пара-изомер. Сульфирование в орто-положение
протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко
гидролизуется на исходные реагенты в отличие от пара-изомера, для которого
скорость гидролиза мала.
Феноляты в реакциях электрофильного замещения
еще более реакционноспособны, чем фенолы (влияние +I- и +M-эффектов группы
О—). Они взаимодействуют даже с
таким слабым электрофилом, как СО2. При нагревании сухого фенолята натрия с
СО2 при 150-180оС и
давлении 5 атм, образуется натриевая соль салициловой кислоты.
Эфиры салициловой кислоты по гидроксильной и
карбоксильной группам используются как лекарственные средства.
Аспирин и метилсалицилат обладают
анальгетическим, жаропонижающим и противовоспалительным действием. Салол
Салол
применяется как дезинфицирующее средство при кишечных заболеваниях, так как не
гидролизуется в кислой среде желудка, а распадается только в кишечнике. Его
используют также в качестве материала защитных оболочек некоторых лекарств,
которые не стабильны в кислой среде желудка.
Окисление фенолов.
Хиноны
Фенолы легко окисляются. При окислении пространственно затрудненных фенолов
образуются устойчивые феноксильные радикалы.
Повышенная устойчивость феноксильных радикалов
связана с возможностью делокализации неспаренного электрона по ароматическому
кольцу. Кроме того, наличие объемистых заместителей в орто-положении
препятствует рекомбинации двух таких радикалов. Стабильность феноксильных
радикалов обуславливает антиокислительные свойства пространственно затрудненных
фенолов. Они выполняют роль ловушек свободных радикалов в процессах пероксидного
окисления. Активный свободный радикал, ведущий цепь окисления, быстро
взаимодействует с таким фенолом, давая устойчивый феноксильный радикал, что
приводит к обрыву цепи.
Роль природных антиоксидантов выполняют витамины группы Е (токоферолы). Антиокислительная функция токоферолов
проявляется в их способности связывать появляющиеся в клетках активные свободные
радикалы в устойчивые феноксильные радикалы, ингибируя, таким образом, процесс
пероксидного окисления липидов.
Повышенную склонность к окислению проявляют
многоатомные фенолы. Окисление фенолов с пара- и орто-расположением
гидроксильных групп приводит соответственно к п- и о-хинонам.
Процесс окисления гидрохинона в 1,4-бензохинон обратим и
дает хорошо воспроизводимый электродный потенциал, величина которого зависит от
рН, что используется в устройстве хингидронного электрода.
Окислительно-восстановительные
свойства системы хинон-гидрохинон играют важную роль в живых организмах (см.
ниже).
1,4-нафтохинон и 9,10-антрахинон могут быть
получены прямым окислением соответствующих углеводородов.
Хиноны широко распространены в
природе и играют роль антибиотиков, пигментов, витаминов, коферментов.
Витамины группы К являются
производными 1,4-нафтохинона и необходимы для обеспечения нормальной
свертываемости крови.
Убихиноны – производные 1,4-бензохинона, содержащие изопреноидную
цепь. Они являются коферментами и играют важную роль переносчика электронов в
дыхательных и фотохимических цепях биологических систем. Принимая электроны от
субстрата, убихиноны могут легко и обратимо восстанавливаться в производные
гидрохинона (см. систему хинон-гидрохинон), которые в свою очередь передают
электроны через цитохромную систему кислороду, обратно окисляясь в убихиноны.
Таким образом убихиноны участвуют в переносе электронов от субстрата к
кислороду.
Двухатомные фенолы – гидрохинон, резорцин, пирокатехин широко
распространены в природе.
Пирокатехин является структурным
элементом многих биологически активных веществ, например, катехоламинов (см.
лек. №13). Монометиловый эфир пирокатехина, гваякол, используется как
лекарственное средство для лечения заболеваний верхних дыхательных путей.
Резорцин применяется как антисептическое средство при лечении кожных
заболеваний.
Гидрохинон является структурным элементом природных соединений, например,
витаминов группы Е. Восстановительная способность гидрохинонового фрагмента
используется в окислительно-восстановительных процессах, сопровождающих дыхание.
Самим гидрохинон служит исходным веществом в синтезе многих лекарственных
средств.
6. Простые эфиры
Простые эфиры можно рассматривать как производные спиртов, в которых атом
водорода гидроксильной группы замещен на углеводородный радикал. По природе
связанных с кислородом углеводородных радикалов различают
диалкиловые эфиры
алкилариловые и диариловые эфиры
циклические простые эфиры
Методы
получения
- Взаимодействие алкоголятов с галогенпроизводными (синтез
Вильямсона).
R-Hal + R/O—Na+® R-OR/ + NaHal - Межмолекулярная дегидратация
спиртов.
Химические
свойства
Простые эфиры обладают низкой
реакционной способностью. Их реакции можно разделить на три группы: реакции по
атому кислорода; реакции по С-Н связи в a -положении; реакции с разрывом связи С-О.
Атом кислорода с неподеленными парами электронов
обуславливает основные свойства простых эфиров. Простые эфиры являются слабыми
основаниями и образуют оксониевые соединения при взаимодействии с сильными
протонными кислотами и кислотами Льюиса.
Простые эфиры вступают в реакции
свободнорадикального хлорирования и окисления. Замещение происходит у a -углеродного
атома.
Направление замещения обусловлено повышенной
стабильностью промежуточно образующегося алкоксиалкильного радикала.
Гидропероксиды – нестабильные взрывоопасные
соединения. Они образуются при длительном хранении простых эфиров на свету.
Поэтому перед использованием простые эфиры необходимо проверять на присутствии
пероксидов.
Реакции с разрывом связи С-О протекают в жестких
условиях в присутствии сильных кислот. Алкоголят анион RO— является сильным основанием и плохой уходящей
группой, поэтому его отщепления возможно только после предварительного
превращения в хорошую уходящую группу путем протонирования.
Эпоксиды Эпоксиды (оксираны, a -оксиды) – циклические
простые эфиры, содержащие атом кислорода в трехчленном цикле.
Получение
- Окисление алкенов.
- Из галогенгидринов путем
внутримолекулярного нуклеофильного замещения.
отличие от других типов простых эфиров эпоксиды –высокореакционноспособные
соединения. Термодинамически неустойчивый трехчленный цикл легко раскрывается
под действием нуклеофильных регентов.
Предполагают, что эпоксиды образуются в качестве
промежуточных продуктов ферментативного окисления кислородом двойных связей
углерод-углерод. Дальнейшие их превращения приводят к введению гидроксильной
Дальнейшие их превращения приводят к введению гидроксильной
группы в природные соединения.
Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Антифризы. Этилен- и пропиленгликоли. Глицерин. Рассолы — антифризы. Рассолы. Поделиться:
 Введите свой запрос: Введите свой запрос: | ||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | |||
| Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Этиленгликоль – обзор
11.4.3 Механизм коррозии
Чистый этиленгликоль имеет очень плохую электропроводность и является практически изолятором. В лаборатории было измерено, что удельное сопротивление чистого этиленгликоля примерно в 40 раз выше, чем у воды ASTM типа II [27]. Следовательно, удельное сопротивление раствора этиленгликоля будет уменьшаться с увеличением содержания воды. Кроме того, разбавление водой способствует гидролизу гидроксильных групп этиленгликоля, что также приводит к увеличению электропроводности. Удельное сопротивление 33 об.% раствора этиленгликоля, измеренное в лаборатории, составляет около 10 4 Ом см [27], что намного выше, чем у обычного водного раствора (обычно менее 10 2 Ом см). . Следовательно, высокое удельное сопротивление раствора играет важную роль в коррозии.
Удельное сопротивление 33 об.% раствора этиленгликоля, измеренное в лаборатории, составляет около 10 4 Ом см [27], что намного выше, чем у обычного водного раствора (обычно менее 10 2 Ом см). . Следовательно, высокое удельное сопротивление раствора играет важную роль в коррозии.
В растворе этиленгликоля локализовано коррозионное повреждение магния. На поверхности отчетливо видна питтинг [27], а окружающая область, где она не подверглась коррозии, относительно блестящая.Ямка представляет собой активный анод, а окружающая блестящая область представляет собой катод, защищенный от коррозии за счет точечной коррозии. На рис. 11.5 схематично показана локальная точечная коррозия и соответствующая эквивалентная схема для магния в растворе этиленгликоля. В эквивалентной схеме C d – емкость некорродировавшего участка магниевого образца, R pt и C pt – сопротивление и емкость в нижней части корродирующего ( питтинг), R пс — сопротивление раствора в ямке, R с — сопротивление раствора между электродом сравнения и образцом из магния. Следовательно, общее поляризационное сопротивление R p может быть выражено как: R p = R пс + R pt . Из-за удельного сопротивления высокого раствора соотношение R PS более R PT PT очень высока ( R PS >> R PT ), и, следовательно, R P ≈ R пс .
Следовательно, общее поляризационное сопротивление R p может быть выражено как: R p = R пс + R pt . Из-за удельного сопротивления высокого раствора соотношение R PS более R PT PT очень высока ( R PS >> R PT ), и, следовательно, R P ≈ R пс .
11.5. Питтинговая модель магния в растворе этиленгликоля и соответствующая схема замещения.
Локализованное коррозионное повреждение подразумевает, что скорость точечной коррозии ограничена сопротивлением раствора в язве, и, таким образом, удельное сопротивление раствора может значительно повлиять на коррозионную стойкость или поляризационную стойкость магния в растворе этиленгликоля. Вывод был подтвержден измеренной линейной зависимостью между сопротивлением поляризации и удельным сопротивлением раствора [27]; поскольку сопротивление раствора увеличивается с увеличением концентрации этиленгликоля, сопротивление поляризации также увеличивается. Это объясняет снижение скорости коррозии магния при увеличении концентрации этиленгликоля (рис. 11.2).
Это объясняет снижение скорости коррозии магния при увеличении концентрации этиленгликоля (рис. 11.2).
В загрязненном растворе этиленгликоля сопротивление раствора снижается с увеличением концентрации каждого загрязнителя NaCl, Na 2 SO 4 или NaHCO 3 . Пониженное поляризационное сопротивление магния можно объяснить повышенным общим содержанием ионов в растворе. При низком содержании загрязняющих веществ проводимость раствора пропорциональна концентрации электролитов.Снижение растворостойкости особенно заметно при увеличении концентрации NaCl. Этим объясняется наиболее пагубное влияние NaCl на коррозионные характеристики магния в загрязненном растворе этиленгликоля. Снижение стойкости к раствору, вызванное загрязняющими веществами, также может объяснить небольшое увеличение скорости коррозии магния в этиленгликоле при добавлении Mg(OH) 2 и Mg(NO 3 ) 2 (рис. 11.3).
Помимо устойчивости к раствору, наиболее фундаментальным объяснением коррозионного поведения магния в этиленгликоле может быть граница раздела магний/этиленгликоль. Как и большинство других органических веществ, этиленгликоль может адсорбироваться на поверхности электрода. Емкость C d является хорошим показателем адсорбции этиленгликоля на поверхности магния. Было измерено [27], что емкость уменьшается с увеличением концентрации этиленгликоля. Уменьшение емкости интерфейса может быть вызвано заменой воды с высокой диэлектрической проницаемостью на границе раздела более крупными длинными диэлектрическими молекулами. Молекула этиленгликоля крупнее и менее полярна, чем вода.Его адсорбция на поверхности магния, безусловно, может привести к снижению C d . Когда концентрация этиленгликоля увеличивается, больше этиленгликоля будет адсорбироваться на поверхности, что приведет к снижению C d . Другими словами, поверхность магния полнее покрыта молекулами этиленгликоля в более концентрированном растворе этиленгликоля, что более эффективно защищает магний от воздействия воды. Это объясняет уменьшение скорости коррозии магния при увеличении концентрации этиленгликоля (рис.
Как и большинство других органических веществ, этиленгликоль может адсорбироваться на поверхности электрода. Емкость C d является хорошим показателем адсорбции этиленгликоля на поверхности магния. Было измерено [27], что емкость уменьшается с увеличением концентрации этиленгликоля. Уменьшение емкости интерфейса может быть вызвано заменой воды с высокой диэлектрической проницаемостью на границе раздела более крупными длинными диэлектрическими молекулами. Молекула этиленгликоля крупнее и менее полярна, чем вода.Его адсорбция на поверхности магния, безусловно, может привести к снижению C d . Когда концентрация этиленгликоля увеличивается, больше этиленгликоля будет адсорбироваться на поверхности, что приведет к снижению C d . Другими словами, поверхность магния полнее покрыта молекулами этиленгликоля в более концентрированном растворе этиленгликоля, что более эффективно защищает магний от воздействия воды. Это объясняет уменьшение скорости коррозии магния при увеличении концентрации этиленгликоля (рис. 11.2).
11.2).
В загрязненном растворе NaCl, Na 2 SO 4 и NaHCO 3 имеют меньший размер, чем этиленгликоль. Увеличение емкости должно происходить за счет замены этиленгликоля на поверхности магния загрязнителями. SO 4 2 − и HCO 3 − могут сильнее (легко) адсорбироваться на поверхности магния, чем Cl – . Дополнительный адсорбированный этиленгликоль может быть заменен на Na 2 SO 4 или NaHCO 3 , и в результате такого обмена получается более высокая поверхностная емкость, чем в случае NaCl при той же весовой/объемной концентрации этих загрязняющих веществ.Тем не менее хорошо известно, что хлориды гораздо более агрессивны, чем сульфаты и карбонаты. Всего нескольких адсорбированных ионов хлора может быть достаточно, чтобы значительно ускорить растворение магния в адсорбированных местах. Таким образом, скорость коррозии магния в хлоридсодержащем растворе этиленгликоля выше, чем в растворе этиленгликоля, содержащем Na 2 SO 4 или NaHCO 3 .
Более сильная адсорбция Na 2 SO 4 или NaHCO 3 , чем хлорида, означает, что если Na 2 SO 4 или NaHCO 3 добавить в раствор, содержащий этиленгликоль, адсорбированные ионы Cl – на поверхности магния замещаются сульфатом или карбонатом.Поскольку сульфат или карбонат гораздо менее агрессивны по отношению к магнию, чем хлорид, замена адсорбированных хлоридов сульфатами или карбонатами фактически пассивирует активные центры на поверхности магния. Следовательно, растворение магния замедляется. Следовательно, в хлоридсодержащем растворе Na 2 SO 4 или NaHCO 3 будут играть двойную роль. С одной стороны, ингибирующее действие Na 2 SO 4 или NaHCO 3 приводит к пассивации.С другой стороны, добавление Na 2 SO 4 или NaHCO 3 в хлоридсодержащий раствор этиленгликоля снижает устойчивость к раствору, что приводит к снижению коррозионной стойкости. После того, как большая часть адсорбированных ионов хлорида на поверхности магния отталкивается, дальнейшее добавление Na 2 SO 4 или NaHCO 3 может только уменьшить R s раствора. Следовательно, скорость коррозии магния сначала снижается, а затем увеличивается при дальнейшем добавлении Na 2 SO 4 или NaHCO 3 .
После того, как большая часть адсорбированных ионов хлорида на поверхности магния отталкивается, дальнейшее добавление Na 2 SO 4 или NaHCO 3 может только уменьшить R s раствора. Следовательно, скорость коррозии магния сначала снижается, а затем увеличивается при дальнейшем добавлении Na 2 SO 4 или NaHCO 3 .
Клейкие виниловые этикетки GHS OSHA «Этиленгликоль», этикетки HCL
Положения и условия
Спасибо, что посетили наш сайт. Настоящие условия использования применимы к веб-сайтам США, Канады и Пуэрто-Рико («Веб-сайт»), которыми управляет VWR («Компания»). Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, посетите соответствующий международный веб-сайт, доступный по адресу www.vwr.com, для ознакомления с применимыми условиями.На всех пользователей веб-сайта распространяются следующие условия использования веб-сайта (данные «Условия использования»). Пожалуйста, внимательно прочитайте настоящие Условия использования перед доступом к любой части веб-сайта или его использованием. Получая доступ к Веб-сайту или используя его, вы соглашаетесь с тем, что прочитали, поняли и согласны соблюдать настоящие Условия использования с периодическими изменениями, а также Политику конфиденциальности Компании, которая настоящим включена в настоящие Условия. использования. Если вы не хотите соглашаться с настоящими Условиями использования, не открывайте и не используйте какую-либо часть веб-сайта.
Пожалуйста, внимательно прочитайте настоящие Условия использования перед доступом к любой части веб-сайта или его использованием. Получая доступ к Веб-сайту или используя его, вы соглашаетесь с тем, что прочитали, поняли и согласны соблюдать настоящие Условия использования с периодическими изменениями, а также Политику конфиденциальности Компании, которая настоящим включена в настоящие Условия. использования. Если вы не хотите соглашаться с настоящими Условиями использования, не открывайте и не используйте какую-либо часть веб-сайта.
Компания может пересматривать и обновлять настоящие Условия использования в любое время без предварительного уведомления, разместив измененные условия на веб-сайте. Ваше дальнейшее использование веб-сайта означает, что вы принимаете и соглашаетесь с пересмотренными Условиями использования. Если вы не согласны с Условиями использования (в которые время от времени вносятся поправки) или недовольны Веб-сайтом, вашим единственным и исключительным средством правовой защиты является прекращение использования Веб-сайта.
Использование на месте
Информация, содержащаяся на этом веб-сайте, предоставляется только в информационных целях.Несмотря на то, что на момент публикации информация считается верной, вы должны самостоятельно определить ее пригодность для вашего использования. Не все продукты или услуги, описанные на этом веб-сайте, доступны во всех юрисдикциях или для всех потенциальных клиентов, и ничто в настоящем документе не предназначено в качестве предложения или ходатайства в какой-либо юрисдикции или любому потенциальному клиенту, если такое предложение или продажа не соответствуют требованиям.
Покупка товаров и услуг
Настоящие Положения и условия применяются только к использованию Веб-сайта.Обратите внимание, что условия, касающиеся обслуживания, продажи продуктов, рекламных акций и других связанных с этим действий, можно найти по адресу https://us.vwr.com/store/content/externalContentPage.jsp?path=/en_US/about_vwr_terms_and_conditions. jsp. , и эти положения и условия регулируют любые покупки продуктов или услуг у Компании.
jsp. , и эти положения и условия регулируют любые покупки продуктов или услуг у Компании.
Интерактивные функции
Веб-сайт может содержать службы доски объявлений, чаты, группы новостей, форумы, сообщества, персональные веб-страницы, календари и/или другие средства обмена сообщениями или средствами связи, предназначенные для того, чтобы вы могли общаться с широкой общественностью или с группой ( совместно именуемые «Функция сообщества»).Вы соглашаетесь использовать Функцию сообщества только для публикации, отправки и получения сообщений и материалов, которые являются надлежащими и связаны с конкретной Функцией сообщества. Вы соглашаетесь использовать Веб-сайт только в законных целях.
A. В частности, вы соглашаетесь не делать ничего из следующего при использовании функции сообщества:
1. Порочить, оскорблять, преследовать, преследовать, угрожать или иным образом нарушать законные права (такие как права на неприкосновенность частной жизни и публичность) других лиц.

2. Публиковать, публиковать, загружать, распространять или распространять любые неуместные, богохульные, клеветнические, нарушающие авторские права, непристойные, непристойные или незаконные темы, названия, материалы или информацию.
3. Загружать файлы, содержащие программное обеспечение или другие материалы, защищенные законами об интеллектуальной собственности (или правами на неприкосновенность частной жизни или публичное использование), за исключением случаев, когда вы владеете правами на них или распоряжаетесь ими или получили все необходимые согласия.
4. Загружать файлы, содержащие вирусы, поврежденные файлы или любое другое подобное программное обеспечение или программы, которые могут нарушить работу чужого компьютера.
5. Перехват или попытка перехвата электронной почты, не предназначенной для вас.
6. Рекламировать или предлагать продать или купить какие-либо товары или услуги для любых деловых целей, если такая Функция сообщества специально не разрешает такие сообщения.
7. Проводить или рассылать опросы, конкурсы, финансовые пирамиды или письма счастья.
8. Загрузите любой файл, опубликованный другим пользователем Элемента сообщества, который, как вы знаете или должны были бы знать, не может быть законно распространен таким образом или что вы обязаны соблюдать конфиденциальность по договору (несмотря на его доступность на веб-сайте).
9. Фальсифицировать или удалять любые указания на авторство, юридические или другие надлежащие уведомления, обозначения прав собственности или ярлыки происхождения или источника программного обеспечения или других материалов, содержащихся в загружаемом файле.
10. Искажать связь с каким-либо лицом или организацией.
11. Участвовать в любых других действиях, которые ограничивают или препятствуют чьему-либо использованию Веб-сайта или которые, по мнению Компании, могут нанести вред Компании или пользователям Веб-сайта или привлечь их к ответственности.
12. Нарушать любые применимые законы или правила или нарушать любой кодекс поведения или другие правила, которые могут применяться к какой-либо конкретной функции сообщества.
13. Собирать или иным образом собирать информацию о других, включая адреса электронной почты, без их согласия.
B. Вы понимаете и признаете, что несете ответственность за любой контент, который вы отправляете, вы, а не Компания, несете полную ответственность за такой контент, включая его законность, надежность и уместность. Если вы публикуете от имени или от имени вашего работодателя или другого лица, вы заявляете и гарантируете, что вы уполномочены делать это. Загружая или иным образом передавая материал в любую область Веб-сайта, вы гарантируете, что этот материал принадлежит вам или находится в общественном достоянии, или иным образом свободен от имущественных или других ограничений, и что вы имеете право размещать его на Веб-сайте.Кроме того, загружая или иным образом передавая материалы в любую область веб-сайта, вы предоставляете Компании безотзывное, безвозмездное право во всем мире публиковать, воспроизводить, использовать, адаптировать, редактировать и/или изменять такие материалы любым способом, в любые средства массовой информации, известные в настоящее время или обнаруженные в будущем, во всем мире, в том числе в Интернете и всемирной паутине, в рекламных, коммерческих, коммерческих и рекламных целях, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения.
C. Компания оставляет за собой право, но не берет на себя никакой ответственности, (1) удалять любые материалы, размещенные на веб-сайте, которые Компания по своему собственному усмотрению считает несовместимыми с вышеуказанными обязательствами или иным образом неуместными по любой причине. ; и (2) прекратить доступ любого пользователя ко всему Веб-сайту или его части. Тем не менее, Компания не может ни просматривать все материалы до их размещения на Веб-сайте, ни гарантировать незамедлительное удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими лицами. Компания оставляет за собой право предпринимать любые действия, которые она сочтет необходимыми для защиты личной безопасности пользователей данного веб-сайта и общественности; однако Компания не несет ответственности перед кем-либо за выполнение или невыполнение действий, описанных в этом параграфе.
D. Несоблюдение вами положений (A) или (B) выше может привести к прекращению вашего доступа к Веб-сайту и может подвергнуть вас гражданской и/или уголовной ответственности.
Специальное примечание о контенте сообщества
Любой контент и/или мнения, загруженные, выраженные или представленные через любую функцию сообщества или любой другой общедоступный раздел веб-сайта (включая защищенные паролем области), а также все статьи и ответы на вопросы, кроме контента, явно разрешенного Компании, являются исключительно мнением и ответственностью физического или юридического лица, представляющего их, и не обязательно отражают мнение Компании.Например, любое рекомендуемое или предлагаемое использование продуктов или услуг, доступных от Компании, которое публикуется через Функция сообщества, не является признаком одобрения или рекомендации со стороны Компании. Если вы решите следовать любой такой рекомендации, вы делаете это на свой страх и риск.
Ссылки на сторонние сайты
Веб-сайт может содержать ссылки на другие веб-сайты в Интернете. Компания не несет ответственности за содержание, продукты, услуги или практику любых сторонних веб-сайтов, включая, помимо прочего, сайты, связанные с Веб-сайтом или с него, сайты, размещенные на Веб-сайте, или рекламу третьих лиц, и не делает заявлений относительно их качество, содержание или точность.Наличие ссылок с веб-сайта на любой сторонний веб-сайт не означает, что мы одобряем, одобряем или рекомендуем этот веб-сайт. Мы отказываемся от всех гарантий, явных или подразумеваемых, в отношении точности, законности, надежности или достоверности любого контента на любом стороннем веб-сайте. Использование вами сторонних веб-сайтов осуществляется на ваш страх и риск и регулируется условиями использования таких веб-сайтов.
Права собственности на контент
Вы признаете и соглашаетесь с тем, что все содержимое Веб-сайта (включая всю информацию, данные, программное обеспечение, графику, текст, изображения, логотипы и/или другие материалы), а также его дизайн, выбор, сбор, размещение и сборка являются являются собственностью Компании и защищены законами США и международными законами об интеллектуальной собственности. Вы имеете право использовать содержимое веб-сайта только в личных целях или в законных деловых целях. Вы не можете копировать, изменять, создавать производные работы, публично демонстрировать или выполнять, переиздавать, хранить, передавать, распространять, удалять, удалять, дополнять, добавлять, участвовать в передаче, лицензировать или продавать любые материалы в Интернете. сайта без предварительного письменного согласия Компании, за исключением: (а) временного хранения копий таких материалов в оперативной памяти, (б) хранения файлов, которые автоматически кэшируются вашим веб-браузером для целей улучшения отображения, и (в) печати разумного количество страниц веб-сайта; при условии, что в каждом случае вы не изменяете и не удаляете какие-либо уведомления об авторских правах или других правах собственности, включенные в такие материалы.Ни название, ни какие-либо права интеллектуальной собственности на какую-либо информацию или материалы на Веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Вы имеете право использовать содержимое веб-сайта только в личных целях или в законных деловых целях. Вы не можете копировать, изменять, создавать производные работы, публично демонстрировать или выполнять, переиздавать, хранить, передавать, распространять, удалять, удалять, дополнять, добавлять, участвовать в передаче, лицензировать или продавать любые материалы в Интернете. сайта без предварительного письменного согласия Компании, за исключением: (а) временного хранения копий таких материалов в оперативной памяти, (б) хранения файлов, которые автоматически кэшируются вашим веб-браузером для целей улучшения отображения, и (в) печати разумного количество страниц веб-сайта; при условии, что в каждом случае вы не изменяете и не удаляете какие-либо уведомления об авторских правах или других правах собственности, включенные в такие материалы.Ни название, ни какие-либо права интеллектуальной собственности на какую-либо информацию или материалы на Веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Товарные знаки
Название и логотип Компании, а также все соответствующие названия, логотипы, названия продуктов и услуг, встречающиеся на Веб-сайте, являются товарными знаками Компании и/или соответствующих сторонних поставщиков. Их нельзя использовать или повторно отображать без предварительного письменного согласия Компании.
Отказ от ответственности
Компания не несет никакой ответственности за материалы, информацию и мнения, представленные на Веб-сайте или доступные через него («Контент сайта»). Вы полагаетесь на Контент Сайта исключительно на свой страх и риск. Компания отказывается от какой-либо ответственности за травмы или убытки, возникшие в результате использования любого Контента Сайта.
ВЕБ-САЙТ, СОДЕРЖИМОЕ САЙТА, ПРОДУКТЫ И УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ВЕБ-САЙТЕ ИЛИ ДОСТУПНЫЕ ЧЕРЕЗ ЕГО, ПРЕДОСТАВЛЯЮТСЯ НА УСЛОВИЯХ «КАК ЕСТЬ» И «КАК ДОСТУПНО», СО ВСЕМИ ОШИБКАМИ. НИ КОМПАНИЯ, НИ ЛЮБОЕ СВЯЗАННОЕ С КОМПАНИЕЙ ЛИЦО НЕ ДАЕТ НИКАКИХ ГАРАНТИЙ ИЛИ ЗАЯВЛЕНИЙ В ОТНОШЕНИИ КАЧЕСТВА, ТОЧНОСТИ ИЛИ ДОСТУПНОСТИ ВЕБ-САЙТА. В ЧАСТНОСТИ, НО НЕ ОГРАНИЧИВАЯ ВЫШЕИЗЛОЖЕННОЕ, НИ КОМПАНИЯ, НИ ЛЮБОЕ СВЯЗАННОЕ С КОМПАНИЕЙ ЛИЦО НЕ ГАРАНТИРУЕТ И НЕ ЗАЯВЛЯЕТ, ЧТО ВЕБ-САЙТ, СОДЕРЖИМОЕ САЙТА ИЛИ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ВЕБ-САЙТЕ ИЛИ ЧЕРЕЗ ВЕБ-САЙТ, БУДУТ ТОЧНЫМИ, НАДЕЖНЫМИ, БЕЗОШИБОЧНЫМИ ИЛИ БЕСПЕРЕБОЙНЫМИ; ЧТО ДЕФЕКТЫ БУДУТ ИСПРАВЛЕНЫ; ЧТО ВЕБ-САЙТ ИЛИ СЕРВЕР, КОТОРЫЙ ДЕЛАЕТ ЕГО ДОСТУПНЫМ, НЕ СОДЕРЖАТ ВИРУСОВ ИЛИ ДРУГИХ ВРЕДНЫХ КОМПОНЕНТОВ; ИЛИ ЧТО ВЕБ-САЙТ БУДЕТ ОТВЕЧАТЬ ВАШИМ ПОТРЕБНОСТЯМ ИЛИ ОЖИДАНИЯМ.КОМПАНИЯ ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ГАРАНТИЙ ЛЮБОГО РОДА, ЯВНЫХ ИЛИ ПОДРАЗУМЕВАЕМЫХ, ВКЛЮЧАЯ ЛЮБЫЕ ГАРАНТИИ КОММЕРЧЕСКОЙ ПРИГОДНОСТИ, ПРИГОДНОСТИ ДЛЯ КОНКРЕТНОЙ ЦЕЛИ И НЕНАРУШЕНИЯ ПРАВ.
НИ КОМПАНИЯ, НИ ЛЮБОЕ СВЯЗАННОЕ С КОМПАНИЕЙ ЛИЦО НЕ ДАЕТ НИКАКИХ ГАРАНТИЙ ИЛИ ЗАЯВЛЕНИЙ В ОТНОШЕНИИ КАЧЕСТВА, ТОЧНОСТИ ИЛИ ДОСТУПНОСТИ ВЕБ-САЙТА. В ЧАСТНОСТИ, НО НЕ ОГРАНИЧИВАЯ ВЫШЕИЗЛОЖЕННОЕ, НИ КОМПАНИЯ, НИ ЛЮБОЕ СВЯЗАННОЕ С КОМПАНИЕЙ ЛИЦО НЕ ГАРАНТИРУЕТ И НЕ ЗАЯВЛЯЕТ, ЧТО ВЕБ-САЙТ, СОДЕРЖИМОЕ САЙТА ИЛИ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ВЕБ-САЙТЕ ИЛИ ЧЕРЕЗ ВЕБ-САЙТ, БУДУТ ТОЧНЫМИ, НАДЕЖНЫМИ, БЕЗОШИБОЧНЫМИ ИЛИ БЕСПЕРЕБОЙНЫМИ; ЧТО ДЕФЕКТЫ БУДУТ ИСПРАВЛЕНЫ; ЧТО ВЕБ-САЙТ ИЛИ СЕРВЕР, КОТОРЫЙ ДЕЛАЕТ ЕГО ДОСТУПНЫМ, НЕ СОДЕРЖАТ ВИРУСОВ ИЛИ ДРУГИХ ВРЕДНЫХ КОМПОНЕНТОВ; ИЛИ ЧТО ВЕБ-САЙТ БУДЕТ ОТВЕЧАТЬ ВАШИМ ПОТРЕБНОСТЯМ ИЛИ ОЖИДАНИЯМ.КОМПАНИЯ ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ГАРАНТИЙ ЛЮБОГО РОДА, ЯВНЫХ ИЛИ ПОДРАЗУМЕВАЕМЫХ, ВКЛЮЧАЯ ЛЮБЫЕ ГАРАНТИИ КОММЕРЧЕСКОЙ ПРИГОДНОСТИ, ПРИГОДНОСТИ ДЛЯ КОНКРЕТНОЙ ЦЕЛИ И НЕНАРУШЕНИЯ ПРАВ.
НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ КОМПАНИЯ ИЛИ ЕЕ ЛИЦЕНЗИАРЫ ИЛИ ПОДРЯДЧИКИ НЕ НЕСУТ ОТВЕТСТВЕННОСТИ ЗА ЛЮБОЙ УЩЕРБ ЛЮБОГО РОДА, ПО ЛЮБОЙ ПРАВОВОЙ ТЕОРИИ, ВЫТЕКАЮЩИЙ ИЗ ИЛИ В СВЯЗИ С ИСПОЛЬЗОВАНИЕМ ВАМИ ИЛИ НЕВОЗМОЖНОСТЬЮ ИСПОЛЬЗОВАНИЯ ВЕБ-САЙТА, СОДЕРЖИМОГО САЙТА, ЛЮБЫЕ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ИЛИ ЧЕРЕЗ ВЕБ-САЙТ ИЛИ ЛЮБОЙ ССЫЛОЧНЫЙ САЙТ, ВКЛЮЧАЯ ЛЮБЫЕ ПРЯМЫЕ, КОСВЕННЫЕ, СЛУЧАЙНЫЕ, ОСОБЫЕ, КОСВЕННЫЕ ИЛИ ШТРАФНЫЕ УБЫТКИ, ВКЛЮЧАЯ, ПОМИМО ПРОЧЕГО, ТРАВМЫ, УПУЩЕННУЮ ПРИБЫЛЬ ИЛИ УЩЕРБ В РЕЗУЛЬТАТЕ ЗАДЕРЖКИ, ПЕРЕРЫВА В ОБСЛУЖИВАНИИ , ВИРУСЫ, УДАЛЕНИЕ ФАЙЛОВ ИЛИ ЭЛЕКТРОННЫХ СООБЩЕНИЙ, ИЛИ ОШИБКИ, УПУЩЕНИЯ ИЛИ ДРУГИЕ НЕТОЧНОСТИ НА ВЕБ-САЙТЕ ИЛИ СОДЕРЖИМОМ САЙТА ИЛИ УСЛУГАХ, НЕЗАВИСИМО ОТ НЕБРЕЖНОСТИ СО СТОРОНЫ КОМПАНИИ И БЫЛА ИЛИ НЕ УВЕДОМЛЕНА КОМПАНИЯ О ВОЗМОЖНОСТИ ЛЮБОЙ ТАКОЙ УЩЕРБ, ЕСЛИ НЕ ЗАПРЕЩЕНО ПРИМЕНИМЫМ ЗАКОНОДАТЕЛЬСТВОМ.
Возмещение ущерба
Вы соглашаетесь ограждать и ограждать Компанию и ее должностных лиц, директоров, агентов, сотрудников и других лиц, связанных с Веб-сайтом, от любых и всех обязательств, расходов, убытков и издержек, включая разумные гонорары адвокатов, возникающие в результате любое нарушение вами настоящих Условий использования, использование вами веб-сайта или любых продуктов, услуг или информации, полученных с веб-сайта или через него, ваше подключение к веб-сайту, любой контент, который вы отправляете на веб-сайт через любую Функция сообщества или нарушение вами каких-либо прав другого лица.
Применимое законодательство; Международное использование
Настоящие условия регулируются и толкуются в соответствии с законами штата Пенсильвания без учета каких-либо принципов коллизионного права. Вы соглашаетесь с тем, что любой иск по закону или справедливости, который возникает из настоящих Условий использования или относится к ним, будет подан исключительно в суды штата или федеральные суды, расположенные в Пенсильвании, и настоящим вы соглашаетесь и подчиняетесь личной юрисдикции таких судов для целей судебного разбирательства любого такого действия.
Настоящие Условия использования применимы к пользователям в США, Канаде и Пуэрто-Рико. Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, посетите соответствующий международный веб-сайт, доступный по адресу www.vwr.com, для ознакомления с применимыми условиями. Если вы решите получить доступ к этому веб-сайту из-за пределов указанной юрисдикции, а не использовать доступные международные сайты, вы соглашаетесь с настоящими Условиями использования и тем, что такие условия будут регулироваться и толковаться в соответствии с законами Соединенных Штатов и штата. Пенсильвании, и что мы не делаем заявлений о том, что материалы или услуги на этом веб-сайте подходят или доступны для использования в этих других юрисдикциях.В любом случае, все пользователи сами несут ответственность за соблюдение местного законодательства.
Общие условия
Настоящие Условия использования, в которые время от времени могут вноситься поправки, представляют собой полное соглашение и понимание между вами и нами, регулирующее использование вами Веб-сайта. Наша неспособность осуществить или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы, тем не менее, соглашаетесь с тем, что суд должен приложить усилия для реализации намерений сторон, отраженных в этом положении, и других положений Условия использования остаются в полной силе.Ни курс дел или поведение между вами и Компанией, ни какие-либо торговые практики не должны рассматриваться как изменяющие настоящие Условия использования. Вы соглашаетесь с тем, что независимо от любого закона или закона об обратном, любой иск или основание для иска, вытекающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такого требования или основания. действия возникло или будет навсегда запрещено. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией и для нее.
Наша неспособность осуществить или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы, тем не менее, соглашаетесь с тем, что суд должен приложить усилия для реализации намерений сторон, отраженных в этом положении, и других положений Условия использования остаются в полной силе.Ни курс дел или поведение между вами и Компанией, ни какие-либо торговые практики не должны рассматриваться как изменяющие настоящие Условия использования. Вы соглашаетесь с тем, что независимо от любого закона или закона об обратном, любой иск или основание для иска, вытекающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такого требования или основания. действия возникло или будет навсегда запрещено. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией и для нее. Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему Сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением любого применимого законодательства или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы, касающиеся настоящих Условий использования, следует направлять на адрес [email protected].
Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему Сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением любого применимого законодательства или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы, касающиеся настоящих Условий использования, следует направлять на адрес [email protected].
Жалобы на нарушение авторских прав
Мы уважаем интеллектуальную собственность других и просим наших пользователей делать то же самое.Если вы считаете, что ваша работа была скопирована и доступна на Сайте таким образом, что это представляет собой нарушение авторских прав, вы можете уведомить нас, предоставив нашему агенту по авторским правам следующую информацию:
электронная или физическая подпись лица, уполномоченного действовать от имени владельца авторских прав;
описание защищенной авторским правом работы, права на которую были нарушены в соответствии с вашим заявлением;
указание URL-адреса или другого конкретного места на Сайте, где находится материал, который, по вашему мнению, нарушает авторские права;
ваш адрес, номер телефона и адрес электронной почты;
ваше заявление о том, что вы добросовестно полагаете, что оспариваемое использование не разрешено владельцем авторских прав, его агентом или законом; и
ваше заявление, сделанное под страхом наказания за лжесвидетельство, о том, что приведенная выше информация в вашем уведомлении является точной и что вы являетесь владельцем авторских прав или уполномочены действовать от имени владельца авторских прав.

С нашим агентом для уведомления о нарушении авторских прав на Сайте можно связаться по адресу: [email protected].
α,ω-диаминополи(этиленгликоль) гидрохлоридная соль [HCl·h3N-PEG-Nh3·HCl] Производитель
Гидрохлоридная соль α,ω-диаминополи(этиленгликоля)
Число | Мн |
06020208102 | 2000 г. |
06020208106 | 5000 |
06020208109 | 10000 |
06020208112 | 20000 |
06020208115 | 40000 |
Тел.: +86-400-918-9898 Тел.: +1-844-782-5734 | |
Гидрохлоридная соль α,ω-диаминополи(этиленгликоля) доступна с молекулярной массой 2K, 5K, 10K, 20K и 40K Да, другие M. W. может быть доступен путем пользовательского синтеза. Размеры упаковки доступны для 1g, 10g и 100g. Пожалуйста, свяжитесь с нами, чтобы узнать о ценах и размерах упаковки ПЭГ оптом и по стандартам GMP. MW 2000 Da, MW 5000 Da, MW 10000 Da, MW 20000 Da, MW 40000 Da доступны.
W. может быть доступен путем пользовательского синтеза. Размеры упаковки доступны для 1g, 10g и 100g. Пожалуйста, свяжитесь с нами, чтобы узнать о ценах и размерах упаковки ПЭГ оптом и по стандартам GMP. MW 2000 Da, MW 5000 Da, MW 10000 Da, MW 20000 Da, MW 40000 Da доступны.
SINOPEG обслуживает фармацевтические компании и компании, производящие медицинское оборудование, по всему миру, с присутствием продуктов в различных процессах разработки фармацевтических препаратов и устройств (доклинические, клинические и пострегистрационные крупномасштабные поставки).Наше предприятие сертифицировано по стандартам ISO9001 и ISO13485 и работает в соответствии с рекомендациями ICH Q7A по производству продукции для фармацевтических компаний.
Свяжитесь с нами по адресу [email protected] для производных ПЭГ. В нашем онлайн-каталоге или реестре могут быть указаны не все молекулярные массы и функциональные группы, которые могут быть получены путем индивидуального синтеза. Пожалуйста, свяжитесь с нами по [email protected] , чтобы узнать цену и наличие.
Пожалуйста, свяжитесь с нами по [email protected] , чтобы узнать цену и наличие.
Первоначальный перечень опасных загрязнителей воздуха с изменениями
В соответствии с Законом о чистом воздухе Агентство по охране окружающей среды обязано регулировать выбросы опасных загрязнителей воздуха.Этот первоначальный список включал 189 загрязняющих веществ. С 1990 года Агентство по охране окружающей среды изменило этот список, включив в него 188 опасных загрязнителей воздуха.
| Номер CAS | Химическое название |
|---|---|
| 75070 | Ацетальдегид |
| 60355 | Ацетамид |
| 75058 | Ацетонитрил |
| 98862 | Ацетофенон |
| 53963 | 2-ацетиламинофлуорен |
| 107028 | Акролеин |
| 79061 | Акриламид |
| 79107 | Акриловая кислота |
| 107131 | Акрилонитрил |
| 107051 | Аллилхлорид |
| 92671 | 4-аминодифенил |
| 62533 | Анилин |
| о-анизидин | |
| 1332214 | Асбест |
| 71432 | Бензол (включая бензол из бензина) |
| 92875 | Бензидин |
| 98077 | Бензотрихлорид |
| 100447 | Бензилхлорид |
| 92524 | Бифенил |
| 117817 | Бис(2-этилгексил)фталат (ДЭГФ) |
| 542881 | Бис(хлорметил)эфир |
| 75252 | Бромоформ |
| 106945 | 1-бромпропан (см. модификацию) модификацию) |
| 106990 | 1,3-бутадиен |
| 156627 | Цианамид кальция |
| 105602 | Капролактам (см. модификацию) |
| 133062 | Капитан |
| 63252 | Карбарил |
| 75150 | Сероуглерод |
| 56235 | Четыреххлористый углерод |
| 463581 | Карбонилсульфид |
| 120809 | Катехол |
| 133904 | Хлорамбен |
| 57749 | Хлордан |
| 7782505 | Хлор |
| 79118 | Хлоруксусная кислота |
| 532274 | 2-хлорацетофенон |
| 108907 | Хлорбензол |
| 510156 | Хлорбензилат |
| 67663 | Хлороформ |
| 107302 | Хлорметилметиловый эфир |
| 126998 | Хлоропрен |
| 1319773 | Крезолы/крезиловая кислота (изомеры и смеси) |
| 95487 | о-крезол |
| 108394 | м-крезол |
| 106445 | п-крезол |
| 98828 | Кумол |
| 94757 | 2,4-Д, соли и сложные эфиры |
| 3547044 | ДДЭ |
| 334883 | Диазометан |
| 132649 | Дибензофураны |
| 96128 | 1,2-дибром-3-хлорпропан |
| 84742 | Дибутилфталат |
| 106467 | 1,4-Дихлорбензол(п) |
| 91941 | 3,3-дихлорбензиден |
| 111444 | Дихлорэтиловый эфир (бис(2-хлорэтил)эфир) |
| 542756 | 1,3-Дихлорпропен |
| 62737 | Дихлофос |
| 111422 | Диэтаноламин |
| 121697 | N,N-диметиланилин |
| 64675 | Диэтилсульфат |
| 119904 | 3,3-Диметоксибензидин |
| 60117 | Диметиламиноазобензол |
| 119937 | 3,3′-Диметилбензидин |
| 79447 | Диметилкарбамоилхлорид |
| 68122 | Диметилформамид |
| 57147 | 1,1-Диметилгидразин |
| 131113 | Диметилфталат |
| 77781 | Диметилсульфат |
| 534521 | 4,6-динитро-о-крезол и соли |
| 51285 | 2,4-динитрофенол |
| 121142 | 2,4-динитротолуол |
| 123911 | 1,4-диоксан (1,4-диэтиленоксид) |
| 122667 | 1,2-дифенилгидразин |
| 106898 | Эпихлоргидрин (1-хлор-2,3-эпоксипропан) |
| 106887 | 1,2-эпоксибутан |
| 140885 | Этилакрилат |
| 100414 | Этилбензол |
| 51796 | Этилкарбамат (уретан) |
| 75003 | Этилхлорид (хлорэтан) |
| 106934 | Этилендибромид (дибромэтан) |
| 107062 | Этилендихлорид (1,2-дихлорэтан) |
| 107211 | Этиленгликоль |
| 151564 | Этиленимин (азиридин) |
| 75218 | Этиленоксид |
| 96457 | Этилентиомочевина |
| 75343 | Этилидендихлорид (1,1-дихлорэтан) |
| 50000 | Формальдегид |
| 76448 | Гептахлор |
| 118741 | Гексахлорбензол |
| 87683 | Гексахлорбутадиен |
| 77474 | Гексахлорциклопентадиен |
| 67721 | Гексахлорэтан |
| 822060 | Гексаметилен-1,6-диизоцианат |
| 680319 | Гексаметилфосфорамид |
| 110543 | Гексан |
| 302012 | Гидразин |
| 7647010 | Соляная кислота |
| 7664393 | Фторид водорода (фтористоводородная кислота) |
| 7783064 | Сероводород (см. изменение) изменение) |
| 123319 | Гидрохинон |
| 78591 | Изофорон |
| 58899 | Линдан (все изомеры) |
| 108316 | Малеиновый ангидрид |
| 67561 | Метанол |
| 72435 | Метоксихлор |
| 74839 | Метилбромид (бромметан) |
| 74873 | Метилхлорид (Хлорметан) |
| 71556 | Метилхлороформ (1,1,1-трихлорэтан) |
| 78933 | Метилэтилкетон (2-бутанон) (см. изменение) |
| 60344 | Метилгидразин |
| 74884 | Метилиодид (йодметан) |
| 108101 | Метилизобутилкетон (гексон) |
| 624839 | Метилизоцианат |
| 80626 | Метилметакрилат |
| 1634044 | Метил-трет-бутиловый эфир |
| 101144 | 4,4-метилен-бис(2-хлоранилин) |
| 75092 | Метиленхлорид (дихлорметан) |
| 101688 | Метилендифенилдиизоцианат (МДИ) |
| 101779 | 4,4′-метилендианилин |
| Нафталин | |
| 98953 | Нитробензол |
| 92933 | 4-Нитробифенил |
| 100027 | 4-нитрофенол |
| 79469 | 2-нитропропан |
| 684935 | N-нитрозо-N-метилмочевина |
| 62759 | N-нитрозодиметиламин |
| 59892 | N-нитрозоморфолин |
| 56382 | Паратион |
| 82688 | Пентахлорнитробензол (Квинтобензол) |
| 87865 | Пентахлорфенол |
| 108952 | Фенол |
| 106503 | п-фенилендиамин |
| 75445 | Фосген |
| 7803512 | Фосфин |
| 7723140 | Фосфор |
| 85449 | Фталевый ангидрид |
| 1336363 | Полихлорированные бифенилы (Ароклорс) |
| 1120714 | 1,3-пропан сультон |
| 57578 | бета-пропиолактон |
| 123386 | Пропионовый альдегид |
| 114261 | Пропоксур (Байгон) |
| 78875 | Пропилендихлорид (1,2-дихлорпропан) |
| 75569 | Оксид пропилена |
| 75558 | 1,2-пропиленимин (2-метилазиридин) |
| Хинолин | |
| 106514 | Хинон |
| 100425 | Стирол |
| 96093 | Оксид стирола |
| 1746016 | 2,3,7,8-тетрахлордибензо-п-диоксин |
| 79345 | 1,1,2,2-тетрахлорэтан |
| 127184 | Тетрахлорэтилен (перхлорэтилен) |
| 7550450 | Титан тетрахлорид |
| 108883 | Толуол |
| 95807 | 2,4-толуолдиамин |
| 584849 | 2,4-толуолдиизоцианат |
| 95534 | о-толуидин |
| 8001352 | Токсафен (хлорированный камфен) |
| 120821 | 1,2,4-Трихлорбензол |
| 79005 | 1,1,2-Трихлорэтан |
| 79016 | Трихлорэтилен |
| 95954 | 2,4,5-Трихлорфенол |
| 88062 | 2,4,6-трихлорфенол |
| 121448 | Триэтиламин |
| 1582098 | Трифлуралин |
| 540841 | 2,2,4-триметилпентан |
| 108054 | Винилацетат |
| 593602 | Винилбромид |
| 75014 | Винилхлорид |
| 75354 | Винилиденхлорид (1,1-дихлорэтилен) |
| 1330207 | Ксилолы (изомеры и смеси) |
| 95476 | о-ксилолы |
| 108383 | м-ксилолы |
| 106423 | п-ксилолы |
| 0 | Соединения сурьмы |
| 0 | Соединения мышьяка (неорганические, включая арсин) |
| 0 | Соединения бериллия |
| 0 | Соединения кадмия |
| 0 | Соединения хрома |
| 0 | Соединения кобальта |
| 0 | Выбросы коксовых печей |
| 0 | Цианидные соединения 1 |
| 0 | Эфиры гликоля 2 (см. изменение) изменение) |
| 0 | Соединения свинца |
| 0 | Соединения марганца |
| 0 | Соединения ртути |
| 0 | Тонкие минеральные волокна 3 |
| 0 | Соединения никеля |
| 0 | Полициклические органические вещества 4 |
| 0 | Радионуклиды (включая радон) 5 |
| 0 | Соединения селена |
ПРИМЕЧАНИЕ: Ко всем приведенным выше спискам, которые содержат слово «соединения» и эфиры гликоля, применяется следующее: Если не указано иное, эти списки определяются как включающие любое уникальное химическое вещество, содержащее указанное химическое вещество (т.например, сурьма, мышьяк и т. д.) как часть инфраструктуры этого химического вещества.
1 — X’CN, где X = H’, или любая другая группа, в которой может иметь место формальная диссоциация. Например, KCN или Ca(CN)2
Например, KCN или Ca(CN)2
2 — включает моно- и диэфиры этиленгликоля, диэтиленгликоля и триэтиленгликоля R-(OCh3Ch3)n -OR’, где
n = 1, 2 или 3
R = алкильные или арильные группы R, H или группы, которые при удалении дают гликолевые эфиры со структурой: R-(OCh3CH)n-OH.Полимеры исключены из категории гликолей. (См. модификацию)
3 — Включает выбросы минерального волокна от объектов, производящих или перерабатывающих стеклянные, каменные или шлаковые волокна (или другие волокна, полученные из минерального сырья) со средним диаметром 1 микрометр или менее.
4 — Включает органические соединения, содержащие более одного бензольного кольца и имеющие точку кипения выше или равную 100 ºC.
5 — Тип атома, который самопроизвольно подвергается радиоактивному распаду.
Модификации
Загрязняющие вещества исключены из списка опасных загрязнителей атмосферного воздуха:
Метилэтилкетон — исключен из списка опасных загрязнителей воздуха в декабре 2005 г. — Федеральный реестр — 19 декабря 2005 г. (70 FR 75047).
— Федеральный реестр — 19 декабря 2005 г. (70 FR 75047).
Монобутиловый эфир этиленгликоля (ЭГБЭ) (2-бутоксиэтанол) — исключен из списка опасных загрязнителей воздуха (категория эфиров гликоля) в ноябре 2004 г. — Федеральный реестр — 29 ноября 2004 г. (69 FR 69320).
Капролактам — исключен из списка опасных загрязнителей воздуха в июне 1996 г. – Федеральный реестр – 18 июня 1996 г. (61 FR 30816).
Сероводород — добавлен в список непреднамеренно, но удален Конгрессом с одобрения президента в 1991 году.
Этоксилаты спиртов ПАВ и их производные — исключены из списка опасных загрязнителей воздуха в августе 2000 г. — Федеральный реестр — 2 августа 2000 г. (65 FR 47342). Чтобы реализовать это действие, EPA изменило сноску 2 списка (42 U.S.C. 7412(b)(1)) следующим образом:
2 — включает моно- и диэфиры этиленгликоля, диэтиленгликоля и триэтиленгликоля R-(OCH 2 CH 2 ) n -OR’ , где:
n = 1, 2 или 3 ;
R = алкил C7 или менее; или R = фенил или алкилзамещенный фенил;
R’ = H или алкил C7 или менее; или OR’, состоящий из сложного эфира карбоновой кислоты, сульфата, фосфата, нитрата или сульфоната.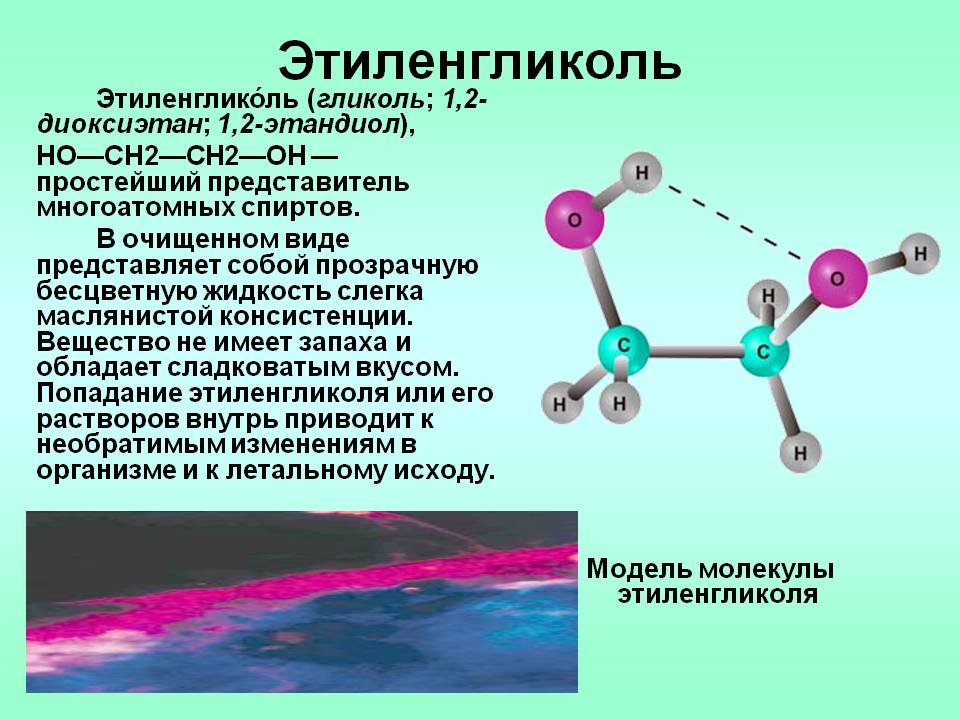
Загрязняющие вещества добавлены в список опасных загрязнителей воздуха:
1-бромпропан – 5 января 2022 г. Агентство по охране окружающей среды издало окончательное правило о добавлении 1-бромпропана (1-BP) в список опасных загрязнителей воздуха Закона о чистом воздухе. Выучить больше.
Повышение производства сахара из багассы сахарного тростника с помощью предварительной обработки этиленгликолем, подкисленным соляной кислотой, и поверхностно-активного вещества, авторы Yanting Lv, Zhengyu Chen, Huan Wang, Yongcang Xiao, Rongxin Ling, Weiqi Wei :: SSRN
21 страница Опубликовано: 7 декабря 2021 г.
Просмотреть все статьи Yanting LvНанкинский университет лесного хозяйства
Нанкинский университет лесного хозяйства
Нанкинский университет лесного хозяйства
Нанкинский университет лесного хозяйства
Нанкинский университет лесного хозяйства
Нанкинский университет лесного хозяйства 9000
Аннотация
В этой работе предварительная обработка этиленгликолем (EG), подкисленным HCl, использовалась для стимуляции высвобождения сахара из жома сахарного тростника (SCB). Результаты показали, что комбинация HCl и ЭГ может удалять ксилан (~ 100,0%) и лигнин (~ 61,3%) в SCB вместе, что в конечном итоге приводит к тому, что предварительно обработанный субстрат обладает хорошей эффективностью для последующего ферментативного гидролиза. Максимальный выход глюкозы в этой работе составил 93,9% и был получен после предварительной обработки при 130 ℃ в течение 60 минут 0,5% HCl и ферментативного расщепления в течение 72 часов. Анализ различных предварительно обработанных или необработанных SCB показал, что изменение морфологии поверхности и внутреннего состава SCB было основной причиной повышения эффективности гидролиза.Добавление Tween 80 в процесс гидролиза может значительно сократить время гидролиза и дозу целлюлазы с 72 до 36 часов и от 20 FPU/г субстрата до 10 FPU/г субстрата соответственно, сохраняя при этом относительно высокий выход глюкозы (91,4%).
Результаты показали, что комбинация HCl и ЭГ может удалять ксилан (~ 100,0%) и лигнин (~ 61,3%) в SCB вместе, что в конечном итоге приводит к тому, что предварительно обработанный субстрат обладает хорошей эффективностью для последующего ферментативного гидролиза. Максимальный выход глюкозы в этой работе составил 93,9% и был получен после предварительной обработки при 130 ℃ в течение 60 минут 0,5% HCl и ферментативного расщепления в течение 72 часов. Анализ различных предварительно обработанных или необработанных SCB показал, что изменение морфологии поверхности и внутреннего состава SCB было основной причиной повышения эффективности гидролиза.Добавление Tween 80 в процесс гидролиза может значительно сократить время гидролиза и дозу целлюлазы с 72 до 36 часов и от 20 FPU/г субстрата до 10 FPU/г субстрата соответственно, сохраняя при этом относительно высокий выход глюкозы (91,4%).
Ключевые слова: SCB, предварительная обработка HCl-EG, ферментативный гидролиз, глюкоза, твин 80
Рекомендуемое цитирование: Рекомендуемая ссылка
.




 Химическая стойкость. Температурная применимость. Коррозионная стойкость.
Химическая стойкость. Температурная применимость. Коррозионная стойкость. Что это такое?
Что это такое?
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.