Как получить этиленгликоль из этилена: №2. Как можно получить этиленгликоль? Составьте уравнение соответствующей реакции.
Формула этиленгликоля: как это вещество изменило нашу жизнь | Блог
Утро многих людей начинается похоже: выпиваем бутылку воды, заводим машину, чтобы поехать на работу, сидим в офисе, задумчиво глядя на стену с календарем, где уже отмечены даты отпуска. Но мало кто знает, что ничего этого бы не было, если бы не этиленгликоль (моноэтиленгликоль, или МЭГ), благодаря которому появилась пластиковая тара, антифриз и даже краска для стены. Рассказываем о незаменимых свойствах этиленгликоля и сферах его применения.
Рассказываем, что такое этиленгликольМногопрофильное вещество
Этиленгликоль – один из наиболее популярных видов нефтехимического сырья и компонент для многих промышленных продуктов. Это двухатомный спирт, который в очищенном виде выглядит, как бесцветная жидкость без запаха. Вещество достаточно токсично и отнесено к третьему классу опасности по международной классификации.
Формула этиленгликоля- в высокой концентрации он переносит нагрев почти до 200 градусов, что позволяет использовать их в теплоносителях;
- температура их кристаллизации в смеси с водой может опускаться вплоть до 75 градусов ниже нуля.
 Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
Но полвека с момента его открытия этиленгликоль фактически «пролежал на полке».
От нефти к «зеленым» технологиям. История создания этиленгликоля
История производства этиленгликоля началась в середине 19 века. Впервые это вещество в 1859 году синтезировал французский химик Шарль Адольф Вюрц. Вначале — из диацетата этиленгликоля, а в год спустя – гидратацией этиленоксида. Но потом еще полвека этиленгликоль не получал широкого распространения.
Его свойства оценили только в ходе Первой мировой войны. Германия начала применять этиленгликоль при производстве взрывчатки, используя в качестве сырья дихлорэтан. Следом были запущены мощности по его выпуску в США на базе этиленхлоргидрина.
Наиболее масштабное производство этиленгликоля начала компания Carbide в 1937 году, используя технологию газофазного окисления этилена и этиленоксида.
Монополия на такой способ производства сохранялась до 1953 года.
За счет низкой себестоимости и более конкурентного набора свойств к середине 20 века этиленгликоль полностью вытеснил глицерин из промышленного производства динамита, а также из состава охлаждающей жидкости, спрос на которую стремительно рос с развитием машиностроения.
Сейчас этиленгликоль производится в основном путем гидратации (присоединение молекул воды) оксида этилена. В одном из вариантов это происходит при давлении в 10 атмосфер и температуре около 180 градусов в присутствии кислотного катализатора. На выходе получается жидкость, содержащая до 90% чистого этиленгликоля.
Побочные продукты – диэтиленгликоль и триэтиленгликоль – также используются в промышленности, например, в дезинфекторах, системах охлаждения воздуха и при производстве пластификаторов.
Другой вариант синтеза МЭГ – гидратация этилена с участием серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов.
На фоне прогнозируемого сокращения добычи углеводородов повышается интерес к экологичным методам выпуска этиленгликоля. Американская компания IPCI нашла новый способ производства многоатомных спиртов из сахаров любого происхождения и уже запустила по этой технологии завод на 10 тыс. тонн продукции в год в Китае.
Запустить заводы по производству этиленгликоля из растительного сырья в середине 2020-ых годов планируется и в Европе.
После отвязки цены на МЭГ от нефтяных котировок, рынок станет прозрачнее, а сферы применения этиленгликоля могут расшириться за счет разработки новых продуктов.
Пластик, антифриз и краски. Где используется этиленгликоль?
Основная часть МЭГ идет на производство полиэтилентерефталата (ПЭТ). Это одна из разновидностей полимеров, продукт поликонденсации этиленгликоля с терефталевой кислотой. ПЭТ применяется для получения синтетических волокон, пленок и пластиковых бутылок.
Именно со сферой ПЭТ связаны позитивные перспективы роста объемов потребления этиленгликоля.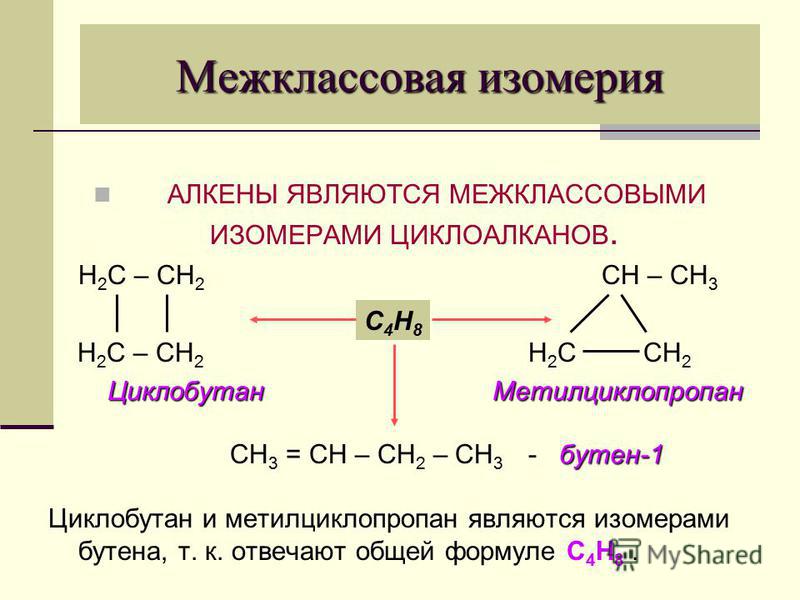 Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Эксперты уверены, что потребление ПЭТ, а, следовательно, и этиленгликоля будет расти в ближайшие годы, несмотря на запланированное ужесточение в ЕС и некоторых других странах норм использования продукции из полиэтилентерефталата. Тем более что сроки внедрения новых требований существенно сдвинулись вправо из-за ситуации с коронавирусом, которая повысила спрос на одноразовую пластиковую посуду и тару.
Алексей Костин, генеральный директор Центра отраслевых исследований
Хотя ПЭТ незаменим во многих областях, этот продукт из первичного сырья будет замещать его рециркулированная версия из вторсырья. Степень влияния будет зависеть от регулирования в странах потребления ПЭТ, которые могут ввести обязательный норматив на r-PET в волокне или взять на себя какие-либо обязательства в области текстильного бизнеса.
Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.
Еще один крупный сектор применения этиленгликоля в качестве сырья – изготовление охлаждающих жидкостей. Добавленный в воду МЭГ мешает ей замерзнуть в ледяной монолит, что является угрозой для двигателя, и помогает сформировать отдельные ледяные кристаллы, которые не препятствуют запуску мотора.
Благодаря низкой температуре замерзания в смеси с водой, этиленгликоль используются в противообледенительных жидкостях для авиации, которыми самолеты покрывают перед взлетом.
В качестве компонента антифриза МЭГ впервые стали использоваться еще в 1926 году, а более масштабное применение началось незадолго до Второй мировой войны в основном в военной технике.
На тот момент мало кто обращал внимание на главную проблему охлаждающих жидкостей с использованием этиленгликолей – коррозию металла двигателя от соприкосновения с ним.
Во многом это объяснялось тем, что детали были чугунные, а радиаторы – латунные.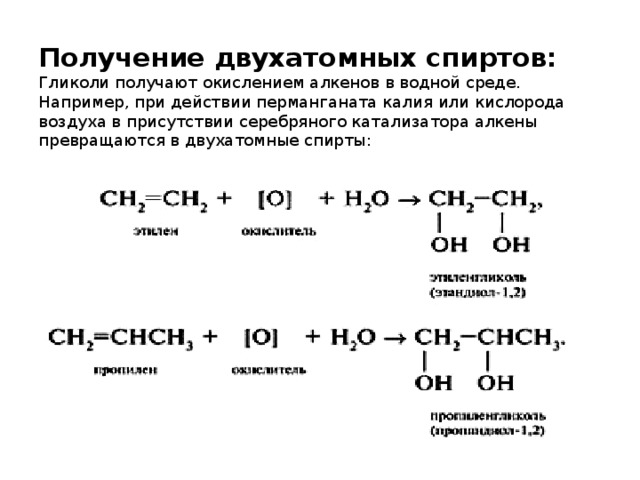 Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Этиленгликоль широко используется при производстве красок как растворитель. В текстильном секторе он применяется для формирования тканей и скручивания нитей, а также как один из главных составляющих красителей для кожи.
Многообещающая динамика
Объемы производства этиленгликоля, которые уже сейчас в мире приближаются к 30 млн. тонн, постоянно увеличиваются.
В Китае к 2020 году их выпуск за последние пять лет вырос на треть, превысив 10 млн. тонн. Еще около 6 млн. тонн производит второй по величине экспортер – Саудовская Аравия.
По прогнозам экспертов, как минимум до 2025 года динамика роста спроса на МЭГ составит 5-6% в год. Россия пока не занимает существенной доли в мировом производстве. В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
Подробнее о том, как будет развиваться рынок этиленгликоля, читайте в статье «5 лет спрос будет расти, но потом все изменится. Что ждет рынок этиленгликоля в ближайшие 10 лет?»
Благодаря возможности разностороннего применения, этиленгликоль стал незаменимым компонентом для многих промышленных отраслей. При этом экономическая эффективность его применения и перспективы дальнейшего развития в качестве экологичного сырья гарантируют МЭГ стабильный спрос еще долгие годы.
Получение — этиленгликоль — Большая Энциклопедия Нефти и Газа, статья, страница 2
Cтраница 2
Технологическая схема получения этиленгликоля гидратацией этиленоксида изображена на рис. 3.37. Этиленоксид из емкости / под давлением 2 МПа подают в эжектор 4 на смешение с обессоленной водой и водно-гликолевым дистиллятом. [16]
[16]
Промышленным способом получения этиленгликоля является жидкофазная гидратация окиси этилена ( стр. [17]
По схеме получения этиленгликоля Dow Chemical of Canada [99] окись этилена и вода в соотношении 1: 8 смешиваются под давлением, и смесь подогревается до 100 С. За счет теплоты реакции температура в гидрататоре повышается до 165 — 185 ГС. [18]
Другой промышленный способ получения этиленгликоля заключается в действии окиси углерода на формальдегид. В результате конденсации образуется гликолевая кислота, метиловый эфир которой восстанавливают в паровой фазе в этиленгликоль ( гл. Последний способ нельзя использовать для производства окиси этилена; хотя теоретически этиленгликоль и может превратиться при повышенной температуре и низком давлении в окись этилена, на практике основными продуктами реакции, проведенной при этих условиях, являются ацетальдегид или диоксан, более устойчивые, чем окись этилена.
В большинстве способов получения этиленгликоля гидролизом окиси этилена получаются только 15 — 20 % водные растворы этиленгликоля, загрязненные большим или меньшим количеством полигликолей. [20]
Представляет интерес метод получения этиленгликоля через этиленкар-бонат. Сущность метода заключается в том, что в присутствии диоксида углерода и катализатора проводят гидратацию этиленоксида в этиленкарбонат. Его подвергают гидролизу с образованием этиленгликоля. Способ интересен тем, что получаемый Этиленгликоль содержит незначительное количество воды и поэтому не требуется сооружение выпарных установок для концентрирования этиленгликоля перед ректификацией. [21]
В большинстве способов получения этиленгликоля гидролизом окиси этилена получаются только 15 — 20 % водные растворы этиленгликоля, загрязненные большим или меньшим количеством полигликолей. [22]
Другой промышленный способ получения этиленгликоля заключается в действии окиси углерода на формальдегид. В результате конденсации образуется гликолевая кислота, метиловый эфир которой восстанавливают в паровой фазе в этиленгликоль ( гл. Последний способ нельзя использовать для производства окиси этилена; хотя теоретически этиленгликоль и может превратиться при повышенной температуре и низком давлении в окись этилена, на практике основными продуктами реакции, проведенной при этих условиях, являются ацетальдегид или диоксан, более устойчивые, чем окись этилена.
[23]
В результате конденсации образуется гликолевая кислота, метиловый эфир которой восстанавливают в паровой фазе в этиленгликоль ( гл. Последний способ нельзя использовать для производства окиси этилена; хотя теоретически этиленгликоль и может превратиться при повышенной температуре и низком давлении в окись этилена, на практике основными продуктами реакции, проведенной при этих условиях, являются ацетальдегид или диоксан, более устойчивые, чем окись этилена.
[23]
Так например в процессе получения этиленгликоля, в холодный 5 % — ный раствор гипохлорита, содержащий 45 кг хлорноватистокис-лого натрия, пропускают 14 м3 этилена и 7 м3 двуокиси углерода. Этилен вводится в раствор в виде весьма мелких пузырьков. Двуокись углерода подается в охлаждаемую жидкость, для поддержания концентрации хлорноватистой кислоты на достаточно низком уровне, с весьма небольшой скоростью. Затем раствор этиленхлоргидрина кипятят несколько часов для гидролиза в гликоль. [24]
Улавливание хлористого винила при получении этиленгликоля из дихлорэтана, Отч.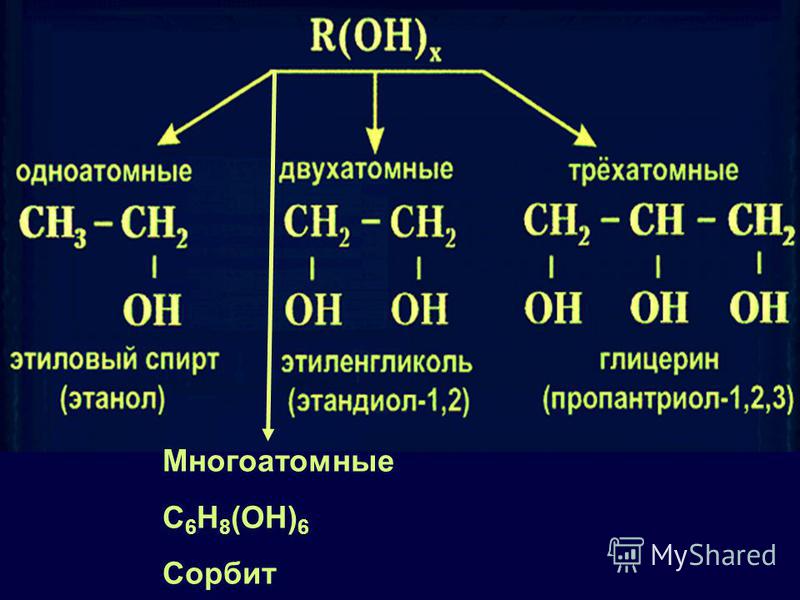 [25]
[25]
| Фазовое равновесие жидкость — пар системы 1 2-пропиленгликоль — этиленгликоль при 1 33 кПа. [26] |
В начале раздела рассмотрены методы получения этиленгликоля из этилена или его производных, затем из метанола или формальдегида и дано описание процессов получения этиленгликоля по методам, которые были реализованы в промышленности. В настоящее время в промышленности этиленгликоль производится практически только одним методом — гидратацией окиси этилена. [27]
На ней приведены два способа получения этиленгликоля — гидратацией окиси этилена и конденсацией формальдегида. Последний способ, применяемый в США в промышленности [86, 88], состоит из трех стадий. [28]
Практически вся аппаратура описанной установки для получения этиленгликоля была изготовлена из углеродистой стали. [29]
Окись этилена, исходное сырье для получения этиленгликоля и других органических продуктов, получается окислением этилена кислородом воздуха на серебряном катализаторе.
Страницы: 1 2 3 4
Каковы пути воздействия этиленгликоля?
- Цели обучения
- ВВЕДЕНИЕ
- Dermal
- Ингаляция
- Приглашение
- Ключевые моменты
- Проверка прогресса
Курс: WB 4342
. : 20 марта 2022 г.
Срок действия CE: 20 марта 2024 г.
Загрузить версию для печати [PDF – 954 КБ]
После завершения этого раздела вы сможете определить наиболее распространенный путь воздействия этиленгликоля, который приводит к токсичности среди населения США в целом .
Случайное или преднамеренное проглатывание антифриза является наиболее распространенным путем воздействия, приводящим к токсичности этиленгликоля, что приводит к тысячам случаев отравления, о которых ежегодно сообщается в Соединенных Штатах (AAPCC 2016; ATSDR 2010).
Не ожидается, что этиленгликоль будет обнаружен в окружающей среде вдали от мест, где он высвобождается. За пределами этих районов у населения мало риска заражения через воздух, питьевую воду или контакт кожи с водой или почвой.
За пределами этих районов у населения мало риска заражения через воздух, питьевую воду или контакт кожи с водой или почвой.
Контакт с кожей является наиболее вероятным путем профессионального воздействия. Однако абсорбция через кожу ограничена, и воздействие таким путем, как правило, не приводит к токсическим эффектам.
Воздействие этиленгликоля на кожу может произойти при работе с
- автомобильными антифризами, охлаждающие жидкости
- и Тормозные жидкости
- .
Такое воздействие вряд ли вызовет неблагоприятные последствия для здоровья.
К началу страницы
Низкое давление паров этиленгликоля предотвращает существенное вдыхание при температуре окружающей среды (Howard PH 1991). Раздражение верхних дыхательных путей возможно при нагревании, взбалтывании или распылении жидкости.
Начало страницы
Случайное или преднамеренное проглатывание антифриза является наиболее распространенным путем воздействия, приводящим к токсичности этиленгликоля, что приводит к тысячам случаев отравления, о которых ежегодно сообщается в Соединенных Штатах (AAPCC 2016; ATSDR 2010)].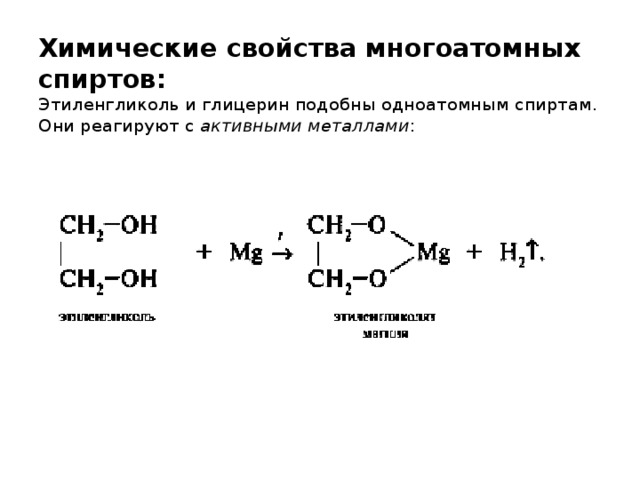
Среди населения США в целом воздействие этиленгликоля чаще всего происходит при проглатывании антифриза. В ежегодных отчетах Американской ассоциации токсикологических центров (AAPCC) сообщается о
- 6600 отравлений этиленгликолем и 16 смертей в 2013 г.,
- 6809 отравлений этиленгликолем и 26 смертей в 2014 г. и
- 6 895 отравлений этиленгликолем и 22 случая смерти в 2015 г.
К началу страницы
- Случайное или преднамеренное проглатывание антифриза является наиболее распространенным путем воздействия, приводящим к токсичности этиленгликоля, что приводит к тысячам случаев отравления, о которых ежегодно сообщается в Соединенных Штатах.
- Вдыхание атмосферного воздуха, прием внутрь питьевой воды или кожный контакт с водой или почвой не считаются значительными путями воздействия на население США в целом.
К началу страницы
К началу страницы
Для просмотра соответствующего содержимого см. раздел «Прием данных» в этом разделе.
раздел «Прием данных» в этом разделе.
Этиленгликол 99%- 1 галлон
Продукт SDS Leale
Этиленгликол 99%
из Wikipedia, Free Encylopedia
19, Ethylenea,
1919, Monylene, Monylenia
1919191919191919191919191919.19191919191919191919.1919191919191919191919.19.1919191919191919. этан-1,2-диол
История
При первом появлении он произвел небольшую революцию в конструкции самолетов, поскольку при использовании вместо воды в качестве охлаждающей жидкости двигателя его более высокая температура кипения позволяла использовать радиаторы меньшего размера, работающие при более высоких температурах. До того, как этиленгликоль стал широко доступен, многие производители самолетов пытались использовать системы испарительного охлаждения, в которых использовалась вода под высоким давлением. Они неизменно оказывались довольно ненадежными и легко повреждались в бою, потому что занимали много места в самолете, где по ним легко стреляли.
До того, как этиленгликоль стал широко доступен, многие производители самолетов пытались использовать системы испарительного охлаждения, в которых использовалась вода под высоким давлением. Они неизменно оказывались довольно ненадежными и легко повреждались в бою, потому что занимали много места в самолете, где по ним легко стреляли.
Производство
Этиленгликоль получают из этилена через промежуточный этиленоксид. Оксид этилена реагирует с водой с образованием этиленгликоля в соответствии с химическим уравнением
C 2 H 4 O + H 2 O ? HOCH 2 CH 2 OH
Эта реакция может катализироваться кислотами или основаниями или может происходить при нейтральном pH при повышенных температурах. Наибольший выход этиленгликоля наблюдается при кислом или нейтральном рН с большим избытком воды. В этих условиях выход этиленгликоля составляет 90% может быть достигнуто. Основными побочными продуктами являются олигомеры этиленгликоля, диэтиленгликоль, триэтиленгликоль и тетраэтиленгликоль.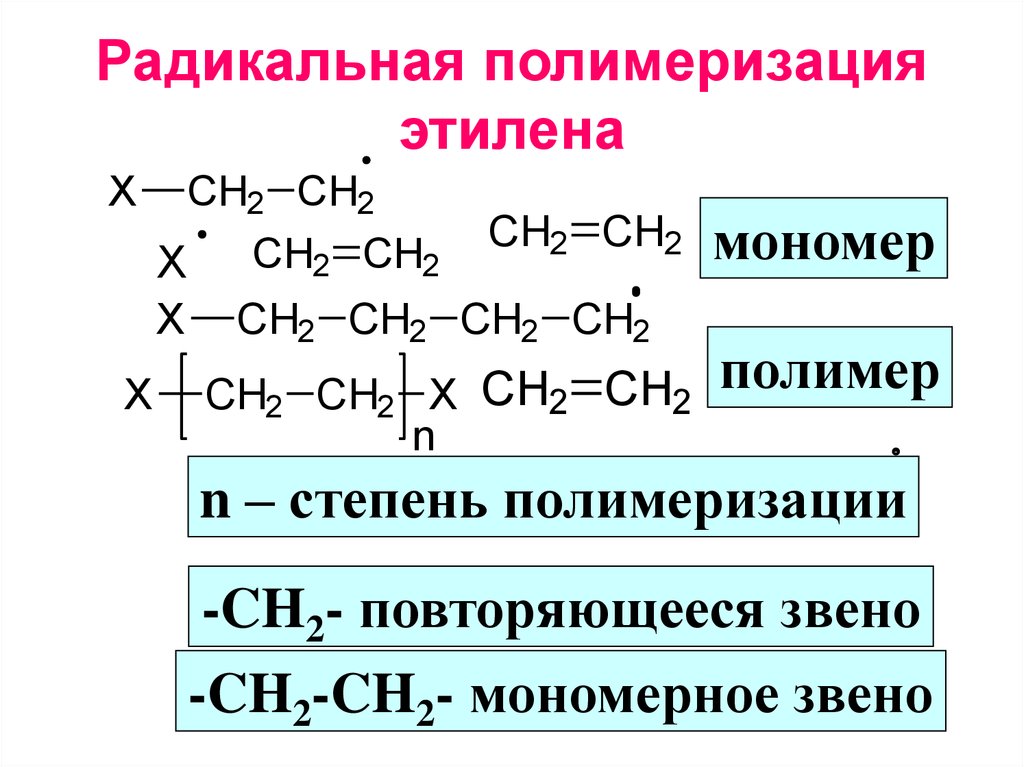
Применение
В основном этиленгликоль используется в качестве охлаждающей жидкости или антифриза, например, в автомобилях и персональных компьютерах. Из-за низкой температуры замерзания он также используется в качестве жидкости против обледенения для ветровых стекол и самолетов. Этиленгликоль приобретает все большее значение в производстве пластмасс для производства полиэфирных волокон и смол, включая полиэтилентерефталат, который используется для изготовления пластиковых бутылок для безалкогольных напитков. Антифризные свойства этиленгликоля сделали его важным компонентом витрифицирующих смесей для низкотемпературной консервации биологических тканей и органов.
Незначительные применения этиленгликоля включают производство конденсаторов, в качестве промежуточного химического вещества при производстве 1,4-диоксана и в качестве добавки для предотвращения роста водорослей в системах жидкостного охлаждения для персональных компьютеров.
Высокая температура кипения этиленгликоля и его сродство к воде делают его идеальным осушителем для производства природного газа. В полевых условиях избыток водяного пара обычно удаляют путем дегидратации гликоля. Гликоль стекает с вершины колонны и встречается снизу с восходящей смесью водяного пара и углеводородных газов. Гликоль химически удаляет водяной пар, позволяя сухому газу выходить из верхней части колонны. Гликоль и вода разделяются, и гликоль снова проходит через колонну.
В полевых условиях избыток водяного пара обычно удаляют путем дегидратации гликоля. Гликоль стекает с вершины колонны и встречается снизу с восходящей смесью водяного пара и углеводородных газов. Гликоль химически удаляет водяной пар, позволяя сухому газу выходить из верхней части колонны. Гликоль и вода разделяются, и гликоль снова проходит через колонну.
Этиленгликоль обычно используется в лабораториях для осаждения белков в растворе. Часто это промежуточный этап фракционирования, очистки и/или кристаллизации. Его можно использовать для защиты функциональных групп от реакции во время органического синтеза. Чтобы вернуть функциональной группе ее первоначальный состав, просто добавьте воду и кислоту.
Этиленгликоль нашел применение в качестве средства для обработки древесины от гнили и грибка, как в качестве профилактического средства, так и в качестве лечения постфактум. В некоторых случаях он использовался для обработки частично сгнивших деревянных предметов, которые будут выставлены в музеях. Это один из немногих методов лечения, которые успешно борются с гнилью в деревянных лодках и относительно дешевы.
Это один из немногих методов лечения, которые успешно борются с гнилью в деревянных лодках и относительно дешевы.
Этиленгликоль обычно используется в качестве консерванта для образцов в школах, часто во время вскрытия. Говорят, что он безопаснее формальдегида, но безопасность сомнительна.
Токсичность
Основная опасность этиленгликоля связана с проглатыванием. Из-за его сладкого вкуса дети и животные иногда потребляют его в больших количествах, если им предоставляется доступ к антифризу. Этиленгликоль также может быть обнаружен в качестве загрязняющего вещества в виски (самогоне), полученном незаконной перегонкой, изготовленном в перегонном аппарате, построенном с использованием неправильно вымытого автомобильного радиатора. В развитых странах горький агент, называемый денатония/денатония бензоат, обычно добавляют к препаратам на основе этиленгликоля в качестве противодействующего фактора (для предотвращения случайного проглатывания). Если кто-то проглотил этиленгликоль, дайте ему алкогольный напиток, пока не прибудут фельдшеры. Алкоголь действует как конкурентный ингибитор активного центра фермента, который превращает этиленгликоль в его токсичную форму. Как только алкоголь связывается, этиленгликоль безвредно выводится из организма.
Алкоголь действует как конкурентный ингибитор активного центра фермента, который превращает этиленгликоль в его токсичную форму. Как только алкоголь связывается, этиленгликоль безвредно выводится из организма.
Отравление этиленгликолем требует неотложной медицинской помощи, и во всех случаях следует обратиться в токсикологический центр или обратиться за медицинской помощью. Он очень токсичен, расчетная LD100 для человека составляет примерно 1,4 мл/кг. Однако даже 30 миллилитров (2 столовые ложки) могут быть смертельными для взрослых.
Симптомы
Симптомы отравления этиленгликолем обычно развиваются в три этапа, хотя у отравленных людей не всегда развивается каждая стадия или они следуют определенным временным рамкам. Стадия 1 состоит из неврологических симптомов, включая состояние опьянения жертвы, проявляющееся такими симптомами, как головокружение, головные боли, невнятная речь и спутанность сознания. Со временем организм метаболизирует этиленгликоль в другие токсины, сначала он метаболизируется в гликоальдегид, который затем окисляется до гликолевой кислоты, глиоксиловой кислоты и, наконец, щавелевой кислоты.

 Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%. Монополия на такой способ производства сохранялась до 1953 года.
Монополия на такой способ производства сохранялась до 1953 года. Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.
Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.